СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
- АВ – атриовентрикулярная
- АВР – активированное время рекальцификации
- АГ – артериальная гипертония
- АД – артериальное давление
- АЧТВ – активированное частичное тромбопластиновое время
- В/в – внутривенное
- ВОЗ – Всемирная организация здравоохранения
- ВСС – внезапная сердечная смерть
- ЖТ – желудочковые тахикардии
- ЛЖ – левый желудочек
- ЛП – левое предсердие
- МНО – международное нормализованное отношение
- НЖТ – наджелудочковая тахикардия
- НМГ – низкомолекулярный гепарин
- НФГ – нефракционированный гепарин
- ОПРТ – очаговая предсердная реципрокная тахикардия
- П/к – подкожно
- ПАВРТ – пароксизмальная атриовентрикулярная реципрокная тахикардия
- ПАВУРТ – пароксизмальная атриовентрикулярная узловая реципрокная тахикардия
- СЗП – свежезамороженная плазма
- СН – сердечная недостаточность
- Ст. – степень
- ТП – трепетание предсердий
- ТЭО – тромбоэмболические осложнения
- ФВ – фракция выбора
- ФЖ – фибрилляция желудочков
- ФП – фибрилляция предсердий
- ФР – фактор риска
- ЧСС – частота сердечных сокращений
- ЭИТ – электроимпульсная терапия
- ЭКГ – электрокардиография
- ЭКС – электрокардиостимуляция
- Эхо-КГ – эхокардиография
- PAI-1 – ингибитор активатора плазминогена-1
- PAI-2 – ингибитор активатора плазминогена 2
- TAFI – активируемый тромбином ингибитор фибринолиза
- WWW – синдром Wolf–Parkinson–White
1. КЛАССЫ РЕКОМЕНДАЦИЙ И УРОВНИ ДОКАЗАТЕЛЬНОСТИ
Для оценки клинической значимости и целесо-образности всех предлагаемых в данном документе подходов рабочая группа пользовалась общепринятыми классами рекомендаций (табл. 1) и уровнями доказательности (табл. 2).
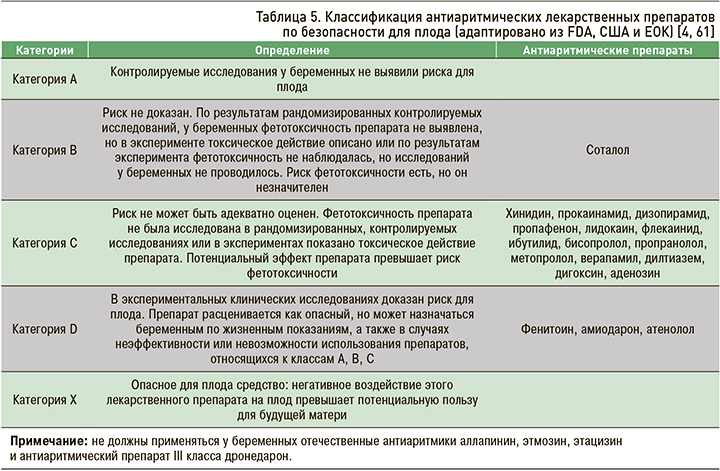
При рекомендации применения лекарственных препаратов у беременных использовалась классификация их безопасности для плода, влияние лекарственного средства на физиологическое течение беременности, предложенная Управлением по контролю качества пищевых продуктов и лекарств (Food and Drug Administration, FDA) (табл. 3).

2. ВЕДЕНИЕ БЕРЕМЕННЫХ С ПРОТЕЗИРОВАННЫМИ КЛАПАНАМИ СЕРДЦА
Беременность рассматривают как тромбофилическое состояние, при котором активация внутрисосудистого тромбогенеза выражена вследствие перестройки свертывающей, противосвертывающей и фибринолитической систем, что отражает эволюционное приспособление женского организма к уменьшению кровопотери в родах после отделения плаценты. Физиологическая перестройка всех звеньев системы гемостаза, приводящая к гиперкоагуляции, обусловлена следующими особенностями:
- повышением резистентности к активированному протеину C во II и III триместрах;
- снижением активности протеина S вследствие уменьшения общего количества протеина S под действием эстрогенов и повышения уровней протеина, связывающего компонент комплемента 4b, который взаимодействует с протеином S;
- повышением уровня фибриногена и факторов II, VII, VIII и X;
- увеличением уровней и активности ингибиторов фибринолиза, активируемого тромбином ингибитора фибринолиза (TAFI), ингибиторов активатора плазминогена (PAI-1 и PAI-2).
Активность прокоагулянтных факторов повышается со II триместра беременности. В III триместре наблюдается прогрессивное увеличение фактора Виллебранда, продуцируемого эндотелием. Повышается концентрация факторов IX, VIII, VII (на 80%), Х, V, II (от 70 до 100% по сравнению с уровнем небеременных и беременных I триместра). Отражением повышения содержания факторов внутреннего пути свертывания является укорочение активированного частичного тромбопластинового времени (АЧТВ) во II и особенно в III триместрах беременности. Повышение протромбинового индекса к концу III триместра беременности указывает на увеличение активности и рост синтеза факторов внешнего пути коагуляционного каскада (II, V, VII, Х факторов). Увеличивается образование тромбина, содержание продуктов деградации фибрина в ответ на интра- и экстраваскулярное отложение фибрина, что указывает на интенсификацию процессов внутрисосудистого свертывания крови и активацию системы свертывания крови в маточно-плацентарном кровотоке.
Одновременно с началом II триместра происходит постепенное снижение антикоагулянтного потенциала крови. Концентрация антитромбина III снижается перед родами, а его активность растет. Остается неизменным уровень протеина C, наблюдается снижение концентрации его кофермента – протеина S. При физиологической беременности отмечаются изменения в системе фибринолиза: значительно увеличивается уровень РАI-1, продуцируемого эндотелием, кроме того, плацента начинает синтезировать PAI-2.
Во время родов наблюдается повышенное потребление тромбоцитов и факторов коагуляции, в том числе фибриногена. При лабораторном исследовании системы гемостаза в родах повышается активность фактора VIII, увеличиваются концентрация фибриногена, толерантность плазмы к гепарину, количество растворимых фибрин-мономерных комплексов и Д-димера в результате усиления фибринолиза. В послеродовом периоде растет уровень t-PA, снижается PAI-1 и PAI-2, происходит укорочение АЧТВ, активированного времени рекальцификации (АВР). Содержание Д-димера повышается в первые 5 дней после родов по причине активного фибринолиза массы «молодых» тромбов, сформировавшихся в маточных сосудах на маточно-плацентарной площадке. Нормализация параметров системы гемостаза происходит в течение 4–6 нед после родов.
Таким образом, даже при физиологическом течении беременности в ≈6 раз повышается риск венозных тромбоэмболических осложнений (ТЭО) за счет обструкции венозного возврата растущей маткой, венозной атонии, перечисленных изменений в системе гемостаза, что и является главной причиной смертности женщин во время беременности и родов.
Все беременные с искусственными клапанами сердца относятся к категории высокого риска сердечно-сосудистых осложнений (ВОЗ III). Согласно приказу Минздрава России от 01.11.2012 № 572н со ссылкой на приказ от 03.12.2007 № 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» (с изменениями и дополнениями), планирование беременности и прерывание беременности по медицинским показаниям показано следующей категории женщин после протезирования искусственными или биологическими трансплантатами (при ревматических или врожденных пороках сердца):
- одного клапана сердца с признаками нарушения функции протеза;
- при многоклапанном протезировании;
- в случае ТЭО осложнений во время беременности или в анамнезе, а также при наличии тромба в полостях сердца.
Беременность и роды у женщин с протезированными клапанами сердца обычно сопряжены с высоким риском, связанным прежде всего с необходимостью использования антикоагулянтов. По данным литературы, частота ТЭО у пациенток с клапанными механическими протезами при беременности колеблется от 7,5 до 33% [1]. Регистр беременных с сердечно-сосудистыми заболеваниями (ROPAC), в который в настоящее время включено 212 беременных с механическим протезом клапанов сердца, показал, что тромбоз протеза произошел у 10 (4,7%) пациенток, смертность составила 1,4%, геморрагические осложнения у матери регистрировались в 23,1% случаев [2].
Вопрос о выборе между биопротезами и механическими протезами клапанов сердца у женщин детородного возраста остается нерешенным. Механические клапаны прочны, характеризуются отличными гемодинамическими характеристиками, но требуют пожизненной антикогуляции. Использование биопротезов сопряжено с гораздо меньшим риском ТЭО, однако они недолговечны, хотя четких данных об увеличении риска дегенерации биопротеза в связи с беременностью и родами получено не было. Вместе с тем срок службы биопротезов по-прежнему остается небольшим, и больные должны осознавать неизбежность повторной операции через несколько лет. По крайней мере половина биопротезов, имплантируемых женщинам детородного возраста, требует замены в течение 10 лет, а через 15 лет функция биопротеза нарушается у 90% пациенток. Риск дегенерации биопротеза значительно возрастает при его положении в митральной позиции по сравнению с биопротезами аортального и трикуспидального клапанов. При повторных операциях по протезированию клапанов сердца летальность, по разным данным, колеблется от 3 до 9%. Наличие факторов риска (ФР) тромбоза биопротеза – фибрилляция предсердий (ФП), наличие тромба в полостях сердца диктует необходимость проведения антикоагулянтной терапии у этих пациенток.
Возможность тромбоза искусственного клапана сердца определяется несколькими факторами:
1. исходной тромбогенностью протеза, зависящей от типа протеза:
- низкой тромбогенности – Carbomedics (аортальный), Medtronic Hall, St Jude Medical;
- средней тромбогенности – Bjork-Shiley и другие двустворчатые протезы;
- высокой тромбогенности – Lillehei-Kaster, Omniscience, Starr-Edwards;
2. ФР тромбоза протеза клапана, к которым относятся:
- митральная, трикуспидальная или легочная позиции протеза;
- предшествующие ТЭО;
- ФП;
- диаметр левого предсердия (ЛП) >50 мм;
- спонтанное контрастирование в ЛП;
- митральный стеноз;
- фракция выброса (ФВ) <35%;
- гиперкоагуляция.
Клинически тромбоз искусственного клапана сердца проявляется одышкой или приступом удушья, в ряде случаев отеком легких, инсультом, артериальными эмболиями, кардиогенным шоком и смертью.
Диагноз тромбоза клапана должен быть подтвержден при стандартной или чреспищеводной эхокардиографии (ЭхоКГ). В случае выявления при ЭхоКГ тромба менее 5 мм в диаметре и не обтурирующего клапана рекомендовано проведение антикоагулянтной терапии внутривенным введением нефракционированного гепарина (НФГ) с дальнейшим возобновлением приема пероральных антикоагулянтов у пациенток, которые не находятся в критическом состоянии. В случае наличия тромба более 5 мм в диаметре рекомендуется проведение тромболитической терапии, эффективность которой составляет 70% при смертности 9–10%. Тромболизис наиболее эффективен при аортальной локализации протеза, а также если со времени появления симптомов прошло менее 2 нед. Большинство фибринолитических препаратов не проникают через плаценту, однако они могут вызвать эмболии (10%) и субплацентарное кровотечение. Опыт применения фибринолитиков у беременных женщин ограничен. Фибринолиз обоснован, если женщина находится в критическом состоянии, а немедленное хирургическое вмешательство невозможно. При неэффективности антикоагуляции и обструкции кровотока показано хирургическое вмешательство [3].
Нередко определяющей неблагоприятные исходы беременности остается проблема использования антикоагулянтов у женщин с механическими протезами клапанов, так как, помимо вышеперечисленных факторов, решающее значение нередко имеют:
- состояние физиологической гестационной гиперкоагуляции;
- эмбриотоксический эффект антагонистов витамина K, рекомендуемых в качестве препаратов первого ряда у пациентов с искусственными клапанами, так как варфарин проходит через плаценту и повышает риск раннего выкидыша, эмбриопатий (назальная гипоплазия, хондродисплазии, атрофия зрительного нерва, микроцефалия, отставание в умственном развитии) и преждевременных родов в 4–10% наблюдений.
Распространенность эмбриопатий до сих пор остается предметом дискуссий: суммарный риск составляет ≈5% у пациенток, получавших антагонисты витамина K между 6-й и 12-й неделями беременности, тогда как в ряде сообщений дается более низкий риск фетопатий и рассматривается их связь с дозой препарата. Так, метаанализ, в который было включено 494 беременности у женщин с искусственными механическими клапанами сердца, продемонстрировал, что, если пациентка принимала варфарин в дозе 5 мг и менее, то в 13,4% наблюдались осложнения со стороны плода, среди которых в 4 случаях (0,9%) были эмбриопатии. Осложнения со стороны матери встречались относительно редко: кровотечения 3,4%, ТЭО 1,8%.
В случае приема женщиной варфарина в дозе более 5 мг (33 беременности) осложнения со стороны плода прогрессивно возрастали (82%, из них 2 случая варфаринзависимых эмбриопатий), осложнений со стороны матери не было, по-видимому, из-за небольшого числа наблюдений [4, 5].
Необходимо помнить, что для пациенток с искусственными клапанами сердца характерны преждевременные роды и фетоплацентарная недостаточность, что может потребовать экстренного родоразрешения. При ургентной акушерской ситуации (отслойка плаценты, экстренное кесарево сечение) у женщин, получающих антикоагулянты, может развиться катастрофическое кровотечение. Варфарин характеризуется пролонгированным эффектом, который нельзя быстро прекратить. Эффект при назначении витамина К достигается только в течение 24 ч. Немедленное замещение витамин К-зависимых факторов свертывания крови возможно только при использовании свежезамороженной плазмы, однако у плода уровень этих факторов восстанавливается только через 7–9 дней после отмены варфарина.
У пациенток с протезированными клапанами целевое международное нормализованное отношение (МНО) не отличается от такого вне беременности, и дозы варфарина обычно не меняются. В зависимости от позиции протеза клапана показаны цифры МНО 2,0–3,5. Следует подчеркнуть, что целевые значения МНО от 2,0 до 3,0 во время беременности могут быть адекватными только у пациенток с более низким риском тромбозов, тогда как у женщин с протезами первого поколения и/или дополнительными отягощающими факторами (ТЭО в анамнезе, нарушениями сердечного ритма, наличием тромба в полости сердца и др.) стоит добиваться более высокого уровня антикоагуляции (МНО 2,5–3,5).
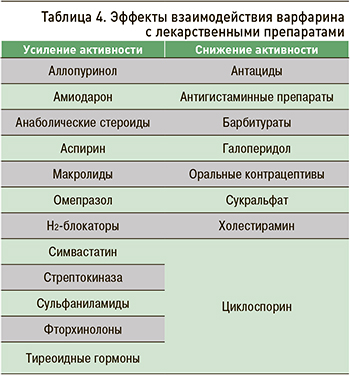 Варфарин при совместном приеме с другими лекарственными препаратами может усиливать или ослаблять свое действие (табл. 4).
Варфарин при совместном приеме с другими лекарственными препаратами может усиливать или ослаблять свое действие (табл. 4).
Главным осложнением со стороны матери при использовании варфарина являются кровотечения. ФР развития кровотечения служат:
- интенсивное воздействие антикоагулянтов;
- сопутствующие заболевания;
- применение других препаратов;
- неточное следование инструкции по применению варфарина.
Признаки кровотечения при лечении антикоагулянтами:
- кровь в стуле и моче;
- образование синяков;
- необычно обильные носовые кровотечения/кровоточивость десен;
- кровотечения из патологических образований (опухоль, язва и др.).
При назначении варфарина должны также учитываться судебно-медицинские аспекты, так как фирмы-производители указывают его как препарат, противопоказанный при беременности.
Альтернативой варфарину может служить нефракционированный гепарин (НФГ), который не проникает через плаценту, но длительная гепаринотерапия во время беременности трудно осуществима и значительно увеличивает риск ТЭО для матери. Так, по данным ряда авторов, у беременных с искусственными клапанами сердца в случае применения НФГ в течение всего периода беременности в 23,8% наблюдались выкидыши и в 42,9% – выкидыши и гибель плода. При его применении с 6-й по 12-ю недели беременности у 3,4% женщин регистрировались эмбриопатии, у 24,8% – выкидыши и у 26,5% женщин – выкидыши и гибель плода. Со стороны матери при использовании НФГ в течение всего периода беременности у 33,3% имели место ТЭО, смертность достигала 15%. Если НФГ назначали с 6-й по 12-ю недели беременности, то ТЭО развивались в 9,2% случаев, смертность составила 4,2% [6, 7].
Следует подчеркнуть, что при принятии решения о применении НФГ у беременных с протезированными клапанами сердца надеяться на успех можно только в случае выбора адекватной (лечебной!) дозы препарата и регулярного контроля состояния системы гемостаза. Хотя терапевтическая доза НФГ подразумевает удлинение активированного частичного тромбопластинового времени (АЧТВ) в 1,5 раза, для обеспечения антитромботического эффекта у беременных с протезированными клапанами сердца этого может оказаться недостаточно, поэтому у таких пациенток необходимо добиваться удлинения АЧТВ примерно в 2 раза по сравнению с контрольными значениями.
Противопоказаниями к назначению НФГ являются:
- исходная глубокая гипокоагуляция;
- язвенная болезнь желудка или двенадцатиперстной кишки;
- неконтролируемая артериальная гипертензия (АГ);
- инфекционный эндокардит;
- острое внутреннее кровотечение;
- желудочно-кишечное или почечное кровотечение давностью до 10 дней;
- геморрагический диатез;
- обширные хирургические вмешательства и травмы давностью до 10 дней;
- геморрагический инсульт в анамнезе;
- травма или операция на головном или спинном мозге до 2 мес;
- подозрение на расслаивающуюся аневризму аорты;
- острый панкреатит;
- диабетическая ретинопатия;
- тяжелые нарушения функции печени и почек;
- варикозное расширение вен пищевода;
- острый перикардит;
- аллергические реакции в анамнезе.
При длительном применении НФГ возможно развитие таких тяжелых осложнений, как:
- иммунная тромбоцитопения (на 3–15 сут лечения гепарином);
- некроз кожи;
- алопеция;
- остеопороз (при длительном применении);
- гиперкалиемия;
- феномен отмены («рикошетные» тромбозы).
Низкомолекулярные гепарины (НМГ), представляющие собой фракции или фрагменты гепарина, обладают большей активностью ингибирования фактора Xa, они меньше инактивируют тромбин, поэтому практически не влияют на время свертывания крови – протромбиновое время (ПВ), что снижает риск кровотечений. Препараты этой группы отличает более длительное действие, высокая биодоступность, меньшая частота осложнений, отсутствие потенцирования агрегации тромбоцитов. Важно отметить, что НМГ не влияют на такие показатели коагулограммы, как АЧТВ, протромбиновое время, МНО. Для контроля терапии НМГ используется определение анти-Ха-активности и динамическое определение маркеров тромбофилии: D-димера, комплексов тромбин-антитромбин (ТАТ), фрагментов протромбина F1+2. Вследствие усиленного клиренса и увеличения объема распределения, НМГ во время беременности должен назначаться 2 раза в сутки с целевыми значениями анти-Ха-активности 0,8–1,2 Ед/мл через 4–6 ч после введения дозы.
Таким образом, у беременных с искусственными клапанами сердца возможно применение одного из рекомендуемых режимов антикоагулянтной терапии, выбор которого определяется индивидуально:
1. с наступлением беременности продолжить прием варфарина, если суточная доза препарата не превышает 5 мг при достижении терапевтических значений МНО. При митральной позиции протеза МНО составляет 2,5–3,5; при аортальной – 2,0–3,0, Контроль МНО целесообразно осуществлять 1 раз в 5–7 дней. За 36 ч до родов рекомендован перевод на НФГ под контролем АЧТВ, уровень которого должен быть увеличен в 1,5–2,0 раза. Введение НФГ прекращают за 4–6 ч до родов и возобновляют его введение через 4–6 ч после родов (класс доказательности II А, уровень доказательности С);
2. в случае приема варфарина в дозе более 5 мг/сут, с первого триместра до 12–13-й недели беременности целесообразно назначение НМГ подкожно (п/к) дважды в день в терапевтической дозировке. Первая доза рассчитывается исходя из веса беременной: далтепарин 100 МЕ/кг, эноксапарин 1мг/кг. Через 4–6 ч после п/к введения НМГ проводят контроль анти-Ха активности плазмы с последующим ежедневным его контролем до достижения целевого его уровня – 0,8–1,2 Ед/мл.
В случае достижения целевого уровня анти-Ха активности его оценка в последующем проводится каждую неделю (класс доказательности I, уровень доказательности С). Возможно также внутривенное постоянное введение НФГ при контроле АЧТВ дважды в сутки (увеличение в 1,5–2,0).
С 12–13-й до 36-й недели беременности рекомендован перевод пациентки на варфарин в дозе, обеспечивающей достижение целевого уровня МНО, с 36-й недели беременности – перевод на НМГ дважды в сутки (при достижении целевых значений анти-Ха активности 0,8–1,2 Ед/мл, контролируется еженедельно) или НФГ при контроле АЧТВ дважды в сутки (в пределах 1,5–2,0) (класс доказательности IIa, уровень доказательности В).
НФГ отменяют за 4–6 ч до планируемых родов, НМГ – за 12 ч (класс доказательности I, уровень доказательности С).
В случае экстренного родоразрешения у пациентки, продолжающей прием варфарина, показано оперативное родоразрешение для уменьшения геморрагических осложнений как со стороны матери, так и плода. Перед экстренным родоразрешением вводится свежезамороженная плазма (СЗП) и только после достижением МНО <2,0 возможно проведение кесарева сечения.
Введение НМГ возобновляют через 12 ч, а НФГ через 4–6 ч после родов, если нет риска геморрагических осложнений, одновременно начинают насыщение варфарином, при достижении целевых значений МНО отменяют НМГ или НФГ (класс доказательности I, уровень доказательности С).
Смену антикоагулянтной терапии рекомендовано осуществлять в стационарных условиях.
Назначение варфарина после родов осуществляется на 2–3-е сутки при отсутствии повышенной кровоточивости и продолжении лечения НМГ/НФГ. Отмену НМГ/НФГ осуществляют при достижении целевых значений МНО, которое определяют еженедельно.
Рутинное сочетание антикоагулянтов с приемом аспирина, обладающего неконтролируемым антитромбоцитарным эффектом, при снижении числа ТЭО увеличивает число геморрагических осложнений в 3 раза, что, по-видимому, делает не вполне обоснованным сочетанное использование антикоагулянтов с антитромбоцитарными препаратами [8].
Следует отметить, что физиологическая гиперкоагуляция, свойственная беременным, часто впервые выявляет фоновые врожденные и/или приобретенные нарушения в системе гемостаза, которые ранее могли быть бессимптомными. Наличие в анамнезе синдрома потери плода, тяжелых акушерских осложнений (тяжелых форм преэклампсии, тяжелой фетоплацентраной недостаточности, антенатальной гибели плода, преждевременной отслойки плаценты), ТЭО служат показанием к исследованию на генетические формы тромбофилии и антифософолипидного синдрома (АФС). Кроме того, следует помнить, что ряд пороков сердца может существовать в рамках первичного синдрома, а некоторые состояния (в том числе инфекционный эндокардит, являющийся частым показанием для протезирования клапанов сердца) могут индуцировать развитие вторичного АФС. Наличие врожденных и/или приобретенных тромбофилий может быть одной из причин, объясняющих неудачи антикоагулянтной терапии у пациентов с искусственными клапанами сердца, резистентность к варфарину, «плавающие» показатели системы гемостаза и трудности с подбором адекватной дозы противотромботических препаратов. Именно у таких больных особое значение имеет подбор антикоагулянтов и контроль антитромботической терапии по маркерам тромбофилии (D-димер, ТАТ, F1+2).
3. ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННЫХ С НАРУШЕНИЯМИ СЕРДЕЧНОГО РИТМА И ПРОВОДИМОСТИ
Нарушения ритма сердца в течение беременности являются сложной кинической проблемой, поскольку они могут представлять опасность сразу для двух жизней – матери и плода. Увеличение объема циркулирующей крови, частоты сердечных сокращений, электролитные нарушения, возрастание уровня катехоламинов, сердечного выброса и другие нейрогуморальные сдвиги, характерные для беременности, ассоциируются с увеличением инцидентов развития аритмий у женщин как имеющих, так и не имеющих структурного поражения миокарда. В большинстве случаев аритмии развиваются у матери, но иногда фетальные аритмии также требуют лечения.
Основными направлениями в ведении беременных с нарушениями ритма сердца являются диагностика и лечение заболеваний сердечно-сосудистой системы, дисфункции щитовидной железы, а также коррекция электролитных нарушений и других патологических состояний, способствующих развитию аритмий сердца. Кроме того, для предотвращения нарушений сердечного ритма необходимо выявить и устранить факторы, которые могут провоцировать их: употребление алкоголя, кофеина, курение, психоэмоциональные перегрузки (ощущение беспокойства, тревоги, страха и т.д.). Во многих случаях выполнение вышеперечисленных мер оказывается достаточным для профилактики или купирования ряда аритмий либо для существенного снижения выраженности их клинических проявлений. Поскольку практически нет абсолютно безопасных для плода антиаритмиков, фармакотерапия нарушений ритма сердца у беременных должна проводиться по строгим клиническим показаниям, как правило, только при гемодинамически значимых или жизнеопасных аритмиях.
Согласно принятой в США классификации, рекомендованной FDA, антиаритмические препараты, применяемые у беременных, можно разделить на 5 категорий (табл. 5).
3.1. Экстрасистолия
Наджелудочковая и желудочковая экстрасистолия – наиболее часто диагностируемое у беременных нарушение ритма сердца. У многих из них она протекает бессимптомно и определяется только при плановой регистрации электрокардиографии (ЭКГ) или при длительном мониторировании ЭКГ по Холтеру.
Однако у части пациенток экстрасистолия может проявляться ощущениями перебоев в работе сердца, дискомфортом в грудной клетке, тревогой и беспокойством. Выявление патологических факторов, способствующих развитию нарушений ритма сердца, коррекция психоэмоционального статуса позволяют устранить или в значительной степени уменьшить субъективные ощущения, что часто предотвращает необходимость медикаментозной антиаритмической терапии.
В подавляющем большинстве случаев наджелудочковая и желудочковая экстрасистолия не являются противопоказанием к естественным родам и не требуют медикаментозного лечения. Назначение антиаритмических препаратов, в первую очередь кардиоселективных бета-адреноблокаторов, показано в редких случаях при плохой субъективной переносимости экстрасистолии, а также беременным с желудочковой экстрасистолией и систолической дисфункцией левого желудочка (потенциально опасная желудочковая аритмия).
3.2. Наджелудочковые тахикардии
Наиболее часто встречающимися формами наджелудочковых тахикардий (НЖТ) у женщин во время беременности являются пароксизмальная АВ-узловая реципрокная тахикардия (ПАВУРТ), АВ-реципрокная тахикардия при наличии дополнительных путей АВ-проведения (ПАВРТ) – синдром WPW, скрытые дополнительные пути проведения (ДПП). Реже у них регистрируются предсердные тахикардии, в основном при органическом поражении сердца. Беременность может спровоцировать развитие НЖТ или привести к учащению уже имевшихся пароксизмов. По стандартной ЭКГ трудно дифференцировать различные виды НЖТ (тахикардия с узкими комплексами QRS – менее 0,12 с), поэтому предлагается следующий алгоритм их купирования:
- НЖТ с нестабильной гемодинамикой (сердечная астма, отек легких, симптомная артериальная гипотензия): электроимпульсная терапия (ЭИТ), энергия первого разряда монофазного тока 100 Дж, если вагусные пробы и внутривенное (в/в) введение аденозина не эффективны;
- когда пароксизм аритмии протекает без осложнений, лечение начинают с вагусных приемов (проба Вальсальвы, массаж каротидного синуса). Если вагусные приемы не эффективны, переходят к в/в быстрому введению антиаритмических препаратов:
- аденозинтрифосфата (АТФ, 10 мг) или аденозина (6 мг) (класс рекомендаций I, уровень доказательства С). При отсутствии эффекта можно повторно ввести через 2 мин АТФ (20 мг) или аденозин (12 мг). Введение этих препаратов нередко сопровождается кратковременными ощущениями жара, покраснения лица и головной болью. На ЭКГ могут быть зафиксированы транзиторная преходящая синусовая брадикардия, синоатриальная и атривентрикулярная блокада;
- по мнению экспертов ESC, 2011 [4], 2015ACC/AHA/HRS(62,63), в/в введение бета-адреноблокаторов (метопролола, пропранолола) менее эффективно, но безопаснее верапамила для купирования НЖТ у беременных (класс рекомендаций IIa, уровень доказательства С);
- в/в введение верапамила в дозе 5–10 мг не менее чем за 2 мин под контролем артериального давления (АД) относится к действиям второй линии при купировании НЖТ у беременных (класс рекомендаций IIb, уровень доказательства С), так как описаны побочные эффекты у плода – брадикардия, гипотензия, блокады сердца и др. Возможно в/в введение новокаинамида (класс рекомендаций IIb) и крайне редко амиодарона (табл. 8);
- мАТФ (аденозин) купирует ПАВУРТ и ортодромную ПАВРТ (скрытые ДПП) в 90% случаев. Предсердные тахикардии реже купируются вагусными приемами, АТФ (аденозином), бета-адреноблокаторами и верапамилом;
- при в/в введении АТФ (аденозина), верапамила, дилтиазема, бета-адреноблокаторов у больных с синдромом WPW может развиться ФП с проведением большого количества импульсов на желудочки, поэтому должна быть доступна возможность быстрого выполнения ЭИТ.
Новокаинамид при в/в применении (скорость инфузии 30–50 мг/мин) – хорошо переносимый и относительно безопасный препарат при беременности. Однако у 60–70% больных при его длительном пероральном приеме обнаруживаются антинуклеарные антитела, в 20–30% случаев возникает волчаночноподобный синдром. Поэтому длительный пероральный прием новокаинамида не рекомендован.
Применение амиодарона во время беременности должно быть резко ограничено. Его можно назначать только в случаях тяжело протекающих тахиаритмий, и в первую очередь для лечения угрожающих жизни желудочковых тахиаритмий, рефрактерных к другим антиаритмическим препаратам, и отсутствии возможности проведения немедикаментозных методов лечения: катетерной аблации (КА), имплантации кардиовертера-дефибриллятора (ИКД) и т.д.
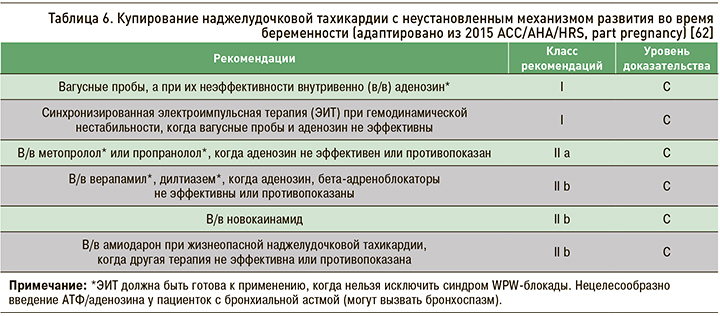
Рекомендации по профилактической терапии НЖТ с неустановленным механизмом развития во время беременности представлены в таблице 6.
Основные мероприятия по профилактике НЖТ с неустановленным механизмом развития во время беременности представлены в таблице 7.

4. КУПИРОВАНИЕ И ПРОФИЛАКТИЧЕСКАЯ АНТИАРИТМИЧЕСКАЯ ТЕРАПИЯ ОТДЕЛЬНЫХ ВИДОВ НАДЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
4.1. Пароксизмальная атриовентрикулярная узловая реципрокная тахикардия
Предполагают, что самой частой причиной пароксизмальной НЖТ у беременных является re-entry в атриовентрикулярном узле.
Для купирования приступа ПАВУРТ применяются:
- вагусные приемы;
- в/в введение АТФ (аденозина);
- в/в введение бета-адреноблокаторов.
В связи с тем что эффективность АТФ (аденозина) высокая, необходимость в применении других антиаритмических препаратов в большинстве случаев отпадает. Возможно в/в использование дигоксина (начинает действовать поздно – через 60 мин), верапамила, пропафенона, новокаинамида. Следует помнить, что бета-адреноблокаторы нельзя вводить в сочетании с верапамилом или быстро друг за другом, потому что это может вызвать брадикардию или даже асистолию.
Тяжелые пароксизмы с нарушением гемодинамики: неотложная синхронизированная ЭИТ с мощностью первого разряда монофазного тока 100 Дж. Электрокардиостимуляция (чреспищеводная, трансвенозная) также высокоэффективна в купировании ПАВУРТ.
Если во время беременности возникают частые, плохо переносимые ПАВУРТ, рекомендуется назначение профилактической антиаритмической терапии. Длительный опыт безопасного применения дигоксина у беременных и высокая эффективность при ПАВУРТ позволяют рассматривать его как один из основных препаратов для профилактики пароксизмов данной аритмии. Возможно использование бета-адреноблокаторов (пропранолола, метопролола, бисопролола). Однако их назначения надо избегать в I триместре беременности, так как возможно развитие у плода брадикардии, гипогликемии, гипотонии. Вместе с тем проспективные рандомизированные исследования указывают на невысокую частоту этих осложнений по сравнению с плацебо.
В случае противопоказаний или неэффективности дигоксина и вышеперечисленных бета-адреноблокаторов целесообразно назначение соталола (необходимо контролировать продолжительность интервала QT).
4.2. Атриовентрикулярная реципрокная тахикардия
Пароксизмальная атриовентрикулярная реципрокная тахикардия (ПАВРТ) – второй по частоте после ПАВУРТ вид пароксизмального наджелудочкового нарушения ритма сердца, обусловленный наличием дополнительных внеузловых путей предсердно-желудочкового проведения.
Формально купирование ортодромной (с узкими комплексами QRS – менее 0,12 с) ПАВРТ похоже на таковое при приступе ПАВУРТ: вагусные приемы, в/в введение АТФ (аденозина), бета-адреноблокаторов или верапамила (при наличии противопоказаний к бета-адреноблокаторам). Учитывая, что АТФ (аденозин) может вызвать ФП с проведением большого количества суправентрикулярных импульсов на желудочки (укорачивает рефрактерность предсердий), при использовании его для купирования ортодромной АВ тахикардии у больных с синдромом WPW должна быть возможность быстрого проведения ЭИТ. Безопасно применение АТФ (аденозина), бета-адреноблокаторов и верапамила только при «скрытых» ДПП.
В то же время, если ПАВУРТ конвертируется в ФП во время внутривенного введения бета-адреноблокаторов или верапамила, в ряде случаев это может сопровождаться значительным увеличением частоты желудочковых сокращений вплоть до развития фибрилляции желудочков. Поэтому наличие дефибриллятора во время их применения у больных с синдромом WPW также считается обязательным. Использование антиаритмиков IA (новокаинамид), IC (пропафенон) классов менее эффективно. Введение сердечных гликозидов для купирования НЖТ при синдроме WPW противопоказано.
Для купирования ПАВРТ, протекающей с очень высокой частотой сердечных сокращений (ЧСС) и гемодинамическими нарушениями при неэффективности вагусных приемов или в/в введения аденозина, методом выбора является синхронизированная ЭИТ с мощностью первого разряда монофазного тока 100 Дж.
По данным ACC/AHA/ESC (2015), для купирования антидромной тахикардии при синдроме WPW (тахикардия с широкими комплексами QRS – 0,12 с и более) предпочтительнее антиаритмики, способные ухудшать проведение преимущественно через дополнительные пути проведения (новокаинамид, пропафенон). АТФ и аденозин при антидромной тахикардии не должны применяться: они могут вызвать ФП с высокой ЧСС.
В случае необходимости профилактической антиаритмической терапии рекомендуется использовать антиаритмические препараты, которые ухудшают проведение и/или увеличивают рефрактерность как в АВ-узле, так и в дополнительных путях проведения (пропафенон, соталол). Бета-адреноблокаторы, верапамил и дилтиазем, наряду с сердечными гликозидами, не должны назначаться больным с синдромом WPW для профилактики пароксизмов ПАВРТ, потому что у ряда из них она может трансформироваться в ФП и, кроме того, ФП у них может развиться в будущем (риск индукции ФЖ). Профилактика приступов ПАВРТ бета-адреноблокаторами, верапамилом, дилтиаземом и сердечными гликозидами возможна только при «скрытых» ДПП.
4.3. Предсердные тахикардии
Автоматическая, триггерная и реципрокная предсердные тахикардии объединяются термином «очаговая предсердная тахикардия» (ОПРТ), которая развивается преимущественно на фоне органических заболеваний сердца, электролитных нарушений, интоксикаций (дигиталисной, алкогольной). Прогноз больных с ОПРТ определяется, как правило, основным заболеванием.
ЭИТ с энергией первого разряда монофазного тока 100 Дж используется у больных с рефрактерной к фармакологической кардиоверсии или осложненной ОПРТ (АГ, сердечная недостаточность, тяжелый ангинозный статус).
При стабильной гемодинамике для купирования или урежения высокой ЧСС в/в вводят бета-адреноблокаторы или верапамил. Для урежения ЧСС можно использовать в/в введение сердечных гликозидов. Если пароксизм сохраняется, то он купируется в/в введением антиаритмиков IA (новокаинамид), IC (пропафенон) классов. АТФ (аденозин) редко купирует ОПРТ, но может помочь в дифференциальной диагностике НЖТ.
Больные с асимптомными, редкими, непродолжительными пароксизмами ОПРТ не нуждаются в лечении. Их надо обследовать с целью определения причины нарушения ритма сердца и попытаться устранить ее. Фармакотерапия или немедикаментозное лечение необходимы только больным с симптомными приступами аритмии, а также при ее хроническом течении. Учитывая высокую эффективность и небольшое количество осложнений, в настоящее время в лечении больных с НЖТ, в том числе и ОПРТ, предпочтение отдается интервенционным вмешательствам – катетерной аблации (КА), а не антиаритмическим препаратам. Эффективность профилактической антиаритмической терапии ОПРТ составляет 50–60%, а КА – около 90%. Эффективными в предупреждении повторных приступов аритмии, по данным литературы, являются препараты I C (пропафенон, флекаинид) и III (соталол) классов, а также бета-адреноблокаторы, верапамил или дилтиазем. Однако, учитывая возможность появления побочных эффектов, в том числе удлинение интервала QT, в первые 5 дней терапии соталолом, подбор этого препарата рекомендуется проводить в условиях стационара и под контролем ЭКГ. Когда возникновение ОПРТ связывают с применением сердечных гликозидов, они отменяются. При необходимости уменьшения тахикардии перорально назначают бета-адреноблокаторы, верапамил.
КА при НЖТ должна быть рекомендована еще до беременности. В случаях плохой переносимости приступов и рефрактерности к антиаритмической терапии процедуру КА можно выполнять во время беременности с использованием средств максимальной защиты плода (в том числе под контролем эхокардиографии и др.), по возможности во II триместре беременности.
4.4. Фибрилляция предсердий
При беременности ФП редко встречается у женщин без органического поражения сердца и патологии щитовидной железы. Чаще она развивается при некоторых заболеваниях сердца (врожденных, приобретенных пороках сердца, кардиомиопатии и др.) или других органов (тиреотоксикозе, хронических заболеваниях легких и др.). Высокая ЧСС во время ФП может стать причиной серьезных гемодинамических нарушений как у матери, так и у плода.
4.4.1. Общие принципы лечения фибрилляции предсердий
Основными направлениями в лечении ФП являются:
- установление причины ФП и воздействие на модифицируемые факторы: лечение гипертирео-за, прекращение приема алкоголя, устранение передозировки сердечных гликозидов, симпатомиметиков, нормализация электролитного баланса и др.;
- контроль ЧСС, купирование и предупреждение рецидивов аритмии;
- профилактика ТЭО.
Короткие, асимптомные (малосимптомные) пароксизмы ФП не требуют антиаритмической терапии. Профилактическая антиаритмическая терапия может потребоваться при устойчивых, рецидивирующих, симптомных приступах аритмии. Если принято решение о медикаментозном лечении ФП, надо выбрать ее стратегию: «ритм–контроль» – фармакологическая кардиоверсия или ЭИТ с последующей профилактической антиаритмической терапией или «частота–контроль» – только назначение препаратов, влияющих на проводимость в АВ-узле, но без купирования приступов аритмии (исключение – осложненное течение ФП). В исследованиях, посвященных данной проблеме, не получено доказательств преимущества одной из стратегий: одинаковая общая смертность, частота ТЭО и др.
Однако отсутствие исследований по сравнению двух вышеуказанных тактик ведения беременных с ФП позволяет, ориентируясь на конкретную клиническую ситуацию – тяжесть течения аритмии, эффективность, переносимость и, главное, безопасность антиаритмических препаратов, индивидуально определять тактику лечения ФП.
В обоих случаях обязательным является проведение антитромботической терапии для предупреждения ТЭО. Оральные антикоагулянты не антагонисты витамина K (апиксабан, дабигатран, ривароксабан) противопоказаны беременным, женщинам, планирующим беременность, и кормящим матерям, что подтверждается также в Рекомендациях EHRA (2018) по их практическому применению у больных с ФП.
4.4.2. Рекомендации по лечению ФП во время беременности
- Электрическая кардиоверсия безопасна в любом триместре беременности и должна быть выполнена у пациенток с нестабильной гемодинамикой, развившейся вследствие аритмии.
- Проведение антитромботической терапии показано в течение всего срока беременности всем пациенткам с ФП после оценки риска по шкале CHA2DS2-VASc. Выбор антитромботического препарата (НФГ, НМГ или варфарин) зависит от стадии беременности.
- Применение оральных антикоагулянтов – антагонистов витамина K (варфарин) – рекомендуется со II триместра беременности и заканчивается за 2–4 нед до родов.
- П/к введение НМГ рекомендуется в первом триместре и в течение последних 2–4 нед беременности. Альтернативой НМГ может быть НФГ, вводимый в дозе, достаточной для удлинения АЧТВ в 1,5 раза по сравнению с контрольным значением.
- Для урежения частоты желудочковых сокращений рекомендуются бета-адреноблокаторы (кроме атенолола), дигоксин и недигидропиридиновые АК. Назначение бета-адреноблокаторов в I триместре беременности должно быть ограничено из-за их возможного отрицательного влияния на плод.
Применение сердечных гликозидов, верапамила, дилтиазема, бета-адреноблокаторов противопоказано при синдроме WPW, кроме того, верапамил и дилтиазем не должны назначаться больным с систолической дисфункцией левого желудочка (сердечная недостаточность с ФВ левого желудочка <40%). В неотложных ситуациях урежение ЧСС при систолической сердечной недостаточности с ФВ левого желудочка (ЛЖ) <40% проводят в/в введением только сердечных гликозидов. При отсутствии эффекта от монотерапии для урежения частоты сокращения желудочков можно назначить перорально комбинацию дигоксина с бета-адреноблокатором или верапамилом. Нельзя сочетать бета-адреноблокаторы с верапамилом.
Выбор препарата для удержания синусового ритма зависит от ряда факторов, которые включают влияние антиаритмика на плод, его эффективность, риск развития кардиальных и некардиальных побочных реакций у беременной, наличие у нее сердечно-сосудистой патологии и сопутствующих заболеваний. Лечение антиаритмическим препаратом должно начинаться с минимально эффективной дозы, а ЭКГ регистрироваться после каждого ее увеличения. Необходимо учитывать сопутствующую терапию.
Для профилактики рецидивов ФП у беременных без органической патологии сердца или с АГ без гипертрофии миокарда используют антиаритмические препараты IC (пропафенон, флекаинид) и III (соталол) классов.
Больным с систолической дисфункцией ЛЖ (систолическая сердечная недостаточность и/или ФВ ЛЖ <40%) терапия антиаритмиками IA, IC класса и соталолом противопоказана в связи с ухудшением прогноза жизни. У них возможен выбор стратегии лечения «частота–контроль».
Когда пароксизм ФП приводит к критическому ухудшению состояния беременной, показана ургентная синхронизированная ЭИТ с мощностью первого разряда монофазного тока 200 Дж с учетом специфики проведения данной процедуры при беременности.
При отсутствии экстренных показаний решение о купировании ФП (электрическом или медикаментозном) должно быть принято в течение 48 ч, так как при длительном приступе (более 2 сут) необходимо продолжительное назначение антикоагулянтов. Фармакологическую кардиоверсию при отсутствии сердечной недостаточности можно проводить новокаинамидом: в/в инфузия 1,0–1,5 г (до 15 мг/кг) со скоростью 30–50 мг/мин или пропафеноном (в/в введение 2 мг/кг за 10–15 мин). При тахиформе ФП перед купированием новокаинамидом и пропафеноном целесообразно уредить ЧСС.
Для купирования ФП при синдроме WPW рекомендуется ЭИТ или в/в введение новокаинамида. Противопоказано в/в или пероральное применение бета-адреноблокаторов, сердечных гликозидов, верапамила и в/в введение амиодарона и аденозина. У женщин с синдромом WPW при развитии ФП или трепетании предсердий (ТП), даже протекающих благоприятно, необходимо выполнение КА ДПП до беременности [68].
Купирующая и профилактическая терапия ТП в общем проводится по тем же самым принципам, что и ФП. Однако фармакотерапия при ТП менее эффективна, чем при ФП, а для восстановления синусового ритма чаще требуется проведение чреспищеводной ЭКС или ЭИТ. При тяжелых, рефрактерных к медикаментозному лечению пароксизмах ФП и ТП возможно применение во время беременности КА. Она наиболее эффективна при типичном ТП.
4.5. Желудочковая тахикардия и фибрилляция желудочков
Желудочковая тахикардия (ЖТ) – редкое нарушение ритма при беременности. Она может быть представлена как эпизодами неустойчивого (длительность до 30 с и отсутствие симптомов нарушения гемодинамики), так и устойчивого (длительность более 30 с или гемодинамическая нестабильность) варианта, по морфологии комплексов QRS – мономорфной или полиморфной формами.
Развитие ЖТ и/или ФЖ наблюдается в основном у беременных с органическими заболеваниями сердца, включая кардиомиопатию, врожденные и приобретенные пороки сердца, аритмогенную дисплазию (кардиомиопатию) правого желудочка. Перипартальная кардиомиопатия должна быть исключена, если впервые желудочковая тахикардия развилась в течение последних 6 нед беременности или в ранние сроки после родов. Желудочковые тахиаритмии могут быть следствием как врожденного удлинения, так и укорочения интервала QT, синдрома Бругада, возможно также развитие катехоламинергической полиморфной («двунаправленной») ЖТ, которая является довольно редкой наследственной аритмией. Вместе с тем ЖТ могут наблюдаться у беременных при отсутствии органического поражения сердца и генетически обусловленных ионных каналопатий.
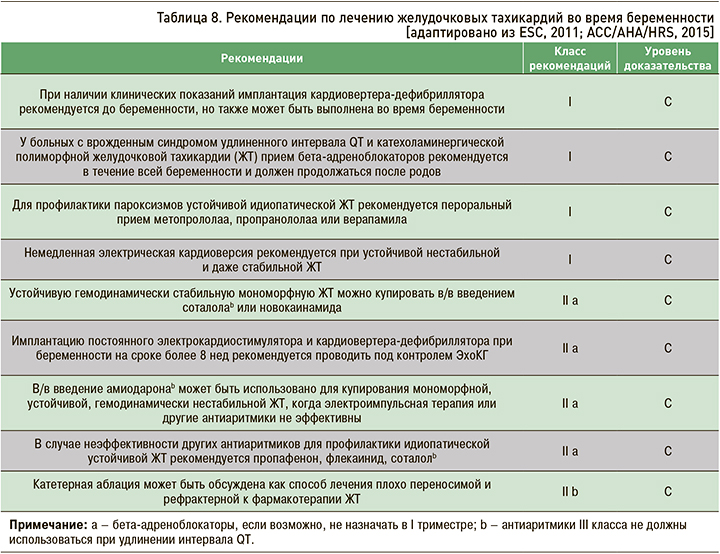
Купирование гемодинамически нестабильной ЖТ, а также ФЖ практически не отличается от такового у небеременных и должно включать весь комплекс мероприятий по проведению электрической кардиоверсии, дефибрилляции и кардио-пульмональной реанимации, предусмотренных соответствующими рекомендациями. Как уже указывалось ранее, ЭИТ служит безопасной для плода процедурой на протяжении всей беременности (табл. 8).
Для восстановления синусового ритма у беременных с мономорфной устойчивой ЖТ, не сопровождающейся тяжелыми нарушениями гемодинамики, можно использовать в/в введение лидокаина или новокаинамида. В/в введение амиодарона проводится только в тех случаях, когда другие методы лечения симптомной мономорфной ЖТ не могут быть применены или не эффективны.
Среди всех мономорфных ЖТ довольно часто у беременных может регистрироваться идиопатическая ЖТ, источником которой является выносящий тракт правого желудочка (ЖТ «БЛВ-тип» с отклонением электрической оси сердца вправо). Прогноз при данном виде ИЖТ благоприятный. Тахиаритмия хорошо купируется аденозином (аденозин-чувствительная идиопатическая ЖТ). Для ее профилактики вначале используют бета-адреноблокаторы или верапамил, а при их неэффективности применяют антиаритмики IC (пропафенон, флекаинид) и III (соталол) классов или КА. Наиболее частым источником другой идиопатической ЖТ (фасцикулярной) служит нижнезадний отдел левой части межжелудочковой перегородки (ЖТ «БПВ-тип» с отклонением электрической оси сердца влево). При ней отмечена высокая купирующая и несколько меньшая профилактическая эффективность верапамила и дилтиазема. Есть данные об эффективности бета-адреноблокаторов в предупреждении рецидивов фасцикулярной идиопатической ЖТ. Больным с этим заболеванием, особенно если они рефрактерны к медикаментозному лечению, показана КА [69].
Купировать полиморфную ЖТ при врожденном синдроме удлиненного интервала QT (тахикардия torsades de pointes) надо сернокислой магнезией, лидокаином или ЭИТ (энергия первого и последующих разрядов монофазного тока 360 Дж).
Профилактика пароксизмов данной ЖТ во время беременности осуществляется бета-адреноблокаторами, прием которых продолжается и после родов, так как в этот период (до 40 нед после родов) увеличивается риск развития полиморфной ЖТ. Противопоказано применение антиаритмиков, удлиняющих интервал QT. Основным методом лечения спонтанных пароксизмов полиморфной ЖТ при синдроме Бругада является имплантация кардиовертера-дефибриллятора. Однако, по данным литературы, для женщин с синдромом Бругада беременность и послеродовый период не представляют такого риска, как при врожденном синдроме удлиненного QT.
Проводя стратификацию риска внезапной сердечной смерти (ВСС) у беременных с желудочковыми тахиаритмиями, необходимо разделять пациенток на 2 группы: лица с потенциально злокачественными и злокачественными желудочковыми аритмиями. К потенциально злокачественным аритмиям относятся желудочковая экстрасистолия (≥10 в ч) и эпизоды неустойчивой ЖТ при наличии дисфункции ЛЖ (систолическая сердечная недостаточность и/или ФВ ЛЖ <40%). У пациенток с этими нарушениями ритма сердца еще не было эпизодов устойчивой ЖТ или ФЖ, но вероятность их развития высока. Целью лечения данной категории пациенток является снижение риска смерти – первичная профилактика. Она включает назначение бета-адреноблокаторов, а в ряде случаев (при неэффективности или непереносимости этой группы лекарственных средств) амиодарона. Амиодарон может оказывать отрицательное воздействие на плод, включая гипотиреоидизм, умственное недоразвитие плода и другое, поэтому его применение показано только в отсутствие альтернативного лечения. У ряда больных женщин с ишемической и неишемической кардиомиопатиями при низкой ФВ ЛЖ (≤35%) независимо от наличия или отсутствия желудочковых аритмий для первичной профилактики ВСС целесообразна имплантация кардиовертера-дефибриллятора (ИКД).
Группу лиц со злокачественными желудочковыми аритмиями формируют беременные с выраженным структурным поражением миокарда и пароксизмами устойчивой ЖТ и/или успешно реанимированные по поводу ФЖ. Прогноз жизни у них крайне неблагоприятен, а лечение должно быть направлено не только на устранение тяжелой аритмии, но и продление жизни, т.е. на вторичную профилактику ВСС. Для профилактики ЖТ и ФЖ у них возможно использование амиодарона и соталола, а также комбинации бета-адреноблокаторов и амиодарона (с учетом вышеизложенного отрицательного влияния его на состояние плода). ИКД (наиболее эффективный метод вторичной профилактики ВСС) может быть выполнена как до беременности, так и при необходимости на любом сроке беременности с использованием средств максимальной защиты плода и минимального использования рентгеновского излучения. ИКД не является противопоказанием для будущей беременности.
5. ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННЫХ С НАРУШЕНИЕМ ПРОВОДИМОСТИ СЕРДЦА
Нарушения проводимости (блокады сердца) возникают при замедлении или полном прекращении проведения электрического импульса по проводящей системе сердца. Выделяют следующие виды блокад:
- синоатриальную;
- внутрипредсердную;
- атриовентрикулярную (АВ): I, II (Мобитц I, Мобитц II) и III степени;
- блокады ветвей пучка Гиса.
Причинами возникновения синоатриальной и внутрипредсердной блокад могут быть воспалительные, склеротические, дегенеративные изменения миокарда предсердий, передозировка лекарственных препаратов (бета-адреноблокаторов, сердечных гликозидов и др.), электролитные нарушения. Эти виды блокад наблюдаются у практически здоровых лиц при ваготонии.
Синоатриальные блокады в подавляющем большинстве случаев бессимптомны и не требуют специального лечения. Синоатриальные блокады с симптомной брадикардией (пресинкопе, синкопе) – показанием для имплантации электрокардиостимулятора.
АВ-блокады характеризуются нарушением проведения импульса от предсердий к желудочкам. При беременности чаще всего встречаются АВ-блокады, которые в большинстве случаев носят врожденный характер. Они, как правило, протекают бессимптомно и не осложняют течение беременности и родов. По-видимому, вероятным этиологическим фактором выступает первичное генетически детерминированное заболевание проводящей системы сердца (во многих случаях прослеживается семейный характер заболевания).
К другим вариантам поражения проводящей системы сердца относят проксимальную идиопатическую АВ-блокаду различной степени: болезнь Ленегра, болезнь Лева, синдром Кери–Сейра, болезнь Фабри. Причинами развития блокад у пациенток, кроме того, являются врожденные и приобретенные пороки сердца, кардиомиопатии, операции на открытом сердце. У практически здоровых лиц может быть блокада правой ножки пучка Гиса.
Если АВ-блокады II (Мобитц II) и III степени не являются врожденными, показана профилактическая имплантация электрокардиостимулятора до беременности. Кроме того, АВ-блокада II степени любого анатомического уровня даже без симптомов, если в бодрствующем состоянии на синусовом ритме имеются периоды асистолии 3 с и более, и АВ-блокада II степени любого анатомического уровня даже без симптомов у больных с ФП, имеющих в бодрствующем состоянии одну или более пауз продолжительностью 5 с и более, также требуют имплантации электрокардиостимулятора до беременности. Показанием для имплантации электрокардиостимулятора до беременности служит наличие альтернирующей (билатеральной) блокады ветвей пучка Гиса.
Беременным с симптомами, связанными с синдромом слабости синусового узла, нарушениями АВ-проводимости II–III ст. (пресинкопе и синкопальные состояния) требуется выполнение временной или постоянной эндокардиальной стимуляции сердца. Такого рода вмешательства необходимо осуществлять с максимальным использованием ЭхоКГ, как правило, не ранее 8-й недели беременности.



