Хроническая обструктивная болезнь легких (ХОБЛ) определяется как персистирующее ограничение воздушного потока, которое обычно прогрессирует и становится следствием хронического воспалительного ответа дыхательных путей и легочной ткани на воздействие ингалируемых повреждающих частиц или газов [1]. Согласно отчету Всемирной организации здравоохранения (ВОЗ), в 2016 г. ХОБЛ стала 3-й ведущей причиной смерти в мире [2].
Обострение ХОБЛ выступает основным фактором риска прогрессирования и неблагоприятного исхода заболевания. Оно нередко сопровождается возникновением сердечно-сосудистых осложнений и декомпенсацией коморбидной патологии, что позволяет говорить о ХОБЛ как о болезни с системными проявлениями. Данный факт обусловливает необходимость оптимизации лечения этого заболевания.
Одна из ведущих причин возникновения, обострения и прогрессирования ХОБЛ – окислительный стресс. В связи с этим в ведущих руководствах по данному заболеванию значимое место отводится применению препаратов, обладающих антиоксидантной активностью [1, 5]. При этом продолжаются поиски новых лекарственных средств этой группы. Одним из таких препаратов является азоксимера бромид (Полиоксидоний®).
Наряду с этим продолжают развиваться методы оценки и прогнозирования течения ХОБЛ с использованием различных показателей (уровни в крови эозинофилов и фибриногена, частота обострений ХОБЛ в течение года и др.). Так, в немногочисленных работах исследовался секреторный протеин бронхиолярных экзокриноцитов (клеток Клара) – спБЭк-16. Бронхиолярные экзокриноциты ответственны за восстановление дыхательных путей после травмы, метаболизм токсических соединений и выделение веществ, уменьшающих воспаление, в том числе при ХОБЛ [6–8]. У пациентов с ХОБЛ происходит усиленное повреждение клеток легких с разрастанием соединительной ткани. Некоторые исследования указывают на снижение концентрации спБЭк-16 в крови при ХОБЛ, однако значение такой закономерности остается не полностью исследованным [6, 9, 10].
В свете представленных данных целью нашего исследования стало изучение связи между уровнем спБЭк-16 в крови и клиническими характеристиками пациентов с ХОБЛ в период обострения, а также анализ изменений исследуемых показателей на фоне применения препарата азоксимера бромид.
МАТЕРИАЛ И МЕТОДЫ
Для исследования было отобрано 90 пациентов с ХОБЛ тяжелой и средней степени тяжести заболевания, находившихся в терапевтическом отделении Дорожной клинической больницы г. Хабаровска в 2018–2019 гг. по поводу обострения этого заболевания. Подтверждение диагноза ХОБЛ проводилось на основе современных российских национальных рекомендаций по ХОБЛ и международных рекомендаций GOLD (Глобальная инициатива по ХОБЛ).
Критерием исключения из исследования было наличие пневмонии и других заболеваний, ограничивающих воздушный поток (бронхиальная астма, интерстициальные болезни легких и т.п.), сопутствующих заболеваний в стадии декомпенсации, а также онкологических заболеваний II, IV клинических групп.
В рамках дифференциальной диагностики ХОБЛ больным выполнялись исследования по стандартным методикам общего и биохимических анализов крови, спирометрии, рентгенографии органов грудной клетки. Уровень спБЭк-16 измерялся в сыворотке крови с использованием наборов ELISA (Cloud-Clone Corporation, США).
При поступлении в стационар пациенты были разделены на две группы:
- группа A (n=45): 25 пациентов (16 женщин + 9 мужчин) с обострением ХОБЛ II степени и 20 пациентов (12 женщин + 8 мужчин) с ХОБЛ III–IV степени, получавшие стандартную терапию при обострении ХОБЛ (антибиотики, глюкокортикостероиды и небулайзерную терапию с бронхолитиками);
- группа Б: 16 пациентов (11 женщин + 5 мужчин) с ХОБЛ II степени и 29 пациентов (14 женщин + 15 мужчин) с ХОБЛ III–IV степени, которые дополнительно к основной терапии получали препарат азоксимера бромид (Полиоксидоний таблетки) 12 мг 2 раза/сут per os 10-дневным курсом.
Обе группы были сопоставимы по полу, возрасту и тяжести течения ХОБЛ. Длительность наблюдения составила 6 мес после выписки из стационара.
Протокол исследования был одобрен этическим комитетом ФГБОУ ВО «Дальневосточный государственный медицинский университет» Минздрава России. Все пациенты подписали добровольное информированное согласие.
Динамику показателей в процессе лечения внутри групп оценивали с помощью критерия Вилкоксона. Для выявления достоверности между группами использовали U-критерий Манна–Уитни. Для представления корреляций между переменными применяли корреляционный анализ Пирсона. Различия считались достоверными при p <0,05. Статистические расчеты выполнялись с использованием Microsoft Excel 2010.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При исследовании всей группы пациентов (n=90) была выявлена положительная корреляция как между уровнем спБЭк-16 и ОФВ1 (r=0,911; p <0,001) (рис. 1А), так и между уровнем спБЭк-16 и ОФВ1/ФЖЕЛ (r=0,940; p <0,001) (рис. 1Б). Уровень спБЭк-16 продолжал достоверно коррелировать с показателями ОФВ1 (r=0,910; p <0,001) и ОФВ1/ФЖЕЛ (r=0,831; p <0,001) как в группе среднетяжелой ХОБЛ (n=41), так и у пациентов с ХОБЛ III, IV степени (n=49) (r=0,878; p <0,001) и (r=0,929; p <0,001) соответственно.
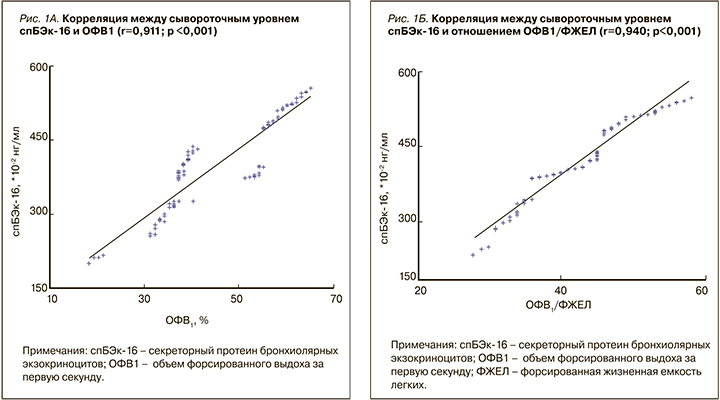
Выявленная нами прямая корреляция между уровнем спБЭк-16 и ключевыми спирометрическими показателями дополнительно характеризует связь этого белка с ХОБЛ, косвенно предполагая его участие в развитии и прогрессировании ХОБЛ. Так, в недавних исследованиях на животных было продемонстрировано, что спБЭк-16 играет значительную роль в уменьшении воспаления в дыхательных путях и их защите от окислительного стресса [11]. При дефиците спБЭк-16 происходит усиление воспаления и ускорение формирования эмфиземы в легких под действием табачного дыма [6]. Также было отмечено, что ХОБЛ характеризуется чрезмерным воспалением и ремоделированием эпителия, которое приводит в том числе к снижению количества бронхиолярных экзокриноцитов с последующим уменьшением уровня спБЭк-16 в крови [6].
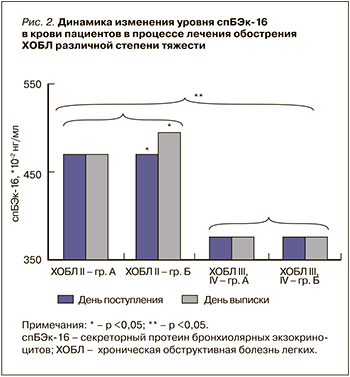 На диаграмме (рис. 2) представлены изменения уровня спБЭк-16 в крови до и после проведенной терапии. При сравнении групп пациентов с ХОБЛ II степени было установлено, что группа Б имела более высокие (p <0,05) уровни спБЭк-16 в день выписки по сравнению с группой A, в которой статистически значимых различий в уровне спБЭк-16 до и после лечения выявить не удалось. В группах пациентов с ХОБЛ III, IV степени тяжести достоверных различий в изменении уровня спБЭк-16 до и после лечения обнаружено не было. Обращает на себя внимание выраженная разница (p <0,01) уровней спБЭк-16 в крови у пациентов, имеющих ХОБЛ II степени, по сравнению с больными ХОБЛ III, IV степенью тяжести.
На диаграмме (рис. 2) представлены изменения уровня спБЭк-16 в крови до и после проведенной терапии. При сравнении групп пациентов с ХОБЛ II степени было установлено, что группа Б имела более высокие (p <0,05) уровни спБЭк-16 в день выписки по сравнению с группой A, в которой статистически значимых различий в уровне спБЭк-16 до и после лечения выявить не удалось. В группах пациентов с ХОБЛ III, IV степени тяжести достоверных различий в изменении уровня спБЭк-16 до и после лечения обнаружено не было. Обращает на себя внимание выраженная разница (p <0,01) уровней спБЭк-16 в крови у пациентов, имеющих ХОБЛ II степени, по сравнению с больными ХОБЛ III, IV степенью тяжести.
Эти данные могут свидетельствовать об обратимости повреждений на уровне эпителия дыхательных путей при среднетяжелой ХОБЛ. Добавление препарата, оказывающего антиоксидантное и противовоспалительное действие, вероятно, ускоряло процессы восстановления эпителия. Однако при тяжелых степенях ХОБЛ с более выраженным ремоделированием структуры дыхательных путей возможность восстановления эпителия может значительно снижаться.
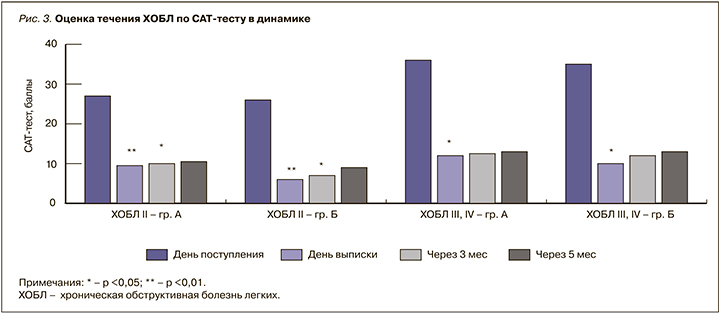
У всех больных на фоне терапии отмечалось улучшение симптоматики ХОБЛ. Однако у тех пациентов, которые дополнительно получали азоксимера бромид, отмечалось достоверно более выраженное уменьшение симптомов, чем у больных, не получавших этот лекарственный препарат (рис. 3). Так, больные со среднетяжелой ХОБЛ в группе Б имели достоверно меньше баллов по опроснику CAT-тест как непосредственно при выписке (p <0,01), так и спустя 3 мес (p <0,05) по сравнению с пациентами группы A. У тяжелых пациентов этот эффект был менее выраженным при выписке (p <0,05), чем у пациентов с ХОБЛ II.
При оценке симптомов одышки по опроснику mMRC (рис. 4) было установлено, что пациенты с ХОБЛ II в группе Б имели достоверно менее выраженные (p <0,05) симптомы одышки при выписке из стационара. В то же время у пациентов с тяжелой ХОБЛ во время выписки достоверного различия по баллам шкалы mMRC обнаружено не было, хотя и наблюдалась более выраженная тенденция к уменьшению симптомов у пациентов, получавших азоксимера бромид. При последующей оценке через 3 и 6 мес достоверного различия в группах по выраженности одышки не наблюдалось, но показатели при этом были ниже, чем при поступлении в стационар.
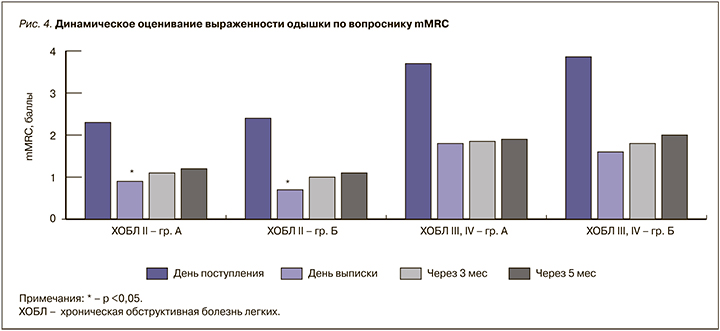
Выявленные различия в выраженности симптомов одышки и показателей САТ-теста могут быть объяснены с позиции усиления стандартной терапии собственным противовоспалительным действием азоксимера бромида, а также дополнительным антиоксидантным действием препарата. В настоящее время азоксимера бромид активно исследуется с позиций разностороннего влияния на патогенез ХОБЛ. Известно, что привлечение нейтрофилов в дыхательные пути характерно для многих респираторных заболеваний, включая ХОБЛ. Недавно открыта уникальная способность нейтрофилов в ответ на действие различных микроорганизмов, образовывать нейтрофильные внеклеточные ловушки (НВЛ), состоящие из внеклеточной сети волокон ДНК. Хотя в респираторной системе НВЛ способствуют захвату и инактивации бактерий, грибков и вирусов, накопленные данные свидетельствуют, что они могут оказывать прямое цитотоксическое действие на эпителиальные клетки легких [12], а их количество положительно коррелирует со степенью тяжести ХОБЛ и выраженностью обструкции по данным ОФВ1 у таких больных [12, 13]. Также было продемонстрировано, что НВЛ могут использоваться как основа для образования биопленок, например нетипируемой Haemophilus influenzae [14].
По данным последних исследований, азоксимера бромид обладает способностью уменьшать формирование НВЛ, что приводит к уменьшению выделения токсичных для собственных клеток организма антимикробных пептидов и гистонов. При этом азоксимера бромид увеличивает активность фагоцитоза, что может способствовать более быстрому уменьшению воспаления. Кроме того, показано, что азоксимера бромид обладает противовирусными и детоксицирующими свойствами [15, 16].
ЗАКЛЮЧЕНИЕ
- Сывороточный уровень спБЭк-16 имеет прямую корреляцию со значениями ОФВ1 и ОФВ1/ФЖЕЛ у пациентов с ХОБЛ.
- Добавление препарата азоксимера бромид к стандартной терапии обострения ХОБЛ II степени тяжести приводило к увеличению уровня спБЭк-16 в крови в конце периода обострения (p <0,05) в отличие от пациентов с тяжелой степенью ХОБЛ.
- При включении азоксимера бромида в терапию обострений среднетяжелой и тяжелой ХОБЛ наблюдалось более выраженное уменьшение влияния болезни на жизнь пациентов и степень одышки (p <0,05) по сравнению с больными, получавшими стандартную терапию обострения ХОБЛ.
- Азоксимера бромид может быть рекомендован к включению в комплексную терапию пациентов с ХОБЛ среднетяжелого и тяжелого течения.



