Хронические неинфекционные заболевания, и прежде всего болезни системы кровообращения, остаются главной причиной смерти населения [1]. В России свыше 50% смертей от сердечно-сосудистых заболеваний (ССЗ) приходится на долю лиц с ишемической болезнью сердца (ИБС). Одно из наиболее фатальных проявлений ИБС – острый коронарный синдром (ОКС), нередко манифестирующийся в качестве клинического дебюта заболевания [2].
На современном этапе развития интервенционной кардиологии стратегически важным моментом в лечении этой категории пациентов является незамедлительное восстановление коронарного кровотока, приводящее к устранению симптомов и улучшению прогноза [3, 4].
Вместе с тем уже на этапе диагностической коронароангиографии (КАГ), по данным ряда авторов, в 2–29,7% случаев развивается острое почечное повреждение (ОПП), индуцированное введением рентгеноконтрастного средства, – постконтрастное острое повреждение почек (ПК-ОПП). Оно существенно влияет на течение заболевания и прогноз патологического процесса [5].
Развитие ПК-ОПП ведет к увеличению частоты почечной недостаточности с необходимостью в кратковременном или продолжительном курсе гемодиализа, увеличению сроков госпитализации, повышению госпитальной летальности, а также смертности в отдаленном периоде [6]. Актуальным является более строгое предварительное обследование больных с ИБС перед плановым чрескожным вмешательством (ЧКВ) с целью профилактики возможных осложнений. Такого преимущества у пациентов с ОКС, как правило, нет, что исходно делает их еще более уязвимыми.
В связи с вышеизложенным целью настоящего исследования стало прогнозирование риска формирования ПК-ОПП у больных ОКС.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 323 пациента с ОКС, находившихся на лечении в кардиологическом отделении регионального сосудистого центра ГБУ РО «Ростовская областная клиническая больница», – 217 (67,1%) мужчин и 106 (32,9%) женщин. Средний возраст обследованных больных составил 59,6±9,2 лет.
На первом этапе всем пациентам были проведены стандартные биохимические исследования, включающие оценку показателей липидного обмена (общий холестерин, холестерин липопротеидов высокой и низкой плотности, индекс атерогенности, триглицериды), уровня креатинина, мочевины. Скорость клубочковой фильтрации (СКФ) рассчитывали по формулам Кокрофта–Голта и CKD-EPI [6].
Комплекс инструментальных исследований включал регистрацию электрокардиограммы (ЭКГ) в покое, холтеровское мониторирование ЭКГ, ультразвуковое исследование (УЗИ) сердца, УЗИ почек, коронароангиографию (КАГ) и селективную ангиографию почечных сосудов.
Статистический анализ полученных результатов проводили с помощью набора прикладных статистических программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США). Для оценки типа распределения данных применяли анализ Колмогорова–Смирнова; при значениях p >0,05 распределение считали не отличающимся от нормального.
Описательную статистику проводили с определением следующих особенностей: данные представляли в виде M±SD (M – среднее арифметическое, SD – стандартное отклонение) при нормальном распределении и в виде Me [Q1;Q3] (Me – медиана, Q1 и Q3 – первый и третий квартили) при ненормальном распределении. При нормальном распределении выборки при сравнении двух независимых выборок использовали критерий Стьюдента, а при отличии от нормального – критерии Манна–Уитни и χ2 или тест Левена с определением F. Также применялся логистический регрессионный анализ с расчетом относительных рисков (OR) и определением χ2, связь считалась статистически значимой при значении р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ полученного фактического материала показал, что отягощенная по ССЗ наследственность встречалась у половины обследованных пациентов. Артериальная гипертензия (АГ) была верифицирована у подавляющего числа больных (95,4%): АГ 1 степени – у 44 (14,3%), 2 степени – у 100 (32,5%), 3 степени – у 164 пациентов (53,3%). У каждого пятого пациента отмечалось наличие сахарного диабета (СД) 2 типа. Повышенный уровень общего холестерина (ОХС) имел место у 229 пациентов (72,2%), холестерина липопротеидов низкой плотности (ХС ЛПНП) – у 209 (98,6%), повышение индекса атерогенности (ИА) было выявлено у 80 (37,7%), повышение уровня триглицеридов (ТГ) – у 114 (47,1%). Дислипидемия 2А-типа наблюдалась у 119 больных (49,2%), 2Б-типа – у 75 (31,0%), 4 типа – у 8 (3,3%).
Согласно данным КАГ, у 20,1% пациентов было выявлено поражение одной коронарной ветви, но не ствола левой коронарной артерии (ЛКА), у 70,9% больных – полисосудистое поражение коронарной артерии или изолированное поражение ствола ЛКА, у 9% пациентов был диагностирован ОКС вследствие тромбоза коронарного сосуда.
У 24,8% больных с ОКС было обнаружено атеросклеротическое поражение почечных сосудов, при этом односторонний стеноз наблюдался у 58,8% пациентов, двусторонний – у 41,2%. У больных с односторонним атеросклеротическим поражением стеноз левой почечной артерии встречался в 57,5% случаев, правой – в 42,5%.
У 28 лиц (8,7%) с ОКС, подвергшихся ЧКВ, развилось ПК-ОПП, проявлявшееся приростом креатинина крови после КАГ на 26,5 мкмоль/л и более (критерии ADQI).
При проведении логистического регрессионного анализа были выявлены факторы, оказывающие влияние на риск развития ПК-ОПП у больных ОКС.
В ходе оценки роли факторов сердечно-сосудистого риска было показано, что риск развития ПК-ОПП существенно повышался с возрастом пациентов, а также увеличивался на фоне позднего дебюта АГ и в случае более раннего развития СД 2 типа в анамнезе (табл. 1).
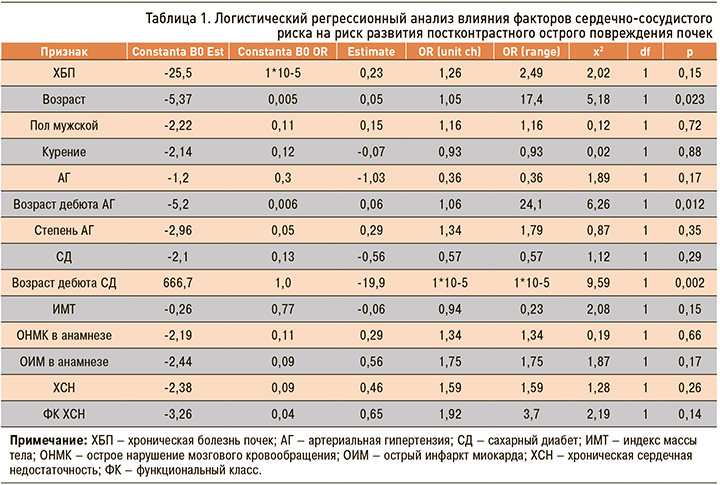
Обращал на себя внимание тот факт, что риск ПК-ОПП существенно возрастал по мере снижения величины фракции выброса (ФВ); при этом остальные параметры эхокардиографии (ЭхоКГ) значимого влияния на обсуждаемый риск не оказывали (табл. 2).

В ходе анализа влияния характера стенозирования различных ветвей коронарных артерий было отмечено, что риск ПК-ОПП повышался только при атеросклеротическом стенозе огибающей ветви (ОВ), в то время как статистически значимых результатов влияния поражения других ветвей коронарного русла выявлено не было.
Изучение факторов почечного повреждения показало, что наличие патологии почек в анамнезе повышало риск развития ПК-ОПП. Из признаков, характеризующих почечную функцию, только в отношении уровня мочевины были получены статистически значимые результаты: по мере повышения уровня мочевины крови до КАГ возрастал и риск ПК-ОПП. Также повышало риск развития ПК-ОПП уменьшение длины правой почки (в отношении левой почки была замечена только тенденция).
Стеноз почечных артерий оказывал слабое влияние на риск развития ПК-ОПП; исключение составляет лишь гемодинамически значимый односторонний стеноз.
В ходе двухфакторного логистического регрессионного анализа было продемонстрировано, что сочетание ряда факторов достоверно повышало риск развития ПК-ОПП у пациентов с ОКС (табл. 3). В частности, это касается сочетаний «гемодинамически значимый стеноз и величина ФВ», «гемодинамически значимый стеноз и возраст больного», а также комбинаций «заболевание почек и нарастающий уровень мочевины до КАГ», «заболевание почек и величина ФВ». Наличие таких связей позволило составить прогнозные таблицы.
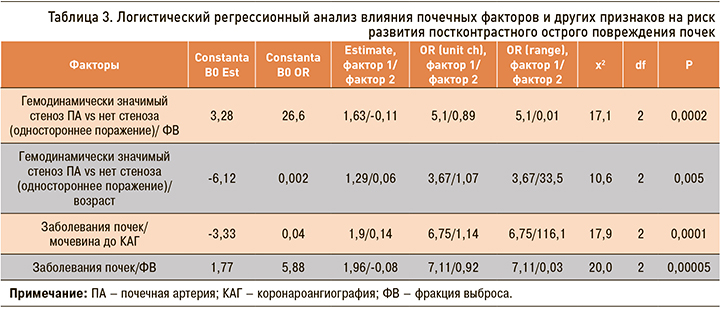
Исходя из полученных данных, у пациентов с наличием гемодинамически значимого одностороннего стеноза почечных артерии и величиной ФВ, например, 50%, риск развития ПК-ОПП составлял 43%, тогда как у лиц с аналогичным показателем ФВ, но без атеросклеротического стеноза почечных сосудов обсуждаемый риск был равен лишь 21% (табл. 4).

Как было показано выше, возраст пациента существенно повышал риск развития ПК-ОПП. Так, у 65-летних пациентов с гемодинамически значимым односторонним стенозом почечной артерии величина риска развития ПК-ОПП составила 29%, а у лиц 75-летнего возраста – 47%.
У больных тех же возрастных групп без поражения почечных сосудов аналогичные показатели составили 8 и 17% соответственно (табл. 5).
У лиц с заболеваниями почек в анамнезе и уровнем мочевины, например, 8 ммоль/л, риск развития ПК-ОПП составлял 30%, тогда как у пациентов без почечной патологии – 5% (табл. 6).
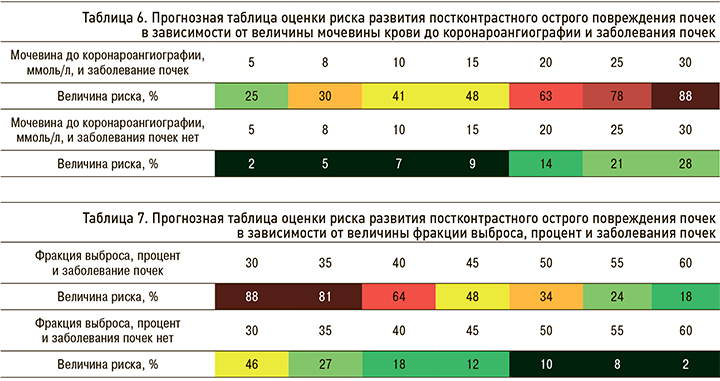
Согласно полученным данным, у больных с заболеваниями почек в анамнезе и величиной ФВ 55% риск развития ПК-ОПП составлял 24%, у лиц с ФВ 40% он увеличивался до 64%, в то время как у пациентов без заболеваний почек этот показатель был равен 8 и 18% соответственно (табл. 7).
Применение прогнозных таблиц предусматривает оценку количественных показателей, а также ранговую оценку качественных показателей с последующим определением риска развития ПК-ОПП, выраженного в процентах (%). Максимальная величина риска составляет 100% – в этом случае наличие признака или его определенная величина сводят к 0 вероятность того, что ПК-ОПП не будет выявлена.
По данным литературы, частота случаев ПК-ОПП широко варьирует в зависимости от диагностических критериев, используемых в ее определении, профиля пациентов, включаемых в исследование, и процедуры применения рентгеноконтрастного средства [6, 7].
При анализе результатов исследования более 16 000 пациентов Levy E.M. et al. выявили ПК-ОПП у 1% пациентов (n=174) [9]. В другом большом эпидемиологическом исследовании ПК-ОПП была диагностирована в среднем у 14,5% пациентов, но ее частота отличалась значительной вариабельностью – от 0 до 90% в зависимости от наличия факторов риска, особенно предшествующего нарушения функции почек, СД, класса и объема рентгеноконтрастного средства [10].
Согласно проведенному нами исследованию, у 8,7% пациентов с ОКС, подвергшихся процедуре ЧКВ, была диагностирована ПК-ОПП.
К факторам, увеличивающим риск поражения почек рентгеноконтрастными средствами, как правило, относят предшествующее нарушение функции почек, диабетическую нефропатию с почечной недостаточностью, уменьшение эффективного внутрисосудистого объема, конкурентное применение нефротоксических лекарств, пожилой возраст и др. [11, 12].
Также было продемонстрировано влияние наличия патологии почек в анамнезе, стеноза ОВ и гемодинамически значимого стеноза почечной артерии.
Особый интерес вызвало сопоставление полученных в ходе исследования данных с методом балльной оценки степени риска контраст-индуцированной нефропатии перед проведением эндоваскулярных процедур, разработанным Mehran R. et al. и в последующем модифицированным Barrett В. и Parfrey P. Так, к факторам риска авторы отнесли возраст старше 75 лет. Согласно полученным нами данным с помощью оригинального математического аппарата, продемонстрировано, что возраст также служит одним из признаков, приводящих к развитию ПК-ОПП. При этом в ходе двухфакторного логистического регрессионного анализа свое влияние на развитие обсуждаемой патологии продемонстрировала комбинация таких факторов, как возраст и наличие гемодинамически значимого стеноза почечной артерии.
В ходе работы доказано, что риск развития ПК-ОПП возрастал при позднем дебюте АГ и в случае раннего развития СД 2 типа. При этом СД является одним из признаков, включенным в таблицу Mehran R. et al., основанную на методе балльной оценки.
Комбинация факторов «гемодинамически значимый односторонний стеноз почечной артерии и величина ФВ» также оказывала влияние на риск развития ПК-ОПП, что согласуется с методом балльной оценки.
ЗАКЛЮЧЕНИЕ
У пациентов с ОКС, подвергшихся ЧКВ, частота развития ПК-ОПП составила 8,7%.
В ходе анализа выявлены факторы, способствующие развитию ПК-ОПП у этой категории больных.
Доказана высокая информативность и прогностическая значимость сочетания ряда признаков, оказывающих существенное влияние на развитие ПК-ОПП.
Разработаны прогнозные таблицы, применение которых позволило оценить риск развития ПК-ОПП перед проведением КАГ у пациентов с ОКС.


