Тромбоэмболия легочной артерии (ТЭЛА) – вторая по частоте причина смерти у пациентов онкологического профиля [1]. По сравнению с другими категориями больных риск венозных тромбоэмболий (ВТЭ) у больных со злокачественными новообразованиями (ЗНО) в 6 раз выше. Это зависит как от морфологических характеристик опухоли, так и от стадии опухолевого процесса, увеличиваясь при наличии метастазов в 4–13 раз [2]. Еще в XIX в. Арман Труссо описал связь между ЗНО и тромбогеморрагическими осложнениями. В патогенезе ВТЭ у пациентов с онкопатологией лежит дисбаланс между тромбообразующими и тромболитическими составляющими свертывающей системы крови, выражающийся в нарастании коагуляционного и истощении коагулитического потенциалов по мере прогрессии опухолевого роста [3].
Высокая предрасположенность онкологических больных к возникновению ВТЭ и других нарушений гемостаза в настоящее время до конца не расшифрована. Между злокачественным процессом и венозным тромбозом имеется двухсторонняя клиническая корреляция: с одной стороны опухолевые клетки приводят к активации коагуляционных механизмов, с другой – коагуляционные механизмы стимулируют прогрессирование опухоли [4, 5]. ВТЭ в ряде случаев является ранним и единственным симптомом опухолевого процесса.
Наибольший интерес представляет параллелизм ВТЭ как раннего симптома первичного рака поджелудочной железы (РПЖ).
В мире ежегодно диагностируется около 170–190 тыс. случаев РПЖ. Прирост показателей заболеваемости среди мужчин за предшествующие 10 лет составил 9,39%, среди женщин – 14,95% [6].
В структуре смертности от онкологических заболеваний в России в 2015 г. РПЖ составил 5,9 %, что соответствует 5 месту после рака легкого, желудка, ободочной кишки и молочной железы. Наиболее часто (58,3%) в Российской Федерации РПЖ выявляется уже на IV стадии опухолевого процесса, на I стадии обнаруживался только 3,4% случаев, пятилетняя выживаемость составила менее 5% [7, 8].
К особенностям РПЖ относятся длительное скрытое течение, отсутствие эффективных методов скрининга, неспецифичность поздно манифестирующих клинических симптомов, появление отдаленных метастазов уже на ранних стадиях опухолевого процесса; склонность к мультицентрическому росту опухоли, низкая эффективность хирургических и терапевтических методов лечения; ограниченные возможности морфологической диагностики (биопсии) [9]. Среди пациентов с отдаленными метастазами средняя продолжительность жизни с момента постановки диагноза РПЖ не превышала 4 мес [7].
Сложности лечебного подхода во многом обусловлены тем, что на долю ранних форм РПЖ приходится всего лишь 3,8% случаев, а резектабельность составляет лишь 15–16%. По данным литературы [10–13], злокачественная опухоль в поджелудочной железе чаще всего локализуется в области головки (63,8%), реже поражаются тело (23,1%) и хвост (7,1%).
При обследовании пациентов с РПЖ на долю случайно выявленной ТЭЛА приходилось 33,3%, тромбоза глубоких вен – 21,4%, тромбоза висцеральных вен – 100% [14]. Венозные тромбозы и тромбоэмболии у пациентов с неоплазиями поджелудочной железы могут манифестировать широким спектром клинически значимых осложнений, включая тромбоз глубоких вен нижних конечностей, ТЭЛА, артериальный тромбоз, тромбоэндокардит, поверхностный тромбофлебит, тромбозы, связанные с сосудистыми катетерами, и синдром Бадда–Киари [15, 16].
В качестве примера приводим собственное наблюдение.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент В., 65 лет, был направлен к ангиохирургу в поликлинику Республиканского кардиологического диспансера Минздрава Чувашии по поводу тромбофлебита вен нижних конечностей. На момент осмотра его беспокоила общая слабость, одышка в пределах самообслуживания, кашель с отхождением скудной мокроты, боли и умеренная отечность обеих нижних конечностей.
Пациент курит более 30 лет, наследственность по сердечно-сосудистым заболеваниям отягощена (у матери артериальная гипертония и стенокардия с 55 лет).
Повышение артериального давления (АД) регистрируется в течение 10 лет, целевой уровень АД не достигнут. Ишемический анамнез в виде стереотипа стенокардии в рамках функционального класса (ФК) II. 9 лет назад пациент перенес миоэндокардит, потребовавший оперативного лечения: протезирования аортального клапана, аннулопластики митрального и трикуспидального клапанов, хирургической коррекции фибрилляции предсердий с восстановлением синусового ритма. С антикоагулянтной целью принимал варфарин 5 мг/сут без контроля международного нормализованного отношения (МНО).
Ухудшение состояния в виде появления болей в нижних конечностях и усиления периферических отеков было отмечено в течение 2 нед; больной был госпитализирован в хирургическое отделение по месту жительства с диагнозом «тромбофлебит глубоких вен нижних конечностей», подтвержденный при ультразвуковой допплерографии (УЗДГ). В течение последующих 2 нед резко нарастала одышка, усиливались боли в нижних конечностях, в связи с чем пациент был направлен на консультацию к ангиохирургу.
При поступлении состояние больного было средней тяжести, телосложение гиперстеническое, индекс массы тела 30 кг/м2.
При объективном осмотре у пациента были выявлены косвенные признаки ТЭЛА: акроцианоз, учащение дыхания до 20 дыхательных движений в минуту, мелкопузырчатые хрипы в нижних отделах легких с обеих сторон, тахикардия до 110 ударов в минуту, при аускультации сердца – акцент II тона над легочной артерией. Живот при пальпации безболезненный, печень не увеличена. Периферические лимфатические узлы пальпаторно не увеличены.
Больному был выставлен предварительный диагноз «тромбофлебит глубоких вен нижних конечностей, подозрение на ТЭЛА» и начат диагностический поиск по установлению причины этого состояния.
В общем анализе крови наблюдался лейкоцитоз (11,3×109/л), лейкоцитарная формула без особенностей, нормохромная анемия средней степени тяжести (гемоглобин 99 г/л, цветовой показатель 0,89) тромбоцитопения 155×109/л и ускорение СОЭ до 36 мм/ч.
В биохимическом анализе крови:
- содержание лактатдегидрогеназы (ЛДГ) 256,0 Ед./л, что соответствует верхней границы нормы;
- 5-кратное повышением гамма-глутамилтрансферазы (ГГТ) до 250 Ед./л;
- снижение сывороточного железа до 3,8 мкмоль/л;
- гипоальбуминемия – 32 г/л, диспротеинемия (повышение α- и γ-глобулиновых фракций сывороточных белков);
- гипохолестеринемия – 3,13 ммоль/л.
Глюкоза крови при поступлении 13, 6 ммоль/л, в динамике уровень гликемии натощак колебался в пределах 7,2–8,6 ммоль/л.
Показатели билирубина, печеночных трансаминаз, альфа-амилазы, маркеры некроза миокарда, эластаза, липаза сыворотки крови и альфа-амилаза в моче не выходили за пределы референсных значений.
МНО – 6,17, протромбиновый индекс – 19%, тромбиновое время – более 3 мин, т.е. имелись признаки гипокоагуляции.
Уровень D-димера повышен до 4,04 мкг/мл (при условной норме 0,5 мкг/мл).
В анализе мочи отмечалась эритроцитурия до 30–40 в поле зрения.
По электрокардиограмме (ЭКГ) регистрировалась синусовая тахикардия с частотой 112 в минуту.
При проведении эхокардиографии сердца выявлены признаки перегрузки правых отделов сердца (увеличение размеров правого желудочка и правого предсердия, повышение систолического давления в легочной артерии до 72 мм рт.ст.), недостаточность трикуспидального клапана 2 степени.
При УЗДГ подтвержден тромбоз в системе глубоких и поверхностных вен обеих нижних конечностей.
 Для оценки клинической вероятности ТЭЛА рекомендуется применять модифицированные индексы Geneva и Wells [17, 18]. По шкале Geneva у обследуемого пациента имелись следующие критерии: возраст старше 65 лет, частота сердечных сокращений больше 95 уд./мин, боль в ноге и болезненность ее при пальпации, сумма баллов 13. По шкале Wells – 7,5 баллов (ЧСС больше 100 уд./мин, клинические признаки тромбоза глубоких вен, альтернативный диагноз менее вероятен, чем ТЭЛА). Таким образом, по обеим шкалам у пациента имелась высокая клиническая вероятность ТЭЛА.
Для оценки клинической вероятности ТЭЛА рекомендуется применять модифицированные индексы Geneva и Wells [17, 18]. По шкале Geneva у обследуемого пациента имелись следующие критерии: возраст старше 65 лет, частота сердечных сокращений больше 95 уд./мин, боль в ноге и болезненность ее при пальпации, сумма баллов 13. По шкале Wells – 7,5 баллов (ЧСС больше 100 уд./мин, клинические признаки тромбоза глубоких вен, альтернативный диагноз менее вероятен, чем ТЭЛА). Таким образом, по обеим шкалам у пациента имелась высокая клиническая вероятность ТЭЛА.
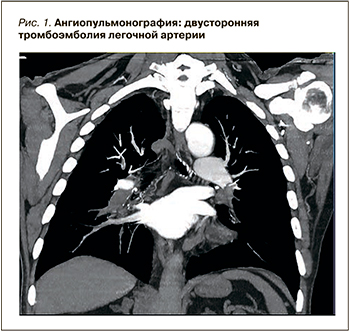
Для верификации данного предположения была проведена компьютерная ангиопульмонография, позволившая обнаружить признаки двусторонней ТЭЛА на уровне сегментарных ветвей и наличие тромбов в обоих предсердия (рис. 1).
Согласно рекомендациям по лечению ТЭЛА Европейского общества кардиологов от 2014 г. и Российского кардиологического общества от 2015 г. [17, 18], для выбора лечебной тактики необходимо определить вероятность смерти при ТЭЛА в ближайшие 30 сут по индексу PESI (Pulmonary Embolism Severity Index) (табл. 1) и категорию риска (табл. 2).
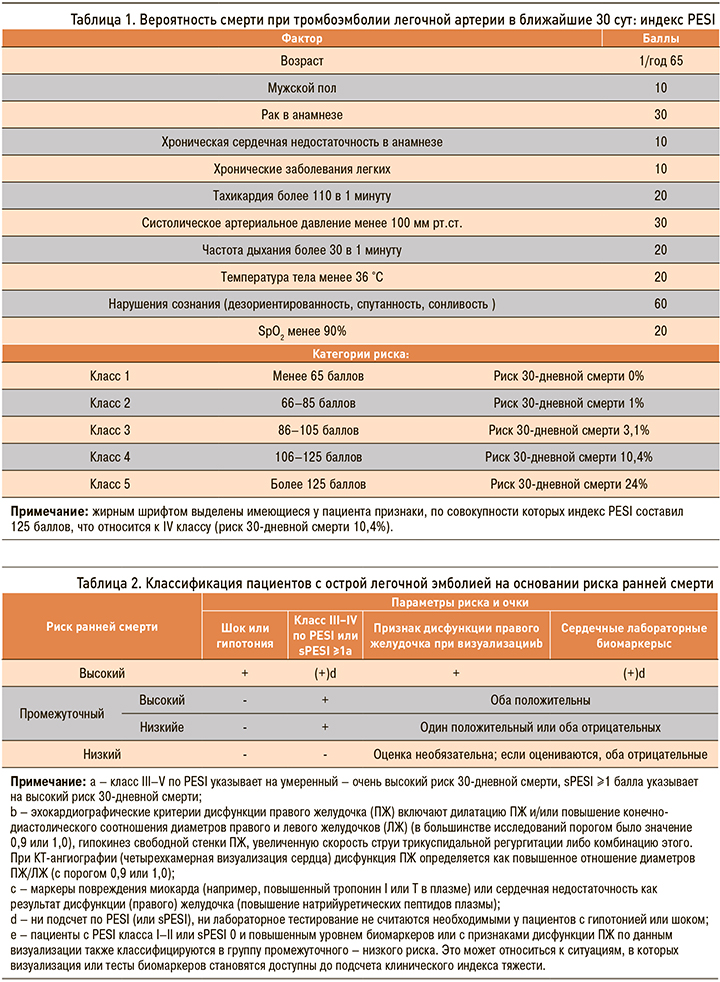
У пациента В. не было гипотонии, но имелся IV класс риска по PESI, т.е. высокая ожидаемая смертность (4,0–11,4%), эхокардиографические признаки дисфункции правого желудочка без повышения уровня сердечных биомаркеров, что соответствовало промежуточному низкому риску.
В ходе дальнейшего диагностического поиска при УЗИ органов брюшной полости выявлено диффузное изменение ткани печени и поджелудочной железы по типу стеатоза без увеличения размеров, безболезненное при глубокой пальпации датчиком, и множественные образования в печени.

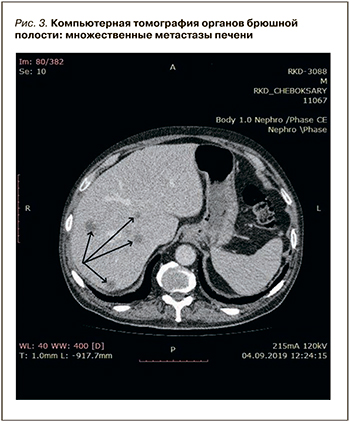
При выполнении компьютерной томографии органов брюшной полости найдено образование в хвосте поджелудочной железы с незначительным накоплением контраста и множественные метастазы в печени без увеличения лимфатических узлов (рис. 2, 3).
 С учетом клинико-анамнестических, лабораторных и инструментальных данных пациенту был выставлен следующий клинический диагноз: «двусторонняя тромбоэмболия сегментарных ветвей легочной артерии промежуточно низкого риска на фоне тромбоза глубоких вен нижних конечностей и злокачественного новообразования хвоста поджелудочной железы Т3NXM1. Синдромный (панкреатогенный) сахарный диабет».
С учетом клинико-анамнестических, лабораторных и инструментальных данных пациенту был выставлен следующий клинический диагноз: «двусторонняя тромбоэмболия сегментарных ветвей легочной артерии промежуточно низкого риска на фоне тромбоза глубоких вен нижних конечностей и злокачественного новообразования хвоста поджелудочной железы Т3NXM1. Синдромный (панкреатогенный) сахарный диабет».
У пациента В. имелся высокий риск геморрагических осложнений, чему способствовало ЗНО поджелудочной железы, анемия, тромбоцитопениия медикаментозная, гипокоагуляция. Исходя из диагноза, была выбрана консервативная тактика лечения: назначен низкомолекулярный гепарин – эноксапарин натрия в необходимой дозе, которая рассчитывается на 1 кг массы тела.
На фоне проводимой терапии достигнуто снижение систолического давления в легочной артерии до 51 мм рт.ст., тромбы в полостях сердца не визуализировались. При УЗДГ вен нижних конечностей визуализируемые изменения характеризовали подострый процесс.
На ЭКГ сформировалась инверсия зубцов Т в правых грудных отведениях (V2–V3).
Для дальнейшего дообследования и лечения пациент переведен в онкологический диспансер, где гистологически подтверждена аденокарцинома поджелудочной железы G III, назначена полихимиотерапия.
Стоит отметить, что характерные для патологии поджелудочной железы боли в животе с иррадиацией в межлопаточное пространство появились у больного через месяц после перевода.
Описанный случай рака поджелудочной железы, дебютировавший тромбоэмболическим синдромом и сахарным диабетом, демонстрирует важность проведения онкопоиска у пациентов с идиопатическим сосудистым тромбозом. Из лабораторных показателей маркерами паранеопластического процесса выступали гамма-глутаминтрансфераза и высокий уровень сахара в сыворотке крови.
Механизм формирования тромбоэмболических осложнений у данного пациента обусловлен активностью ЗНО и метастатическим поражением.
В соответствии с рекомендациям Европейского общества кардиологов (2014) при промежуточном риске ТЭЛА и высоком риске кровотечений была выбрана консервативная тактика [18]. С учетом онкозаболевания рекомендуется назначение парентеральных антикоагулянтов на срок не менее 3–6 мес (класс рекомендаций 1A), предпочтительнее низкомолекулярные гепарины (класс рекомендаций 1B) [17, 18].
Для определения рисков ВТЭ у онкологических больных используются различные шкалы. Американское общество клинической онкологии (ASCO) в настоящее время рекомендует использование шкалы Khorana (табл. 3) для определения риска развития ВТЭ до начала проведения химиотерапии и периодически после окончания ее [19–21].
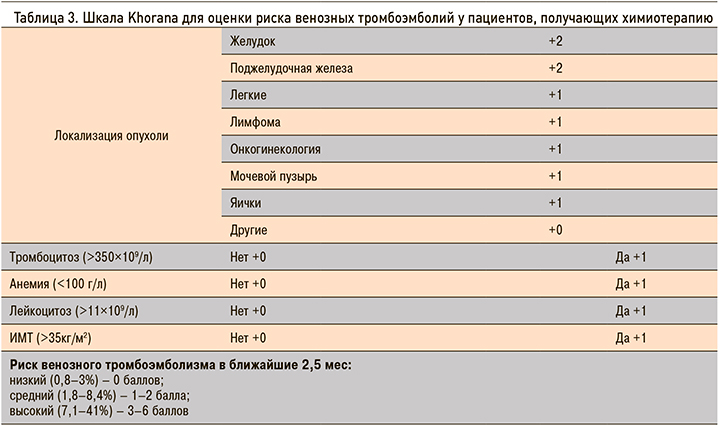
Позже эта модель была дополнена внедрением двух дополнительных биомаркеров – D-димера и растворимого P-селектина, показавших высокую прогностическую ценность (шкала Vienna CAT) [19]. В представленном случае у пациента риск развития ВТЭ был оценен как высокий (4 балла).
ЗАКЛЮЧЕНИЕ
Таким образом, тромбоэмболии выступают ранним признаком паранеопластического процесса, а сама злокачественная опухоль расценивается как независимый фактор высокого риска развития ВТЭ.
Для совершенствования диагностики ЗНО на ранней стадии следует формировать группу больных с повышенным риском развития рака поджелудочной железы. В нее стоит включать пациентов с внезапным увеличением уровня сахара в крови, не имеющих семейного анамнеза по сахарному диабету, но с отягощенным онкологическим семейным анамнезом, в возрасте старше 50 лет, курящих. Пациентам этой группы необходимо провести тщательное обследование на предмет исключения ЗНО, в том числе и поджелудочной железы, и установить диспансерное наблюдение с целью своевременной диагностики и профилактики как формирования ЗНО, так и его ранних осложнений в виде ВТЭ.


