Хроническая сердечная недостаточность (ХСН) и хроническая обструктивная болезнь легких (ХОБЛ) имеют общие факторы риска (курение, возраст), а также патофизиологические механизмы (системное воспаление, активация нейрогуморальных систем). Часто эти заболевания существуют вместе, что способствует утяжелению клинического состояния и развитию неблагоприятного прогноза у таких коморбидных пациентов [1–5].
Имеются данные, что как ХСН, так и ХОБЛ негативно влияют на жесткость сосудов, увеличивая их ригидность посредством разнообразных механизмов: системного и сосудистого воспаления, воздействия оксидативного стресса [6–10].
Системное воспаление – важный компонент ХОБЛ, который способствует клиническим проявлениям заболевания, а также играет ключевую роль в развитии атеросклероза коронарных артерий. Одним из маркеров воспаления выступает С-реактивный белок (СРБ). При этом некоторые исследования показывают, что СРБ – не только маркер воспаления, но и фактор, участвующий в патогенезе атеросклероза за счет активации эндотелиальных и гладкомышечных клеток артерий. Развитие атеросклеротических изменений в стенке сосудов создает условия для снижения эластичности магистральных артерий [11]. В результате у пациентов с ХОБЛ увеличивается риск возникновения сердечно-сосудистых событий, в частности острого инфаркта миокарда, который впоследствии может приводить к ХСН [12–15].
В процессе прогрессирования ХСН включается целый ряд патологических патогенетических механизмов, обусловливающих развитие атеросклеротических изменений в сосудистом русле с последующим увеличением их ригидности: окислительный стресс, провоспалительное и протромботическое состояние, нарушение эндотелиальной функции [16]. В то же время повышенная ригидность магистральных артерий рассматривается как один из значимых неблагоприятных прогностических критериев и является независимым маркером сердечно-сосудистого риска [17, 18]. Установлена роль в развитии кардиоваскулярных осложнений провоспалительных цитокинов – фактора некроза опухоли-5α (ФНО-5α) и интерлейкина 56 (ИЛ-56): они индуцируют синтез СРБ и способствуют ухудшению течения сердечной недостаточности [19].
Как ХСН, так и ХОБЛ сопровождаются развитием гипоксии. Гипоксия на фоне ХОБЛ способствует повышению потребности миокарда в кислороде. Длительная работа сердца в подобных условиях приводит к снижению сократительной функции миокарда. При этом гипоксия тканей, наблюдающаяся при ХСН, служит фактором, провоцирующим снижение насосной функции сердца, увеличение преднагрузки и постнагрузки, изменения ритма сердца, что усугубляет течение обоих заболеваний [20].
Для устранения гипоксии тканей в клинической практике широко применяют корректор метаболизма мельдоний – антиоксидант и антигипоксант, переключающий процесс образования энергии в клетках на анаэробный гликолиз (что особенно важно в условиях гипоксии, характерной для указанных коморбидных состояний) и таким образом адаптирующий метаболизм к функционированию клетки в условиях ишемии. Эффективность применения мельдония установлена при многих сердечно-сосудистых заболеваниях, включая ХСН [21–26]. Также есть сведения о положительном влиянии мельдония на сосуды за счет снижения в плазме крови уровня конечного продукта перекисного окисления липидов, что ведет к уменьшению воспалительных процессов в сосудистой стенке и снижению их периферического сопротивления, а также к устранению вазоспазма [22, 27, 28].
Однако изучение сочетанного влияния мельдония на жесткость сосудистой стенки и уровень СРБ у пациентов с ХСН и ХОБЛ в доступной нам литературе мы не нашли, что и стало целью нашего исследования.
МАТЕРИАЛ И МЕТОДЫ
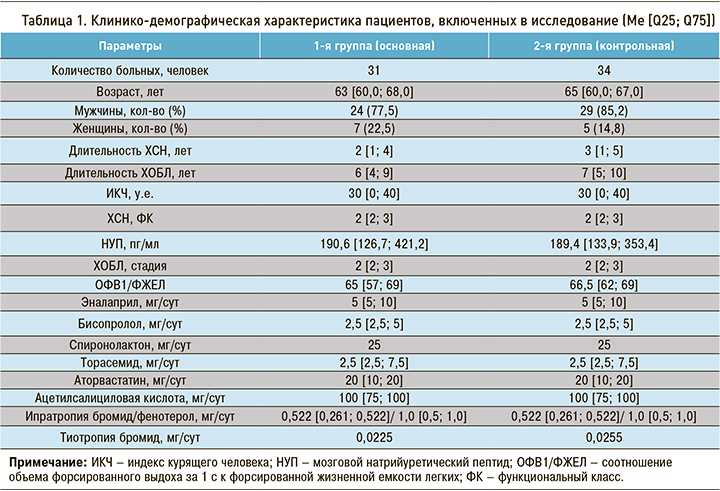
В проспективное открытое рандомизированное неконтролируемое исследование было включено 65 амбулаторных больных обоего пола в возрасте 45–70 лет с диагностированными ХСН ишемического генеза II–III функционального класса (ФК) по NYHA (с постинфарктным кардиосклерозом в анамнезе давностью от 1 года до 5 лет) и ХОБЛ c I–III степенями ограничения воздушного потока (классификация GOLD-2019) в стадии стойкой ремиссии.
Кроме указанных параметров, критерием включения в клиническое исследование было наличие письменного информированного согласия пациентов о включении в исследование, утвержденного Региональным этическим комитетом.
Критериями исключения служили невозможность или нежелание пациента выполнять условия исследования, декомпенсированная ХСН, неконтролируемая злокачественная артериальная гипертония, острый период инфаркта миокарда, стенокардия напряжения IV ФК, нестабильная стенокардия, нарушения ритма высоких градаций, сахарный диабет I и II типа, тяжелые заболевания эндокринной системы, тяжелые неврологические и психические расстройства, беременность, лактация, клинически выраженная печеночная и почечная недостаточность, любые заболевания, способные затруднить проведение любого этапа исследования, участие больного в других клинических исследованиях в течение последнего месяца.
Исследование проводилось в соответствии с этическими принципами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации (2008), трехсторонним соглашением по надлежащей клинической практике (ICHGCP), Конституцией РФ, Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». Исследование одобрено региональным этическим комитетом. Письменное информированное согласие получено у всех участников исследования до начала выполнения любых процедур исследования.
С помощью простой рандомизации все пациенты были разделены на 2 группы:
- 1-я (основная) группа (n=31), наряду с базисной терапией ХСН и ХОБЛ, принимала мельдоний в дозировке 1000 мг/сут [29];
- 2-я (контрольная) группа (n=34) получала только базисную терапии ХСН и ХОБЛ.
Период наблюдения за пациентами составил 12 нед [29]. Такая длительность приема мельдония в составе базисного лечения позволяла объективно оценить клиническое значение его включения в терапию.
Больные, принимавшие участие в исследовании, были сопоставимы по основным клинико-демографическим характеристикам, тяжести проявлений ХСН и ХОБЛ, а также по принимаемым дозам базисной терапии сердечной недостаточности (эналаприл, бисопролол, ацетилсалициловая кислота, аторвастатин, при необходимости торасемид, спиронолактон) и ХОБЛ (ипратропия бромид/фенотерол, тиотропия бромид). 4 пациентам с ХОБЛ был назначен ингаляционно беклометазон. Клинико-демографическая характеристика больных представлена в таблице 1.
Исходно и через 12 нед терапии оценивались изменения в показателях жесткости сосудистой стенки путем расчета скорости распространения пульсовой волны по сосудам эластического (СРПВ Сэ.) и мышечного (СРПВ См.) типов. Для изучения ригидности магистральных артерий использовалась сфигмографическая приставка АПК «Поли-Спектр-8/Е». Учитывался процент встречаемости пациентов с показателем СРПВ Сэ.>10 м/с и СРПВ См.>10 м/с (увеличение СРПВ>10 м/с является фактором риска смертности от сердечно-сосудистых заболеваний) [30].
Уровень высокочувствительного СРБ в крови изучался с применением турбидиметрического метода (АО «Витал Девелопмент Корпорэйшн»), за референсные были приняты его значения 0–10 мг/мл.
Статистическая обработка полученных результатов проводилась с помощью программы STATISTICA 6.0. Нормальность распределения показателей в вариационном ряду оценивалась по критерию Шапиро–Уилка. Критерию нормальности не соответствовал ни один из изучаемых показателей. Полученные результаты представлены в виде Me [Q25; Q75], где Me – медиана, [Q25; Q75] – 25 и 75 процентили соответственно; для качественных показателей использовалась такая величина, как частота встречаемости (%). Сравнение данных двух независимых выборок по количественному показателю выполнялось с помощью критерия Манна–Уитни, при анализе результатов до и после лечения в каждой группе использовался критерий Вилкоксона, качественные признаки оценивались с применением точного метода Фишера. Достоверными считались различия показателей при p <0,05.
РЕЗУЛЬТАТЫ
На фоне лечения мельдонием в составе комплексной терапии ХСН и ХОБЛ отмечено уменьшение степени выраженности хронического воспаления. Это уменьшение проявлялось достоверным снижением уровня СРБ в крови в основной группе пациентов на 31,2% относительно исходного уровня (p <0,05), тогда как в группе контроля достоверных изменений этого показателя не наблюдалось (достоверность межгрупповых различий – р1-2 <0,01). Также в группе исследования, получавшей в дополнение к базисной терапии мельдоний, выявлено статистически значимое уменьшение процента больных с уровнем СРБ ≥10 мг/мл – на 22,6% (p <0,05); при этом в группе пациентов, находившихся только на базисной терапии, достоверных изменений аналогичного показателя не было выявлено (р1-2 <0,05) (табл. 2).
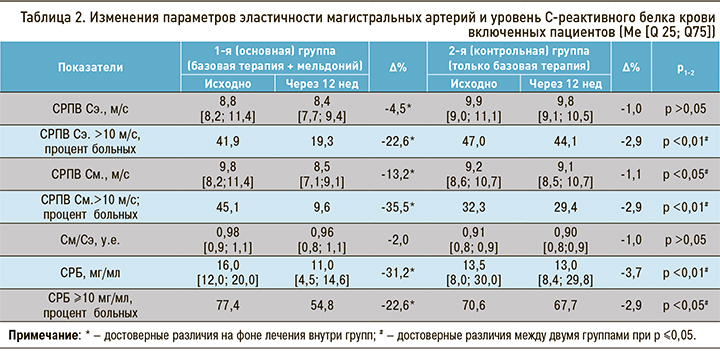
У пациентов, принимавших мельдоний в течение 12 нед в составе комплексной терапии ХСН и ХОБЛ, отмечалось снижение СРПВ относительно исходного уровня: по сосудам эластического типа – на 4,5% (р <0,05), по сосудам мышечного типа – на 13,2% (р <0,05). В контрольной группе достоверных изменений этих параметров не выявлено (р1-2 >0,05 для СРПВ Сэ.; р1-2 <0,05 для СРПВ См.) (см. табл. 2).
В основной группе обнаружено статистически значимое снижение частоты встречаемости пациентов с СРПВ Сэ. >10 м/с (-22,6%; р <0,05) и с СРПВ См. >10 м/с (-35,5%; р <0,05). В контрольной группе оба аналогичных показателя снизились на незначительную величину (достоверность межгрупповых различий по обоим показателям – p <0,01) (см. табл. 2).
При проведении корреляционного анализа исходно у всех больных ХСН и ХОБЛ выявлена достоверная связь между СРПВ Сэ. и уровнем СРБ (r=0,28; р <0,05). В основной группе пациентов через 12 нед терапии с включением мельдония эта связь статистически значимо усилилась (r1–1=0,4), тогда как как в контрольной группе корреляция не изменилась (r2–2=0,28).
ОБСУЖДЕНИЕ
Достоверное снижение СРБ, свидетельствующее об уменьшении воспалительного компонента, происходило параллельно с увеличением эластичности магистральных артерий в основной группе пациентов, что подтверждается усилением корреляционной связи между СРПВ Сэ. и уровнем СРБ. Данный феномен благоприятного влияния исследуемого препарата на эластичность магистральных артерий может быть связан со следующим механизмом действия мельдония: он обратимо ингибирует гамма-бутиробетаин (ГББ) – последний фермент в цепочке биосинтеза карнитина, который, в свою очередь, участвует в переносе длинноцепочечных жирных кислот в митохондрии клеток для образования аденозинтрифосфата. При снижении количества карнитина уровень ГББ резко возрастает. Поскольку же ГББ по своей геометрии напоминает ацетилхолин, повышение его концентрации в плазме крови влечет за собой активацию ацетилхолиновых рецепторов на эндотелии кровеносных сосудов. В результате происходит индукция биосинтеза оксида азота, который способствует вазодилатации сосудистого русла, что, возможно, обеспечивает больший приток крови к органам и тканям [31–33]. Можно предположить, что за счет улучшения кровоснабжения увеличивается приток противовоспалительных клеток крови (Т-хелперов, Т-супрессоров) и, по-видимому, нормализуется количество циркулирующих иммунных комплексов, а это создает условия для уменьшения активности воспалительного процесса.
Важно, что снижение воспалительного компонента, выражающееся в уменьшении концентрации СРБ в крови, а также нормализация функции эндотелия способствуют уменьшению ригидности магистральных артерий; в исследовании это было отмечено в виде достоверного снижения СРПВ как по сосудам эластического, так и мышечного типов. Подобное воздействие мельдония на уровень СРБ в дополнение к базисной терапии при различных нозологиях было описано ранее в ряде работ [34, 35]. Можно сделать предположение, что на фоне снижения ригидности магистральных артерий обеспечивается нормализация кровотока и опять-таки улучшается приток противовоспалительных компонентов крови, которые еще больше снижают воспалительные процессы в сосудистой стенке. Улучшение состояния сосудистого русла у таких коморбидных пациентов, вероятно, обусловлено вазодилатирующим действием и «противовоспалительным» эффектом мельдония.
Выявленная в процессе комплексной терапии с мельдонием у больных ХСН и ХОБЛ высокодостоверная корреляция между уровнем СРБ и СРПВ Сэ. может подтверждать общность патогенетических звеньев у таких коморбидных пациентов.
ЗАКЛЮЧЕНИЕ
У больных ХСН и ХОБЛ в стадии стойкой ремиссии обнаружен повышенный уровень СРБ, свидетельствующий об активности низкоинтенсивного системного воспаления, а также выявлена достоверная корреляционная связь между увеличением концентрации СРБ сыворотки крови и ростом ригидности магистральных артерий.
Применение мельдония в составе комплексной базисной терапии ХСН и ХОБЛ способствует статистически значимому регрессу выраженности воспаления, проявляющемуся в достоверном уменьшении уровня СРБ и параллельному улучшению показателей эластичности магистральных артерий в виде снижения СРПВ как по сосудам эластического, так и мышечного типов в сравнении с группой контроля. Последнее свидетельствует о целесообразности включения мельдония в состав комплексной терапии больных ХСН в сочетании с ХОБЛ.



