Фибрилляция предсердий (ФП) у лиц пожилого возраста является частым осложнением острого инфаркта миокарда [1–3], существенно отягощает состояние больного, приводит к ухудшению гемодинамических показателей и появлению возвратной ишемии миокарда [4–6]. В настоящее время накоплен большой объем данных о причинах, электрофизиологических механизмах и гемодинамических последствиях развития ФП при инфаркте миокарда [7], однако ряд вопросов, относящихся к данным нарушениям ритма, остается малоисследованными. К их числу относится структура тревожно-депрессивных расстройств, состояние эластотонических свойств сосудистой стенки, функции эндотелия и ремоделирование сердца у больных инфарктом миокарда с различными формами ФП.
Цель исследования – оценить показатели контурного анализа пульсовой волны и функцию эндотелия, а также структурно-функциональные изменения миокарда и выраженность эмоциональных расстройств у больных с инфарктом миокарда при различных формах ФП.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось у 138 человек (63 мужчины, 75 женщин, средний возраст 72,8±8,9 года) в период их лечения в кардиологическом отделении Городской клинической больницы № 7 (г. Тверь) с диагнозом «инфаркт миокарда с ФП». В зависимости от формы ФП больные были разделены на 2 группы: первая – 83 (60,1%) пациента с пароксизмальной формой, вторая – 55 (39,9%) с постоянной формой. Обследование проводилось в первые 72 ч нахождения больных в стационаре.
Всем пациентам было проведено общеклиническое обследование с изучением локализации инфаркта миокарда, его кратности (первичный, повторный) и осложнений (острая левожелудочковая недостаточность по Killip, 1967г.) [8].
Определялся липидный спектр плазмы крови (общий холестерин, липопротеиды низкой, высокой плотности, триглицериды; ммоль/л) на фоне приема гиполипидемических препаратов (аторвастатин в дозе 40–80 мг/сут) [9].
Эхокардиографическое исследование выполнялось на аппарате Vivid I (GE Healthcare, Великобритания) с оценкой фракции выброса (ФВ, %), конечного диастолического размера левого желудочка (КДРЛЖ, мм), конечного диастолического объема левого желудочка (КДОЛЖ, мл), толщины задней стенки левого желудочка (ТЗСЛЖ, мм), толщины межжелудочковой перегородки (ТМЖП, мм), размеров левого (ЛП, мм), правого предсердия (ПП, мм) и правого желудочка (ПЖ, мм), систолического давления в легочной артерии (СДЛА, мм рт.ст.) [10].
Жесткость сосудистой стенки изучалась фотоплетизмографическим методом (аппарат «Ангиоскан-1») утром в затемненном помещении. До проведения исследования больной в течение 600 с должен был находиться в расслабленном состоянии. Во время анализа больной сидел за столом с неподвижными кистями. Контурный анализ включает следующие этапы.
1. Измерение артериального давления (АД) типовым осциллометрическим методом с помощью прибора, прошедшего сертификацию.
2. Внесение информации обследуемого (уровень АД, рост, вес, дата рождения) в компьютерную программу «АнгиоСкан».
3. Закрепление оптического преобразователя на фалангу указательного пальца левой руки с регистрацией и оценкой пульсовых волн.
По данным контурного анализа фотоплетизмограммы [11] оценивались частота пульса (уд./ мин), индекс жесткости (SI, м/с), индекс отражения (RI, %), индекс окклюзии по амплитуде (ИОА, %), индекс увеличения (Alp, %), индекс увеличения нормализованный для частоты пульса (ЧП=75; Alp 75 – HR=75), возрастной индекс (AGI), возраст сосудистой системы (VA, лет), продолжительность систолы (ED, м/с), длительность пульсовой волны (PD, м/с), центральное систолическое давление (Spa, мм рт.ст.), тип пульсовой волны (A, B, C). Для регистрации эндотелиальной функции выполнялось исследование с реактивной гиперемией с вычислением индекса окклюзии по амплитуде (ИОА, усл. ед.) и сдвига фаз (СФ, мс) между каналами. После окклюзии плечевой артерии в течение 300 с синхронно происходит занесение данных сигнала показателей фотоплетизмограммы. Через 300 с давление в манжете сбрасывается до нуля, и происходит внесение данных сигнала на протяжении 180 с.
Тревога и депрессия оценивалась по шкале HADS [12], состоящая из 14 вопросов. Для анализа и оценки результатов исследования использовались типовые методы описательной статистики: вычисление средних значений и стандартного отклонения (М±σ) для нормального распределения. В основу статистической обработки материала были положены непараметрические методы (χ2). Связь между переменными оценивалась с помощью рангового коэффициента корреляции (r) Спирмена. Различия распределений считали достоверными при р <0,05. Для статистической обработки полученных результатов использовались программы Statistica, версия 10.
РЕЗУЛЬТАТЫ
 Среди больных первой группы (возраст 71,9±8,9 года) передний инфаркт миокарда был зарегистрирован в 33 (39,7%) случаях, нижний – в 20 (24,3%), повторный передний – в 15 (18,0%), повторный нижний – в 15 (18,0%). Во второй группе (возраст 73,7±9,0 года) передний инфаркт миокарда встречался у 25 (45,4%) пациентов, нижний – у 17 (30,9%), повторный передний – у 11 (20,0%), повторный нижний – у 2 (3,6%).
Среди больных первой группы (возраст 71,9±8,9 года) передний инфаркт миокарда был зарегистрирован в 33 (39,7%) случаях, нижний – в 20 (24,3%), повторный передний – в 15 (18,0%), повторный нижний – в 15 (18,0%). Во второй группе (возраст 73,7±9,0 года) передний инфаркт миокарда встречался у 25 (45,4%) пациентов, нижний – у 17 (30,9%), повторный передний – у 11 (20,0%), повторный нижний – у 2 (3,6%).
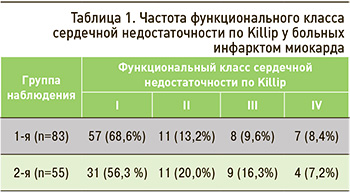
Как видно из данных, приведенных в таблице 1, у больных с пароксизмальной формой ФП преобладал I и II, реже III и IV функциональный класс острой сердечной недостаточности, тогда как у больных с постоянной формой ФП была увеличена частота II и III функционального класса при уменьшении I и IV.
У больных с постоянной формой ФП по сравнению с пароксизмальной формой наблюдалось статистически значимое увеличение ЛП, ПП, СДЛА, также регистрировалась тенденция к повышению показателей КДРЛЖ, КДОЛЖ, ТЗСЛЖ, ПЖ (табл. 2). Это свидетельствует о значительных структурных изменениях миокарда у больных с постоянной формой ФП, которые сочетаются с признаками выраженной сердечной недостаточности.
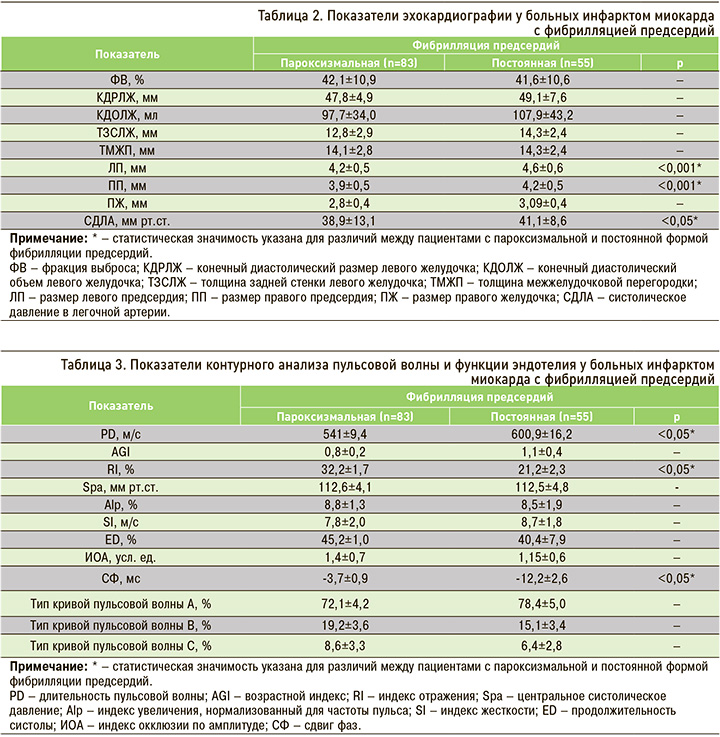
Согласно данным таблицы 3, у больных инфарктом миокарда с постоянной формой ФП по сравнению с пароксизмальной формой имелось достоверное увеличение PD, уменьшение RI, а также тенденция к возрастанию AGI, SI, снижению ED, что свидетельствует об изменении эластичности сосудистой стенки в крупных резистивных артериях. Высокий тонус мелких мышечных артерий у пациентов с пароксизмальной формой ФП служит дополнительным фактором риска поражения сердечной мышцы. В изучаемых группах регистрировался рост частоты пульсовой волны типа А и В, при этом тип кривой С имел тенденцию к снижению, что отражает уменьшение эластичности сосудистой стенки. Однако у лиц с постоянной формой ФП данные типы волн встречались чаще, чем у лиц с пароксизмальной формой, что свидетельствуют о значительном увеличении постнагрузки на миокард левого желудочка и нарушении его диастолического расслабления.
При оценке эндотелиальной функции у больных второй группы по сравнению с первой группой отмечалось статистически значимое уменьшение СФ, а также тенденция к снижению ИОА, что указывает на значительные нарушения функции эндотелия в крупных мышечных артериях.
У больных первой группы имела место прямая корреляционная связь средней силы между показателями КДОЛЖ и RI (r=+0,536), AIp и Spа (r=+0,523), VA и Spа (r=+0,588), обратная корреляционная связь слабой силы между ФВ и RI (r=- 0,492) и средней силы между ТМЖП и RI (r=- 0,624). У пациентов второй группы регистрировалась прямая корреляционная связь средней силы между показателями ИОА и ТЗСЛЖ (r=+0,517), SI и ТЗСЛЖ (r=+0,520), SI и ТМЖП (r=+0,530), Spа и ФВ (r=+0,543), SI и RI (r=+0,569), AIp 75 и SI (r=+0,706), AIp 75 и RI (r=+0,712).
При изучении тревожных расстройств (рис. 1) между пациентами с пароксизмальной и постоянной формой ФП не выявлено статически значимых изменений. У большинства больных инфарктом миокарда с пароксизмальной формой ФП отсутствовала тревога, реже встречалась субклиническая тревога и значительно реже клинически выраженная тревога. У пациентов с постоянной формой ФП по сравнению с пароксизмальной формой отмечалось увеличение частоты субклинически и клинически выраженной тревоги. В первой группе у лиц с отсутствием тревоги ее уровень по шкале HADS составил 3,59±2,0 баллов, у пациентов с субклинически выраженной тревогой – 8,9±0,8 баллов, с клинически выраженной тревогой – 12,0±0,1 баллов. Во второй группе аналогичные показатели были равны 3,6±1,8; 8,8±0,7 и 12,0±0,9 баллов соответственно.
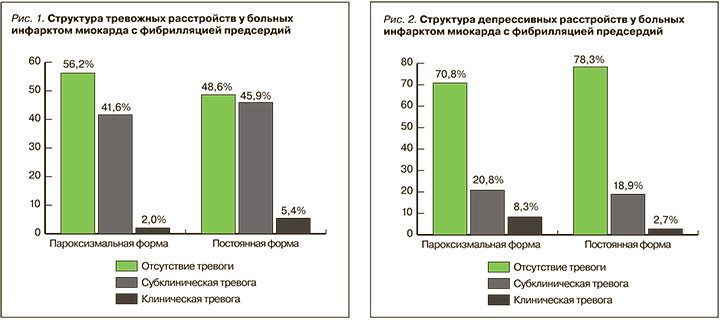
При изучении депрессивных расстройств (рис. 2) в первой группе частота субклинически и клинически выраженной депрессии была выше, чем во второй. В первой группе у лиц с отсутствием депрессии ее уровень по шкале HADS был равен 4,2±1,8 баллов, у пациентов с субклинически выраженной депрессией – 8,8±0,7 баллов, с клинически выраженной депрессией – 12,5±0,5 баллов. Во второй группе аналогичные показатели составили 3,7±2,0;8,5±0,7 и 13,0±0,1 баллов соответственно.
Как показало проведенное исследование, наиболее неблагоприятное течение инфаркта миокарда встречается у больных с постоянной формой ФП в виде значительных структурных изменений миокарда в сочетании с признаками выраженной сердечной недостаточности. Это согласуется c литературными данными [13, 14]. Равным образом фотоплетизмографическим методом выявлено снижение эластичности артериальной сосудистой стенки и значительное нарушение функции эндотелия в крупных мышечных артериях, особенно у больных пожилого возраста с постоянной формой ФП. Настоящее исследование впервые связывает эмоциональные расстройства у больных пожилого возраста с инфарктом миокарда при различных формах ФП.
ЗАКЛЮЧЕНИЕ
У больных инфарктом миокарда с постоянной формой ФП в отличие от больных с пароксизмальной формой отмечаются значительные структурные изменения миокарда, дисфункция эндотелия при снижении эластичности артериальной сосудистой стенки. При пароксизмальной форме ФП эмоциональная нагрузка характеризуется преобладанием депрессивных расстройств, а при постоянной форме – тревожных, что необходимо учитывать при проведении лечебно-профилактических и психокоррекционных мероприятий и решении экспертных вопросов.


