Заболевания сердечно-сосудистой системы давно занимают ведущее место в общей структуре заболеваемости, инвалидности и смертности населения как в России, так и во многих странах мира. В развитие сердечно-сосудистых заболеваний (ССЗ) весомый вклад вносят такие традиционные факторы риска, как артериальная гипертензия (АГ), дислипидемия, гипергликемия. Медикаментозная и немедикаментозная коррекция основных факторов риска развития ССЗ позволяет достигнуть определенных успехов по увеличению продолжительности жизни таких больных, однако смертность от сердечно-сосудистой патологии все еще остается высокой. Безусловную важность в связи с этим представляет изучение дополнительных факторов риска ССЗ, одним из которых считают гиперурикемию.
Повышением концентрации мочевой кислоты в крови все чаще пытаются объяснить угрозу возникновения не только подагры, но и таких значимых патологических процессов, как АГ, атеросклероз и хроническая болезнь почек (ХБП) [1–4]. Единой точки зрения, всесторонне объясняющей взаимосвязь гиперурикемии и сердечно-сосудистой патологии, пока не существует, хотя предложен ряд концепций, так или иначе трактующих возможное влияние мочевой кислоты на формирование и прогрессирование целого ряда ССЗ.
Патогенетическая роль мочевой кислоты при сердечно-сосудистой патологии может определяться многообразными механизмами. Прежде всего необходимо отметить, что мочевая кислота тесно связана со многими известными факторами риска ССЗ, инсулинорезистентностью и метаболическим синдромом, ожирением и неалкогольной жировой болезнью печени, ХБП [5]. Между уровнем мочевой кислоты и всеми указанными выше факторами существует нередко отчетливая зависимость, и выявление индивидуального вклада каждого фактора может оказаться затруднительным. В связи с этим повышенный уровень мочевой кислоты в крови может рассматриваться как детерминанта сердечно-сосудистого риска или как эпифеномен сопутствующих кардиометаболических факторов риска (маркер риска) [6].
ОСНОВНЫЕ ЭФФЕКТЫ МОЧЕВОЙ КИСЛОТЫ
Как известно, мочевая кислота представляет собой продукт ксантиноксидазы – одного из наиболее важных источников свободных радикалов кислорода в организме. Результаты некоторых клинических и экспериментальных исследований позволяют высказать предположение о существенной роли гиперурикемии в патогенезе окислительного стресса [2, 4]. Высокий уровень мочевой кислоты может быть маркером или следствием повышенной активности ксантиноксидазы и повышенного окислительного стресса. Сама по себе ксантиноксидаза оказывает несомненное влияние на развитие ССЗ, связанное главным образом (но не полностью) с генерацией активных форм кислорода и повышенным окислительным стрессом [7]. Ксантиноксидаза сопряжена, кроме того, с другим существенным источником активных форм кислорода – ферментом НАДФН-оксидазой; активные формы кислорода, продуцируемые ксантиноксидазой, активируют НАДФН-оксидазу, и наоборот [7]. По мнению ряда авторов, повышение уровня мочевой кислоты у пациентов с высоким риском ССЗ может служить лишь маркером окислительного стресса, возникающего в условиях локальной ишемии [8].
Следует иметь в виду, что мочевая кислота сама по себе оказывает целый ряд негативных воздействий и, таким образом, может быть непосредственно вовлечена в патогенез ССЗ. В целом прооксидантная активность, истощение оксида азота (NO) и эндотелиальная дисфункция, стимулирование воспаления и потенцирование сосудосуживающих и пролиферативных сосудистых стимулов можно расценивать как наиболее очевидные механизмы вовлечения мочевой кислоты в патогенез болезней системы кровообращения.
Мочевая кислота может воздействовать и как антиоксидант и играть важную физиологическую роль в защите от окислительного стресса. Она нейтрализует несколько окислителей, включая синглетный кислород, супероксид, пероксид и гидроксильные радикалы, и защищает эндотелий сосудов от внешнего окислительного стресса [9]. Мочевая кислота предотвращает также вызванное пероксинитритом нитрозирование белка, перекисное окисление липидов и белков, инактивацию тетрагидробиоптерина (кофактора эндотелиальной синтазы NO) и опосредованное окисление липопротеинов низкой плотности [10].
Однако в зависимости от окружающей химической среды мочевая кислота может превращаться в прооксидант в цитоплазме или атеросклеротических бляшках. В присутствии переходных металлов мочевая кислота может дополнительно окислять частично окисленные липопротеины низкой плотности, что вызывает еще более выраженное их окисление. В результате реакции мочевой кислоты с пероксинитритами образуются несколько радикалов, способных усиливать прооксидантное состояние. Мочевая кислота, присутствующая в атеросклеротических бляшках, действует как прооксидант в гидрофобной/кислой среде [6].
Избыток мочевой кислоты либо возбуждает, либо стимулирует процесс эндотелиальной дисфункции и ремоделирования сосудов. Мочевая кислота способна проникать в клетки эндотелия и провоцировать вазоконстрикцию и эндотелиальную дисфункцию. Повышение ее концентрации в сыворотке крови способствует увеличению адгезивной и агрегационной способности тромбоцитов наряду с повышением пролиферации гладкомышечных клеток сосудов и прогрессированием атеросклеротического процесса [1–3, 11].
К одному из наиболее важных патогенетических механизмов, посредством которых мочевая кислота участвует в развитии сердечно-сосудистой патологии, относят снижение доступности NO. Мочевая кислота реагирует непосредственно с ним в быстрой и необратимой реакции, приводящей к истощению 6-аминоурацила и NO. Поскольку эндотелиальный NO контролирует сосудистый тонус, предотвращает адгезию и агрегацию тромбоцитов и уменьшает пролиферацию сосудистой интимы, снижение его доступности можно рассматривать как основную причину эндотелиальной дисфункции и связанного с гиперурикемией высокого риска ССЗ [4, 9].
Как показано в эксперименте, мочевая кислота способствует сужению сосудов и пролиферации гладкомышечных клеток сосудов, увеличивает экспрессию ангиотензина II в эндотелиальных клетках и активирует систему ренин-ангиотензин-альдостерон [9]. Клинические исследования свидетельствуют о взаимосвязи между концентрацией мочевой кислоты в сыворотке крови и активностью ренина при АГ. Однако в одном из рандомизированных исследований показано, что терапия, снижающая уровень мочевой кислоты, не влияет на специфическую почечную или системную ренин-ангиотензин-альдостероновую систему [12]. Мочевая кислота стимулирует экспрессию эндотелина-1 в гладкомышечных клетках аорты человека и фибробластах сердца крысы [13]. У крыс с гиперурикемией отмечено повышение экспрессии ренина и циклооксигеназы-2 (ЦОГ-2) в почках, что свидетельствует о критической роли опосредованного мочевой кислотой тромбоксана в пролиферации гладкомышечных клеток сосудов, повышении давлении и почечной патологии. В эксперименте мочевая кислота проникала в гладкомышечные клетки сосудов через транспортер UART1 и стимулировала их пролиферацию с повышенной экспрессией тромбоцитарного фактора роста, ЦОГ-2 и моноцитарного хемоаттрактатного протеина-1 [6].
Повышение концентрации мочевой кислоты в сыворотке крови играет важную роль в развитии ряда метаболических нарушений, в частности инсулинорезистентности, ожирения и дислипидемии. Гиперурикемию рассматривают поэтому как ключевой компонент метаболического синдрома [1, 11]. Мочевая кислота проникает в адипоциты через транспортер URAT1 и усиливает окислительный стресс в этих клетках, что обусловливает воспаление, инсулинорезистентность и снижение синтеза адипонектина [9].
Мочевая кислота связана с концентрацией лептина в сыворотке крови у больных сахарным диабетом (СД). Она ингибирует АМФ-активированную протеинкиназу, стимулирующую глюконеогенез и выработку глюкозы при СД и голодании, а также рост бета-клеток поджелудочной железы, нарушая регуляцию метаболизма глюкозы [14]. Эти и множество других дисметаболических эффектов, вызванных повышенной активностью ксантиноксидазы, могут способствовать метаболическому синдрому, неразрывно связанному с гиперурикемией.
Следует остановиться и на провоспалительном эффекте мочевой кислоты. Ее уровень в сыворотке крови прямо коррелирует с числом лейкоцитов и нейтрофилов, содержанием С-реактивного белка, интерлейкина-6 (ИЛ-6), антагониста рецептора ИЛ-6, ИЛ-10, ИЛ-18 и фактора некроза опухоли-α (ФНО-α). Взаимосвязь между повышением уровня мочевой кислоты и увеличением синтеза провоспалительных медиаторов обнаружена не только при тяжелой сердечно-сосудистой патологии, но и субклиническом течении атеросклероза. Мочевая кислота стимулирует синтез ИЛ-1β, ИЛ-6 и ФНО-α мононуклеарными клетками, а также моноцитарного хемоаттрактантного белка-1 (имеющего большое значение в инициации атеросклеротического процесса) гладкомышечными клетками [6, 15–17].
Эпидемиологические данные свидетельствуют о том, что распространенность гиперурикемии и подагры среди населения многих стран мира постоянно возрастает [3, 18]. Для объяснения этого предложено множество концепций, включающих изменения в диете и образе жизни, постарение населения и все более частое применение антигипертензивных препаратов. Особенно важны при этом постепенная потеря активности уриказы (фермента, разлагающего мочевую кислоту до аллантоина) и отчетливые изменения питания и образа жизни населения за последнее столетие, способствовавшие повышению уровня мочевой кислоты в сыворотке крови (с 3,5 мг/дл в 1920-х гг. до свыше 6,0 мг/дл в 1970-х гг.) [9, 19]. «Западная диета» с высоким содержанием продуктов, богатых пуринами и фруктозой, внесла существенный вклад в развитие гиперурикемии и преобразование мочевой кислоты в фактор риска АГ, ожирения, метаболического синдрома и ССЗ. Как точно сформулировано Johnson R.J., мочевую кислоту можно рассматривать как физиологический сигнал тревоги, сбитый с толку западным обществом [20].
МОЧЕВАЯ КИСЛОТА И ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Связь между мочевой кислотой и ишемической болезнью сердца (ИБС) изучена в ряде исследований [21–24]. В исследовании NHANES I с участием 5926 лиц в возрасте от 25 до 74 лет показано, что увеличение уровня мочевой кислоты в сыворотке крови связано с риском смерти от ИБС как у мужчин (в 1,77 раза), так и у женщин (в 3 раза) [22]. В исследовании AMORIS изучена взаимосвязь между уровнем мочевой кислоты в сыворотке крови и риском несмертельного инфаркта миокарда, инсульта или хронической сердечной недостаточности (ХСН) у 417 734 мужчин и женщин в течение почти 12 лет наблюдения; при этом обнаружено постепенное увеличение риска острого инфаркта миокарда, инсульта или ХСН. Более значительная взаимосвязь между уровнем мочевой кислоты и острым инфарктом миокарда или ишемическим инсультом отмечена у женщин. Как у мужчин, так и у женщин отношения между содержанием мочевой кислоты и геморрагическим инсультом описываются U-образной кривой. По сравнению с инфарктом миокарда или инсультом установлена более заметная взаимосвязь между уровнем мочевой кислоты и ХСН [23]. В других исследованиях также продемонстрирована положительная корреляция между содержанием мочевой кислоты и ССЗ, а также смертностью от них [24].
В то же время в других исследованиях существенная взаимосвязь между повышенным уровнем мочевой кислоты, ССЗ и смертностью от них не установлена. Так, во Фремингемском исследовании с участием 6763 человек (в среднем возрасте 47 лет) у мужчин (после поправки на возраст) повышенный уровень мочевой кислоты не был связан с риском развития ССЗ. У женщин увеличение уровня мочевой кислоты сочеталось с повышенным риском ИБС, сердечно-сосудистой смертности и смертности от всех причин, однако с учетом корректировки на другие факторы риска ССЗ эта взаимосвязь оказалась незначимой. Использование диуретиков в данном исследовании расценивали как один из ключевых факторов, способствующих ослаблению связи между уровнем мочевой кислоты и сердечно-сосудистыми осложнениями [25].
Метаанализ 15 проспективных исследований с участием свыше 164 тыс. человек показал лишь незначительное (в 1,13 раза) увеличение риска развития ИБС при возрастании уровня мочевой кислоты [26]. В исследовании NHANES III с участием более 11 тыс. человек, наблюдавшихся в среднем в течение 14,5 лет, отмечено, что концентрация мочевой кислоты в сыворотке крови не связана с ССЗ или смертностью от ИБС [27].
Результаты двух крупных исследований в азиатской популяции выявили существенную взаимосвязь между уровнем мочевой кислоты и риском развития ИБС, а также смертностью [28, 29]. Проспективное когортное исследование с участием более 90 тыс. мужчин и женщин в возрасте старше 35 лет показало, что гиперурикемия связана со значительным увеличением риска смерти от всех причин, развития любого ССЗ или инсульта [28]. Другое азиатское исследование, в котором приняли участие более 128 тыс. взрослых людей в возрасте старше 20 лет, свидетельствовало о повышенном риске возникновения ИБС (как у мужчин, так и у женщин) на фоне гиперурикемии [29]. Результаты большого когортного исследования с участием 83 тыс. австрийских мужчин в среднем возрасте 41,6 года продемонстрировали, что повышенный уровень мочевой кислоты связан с риском смерти от инсульта или ХСН, но не от ИБС [6]. В другом исследовании с участием 28 тыс. австрийских женщин в среднем возрасте 62,3 года обнаружено, что повышенное содержание мочевой кислоты в крови служит независимым фактором риска смерти от любых ССЗ, включая ИБС, ХСН или инсульт [30]. В популяционном проспективном (на протяжении 15 лет наблюдения) исследовании Tromso с участием 2696 мужчин и 3004 женщин показана связь между повышенным уровнем мочевой кислоты в сыворотке крови и смертностью от всех причин как у мужчин, так и у женщин, а также инсультом у мужчин. Независимой связи между концентрацией мочевой кислоты и риском инфаркта миокарда не найдено [31].
Тайваньское исследование с участием 127 тыс. человек в возрасте 65 лет и старше выявило U-образную связь между уровнем мочевой кислоты и смертностью от всех причин или смертностью от ССЗ. При низком уровне мочевой кислоты более высокая общая смертность или смертность от ССЗ отмечена лишь у пациентов с недостаточностью питания [32]. В другом одномоментном исследовании с участием 564 лиц старческого возраста найдена взаимосвязь между уровнем мочевой кислоты в крови и наличием атеросклеротических бляшек в сонных артериях; повышение концентрации мочевой кислоты всего лишь на 95,5 мкмоль/л приводило к существенному увеличению объема бляшки [33]. В американском исследовании с участием свыше 4800 человек обнаружено, что уровень мочевой кислоты связан с наличием атеросклеротических бляшек в сонных артериях у мужчин независимо от наличия иных факторов риска ССЗ [34].
По мнению некоторых авторов, между уровнем мочевой кислоты и толщиной комплекса «интима–медиа» сонных артерий существует определенная взаимосвязь, не зависящая от развития и выраженности АГ [35]. В ряде исследований установлена также связь между повышенным содержанием мочевой кислоты и формированием или тяжестью кальцификации коронарных артерий, что эквивалентно коронарному атеросклерозу [36]. В одном из подобных исследований по уровню мочевой кислоты можно было предсказывать прогрессирование кальцификации коронарных артерий у женщин в постменопаузе [37].
Результаты проведенных метаанализов свидетельствуют о неоднозначной взаимозависимости между содержанием мочевой кислоты в крови и ССЗ или смертностью [26, 38]. Вместе с тем в последних метаанализах такая взаимосвязь подтверждена. Так, в метаанализе Braga F. et al. было проанализировано 12 популяционных исследований (с участием свыше 450 тыс. человек), в которых изучали взаимосвязь между уровнем мочевой кислоты и развитием ИБС, и, помимо этого, 7 исследований (с участием более 237 тыс. пациентов), в которых рассматривали связь между уровнем мочевой кислоты и смертностью от ИБС [39]. По результатам этого анализа обнаружено увеличение заболеваемости ИБС и смертности от ИБС в 1,2 раза при повышенной концентрации мочевой кислоты. Анализ в подгруппах показал незначительную связь между повышенным уровнем мочевой кислоты и заболеваемостью или смертностью от ИБС у мужчин, но в то же время установлен повышенный риск заболеваемости и смертности от ИБС у женщин с гиперурикемией. Этот риск заметно возрастал при увеличении содержания мочевой кислоты более 7 мг/дл.
В другом метаанализе, включившем 29 проспективных исследований с участием 958 тыс. человек, гиперурикемия также была сопряжена с повышенным риском заболеваемости и смертности от ИБС [21]. При каждом увеличении уровня мочевой кислоты на 1 мг/дл вероятность смерти от ИБС повышалась на 13%. В ходе этого анализа установлено, что гиперурикемия повышает (в 2,5 раза) риск смерти от ИБС преимущественно у женщин [21]. В метаанализе Zhong C. et al. (11 исследований с участием более 428 тыс. человек) показано, что повышение уровня мочевой кислоты в крови на 1 мг/дл приводит к увеличению риска возникновения инсульта в 1,1 раза [40]. Данная взаимосвязь оставалась значимой как у мужчин, так и женщин.
В большом рандомизированном исследовании изучалась причинно-следственная связь между содержанием мочевой кислоты в крови и различными заболевания посредством анализа 14 однонуклеотидных полиморфизмов, исключительно связанных с гиперурикемией; при этом не удалось подтвердить значимую роль мочевой кислоты в крови при СД 2 типа, ИБС, ишемическом инсульте и ХСН [41]. В этом исследовании показано также, что снижение уровня мочевой кислоты в сыворотке крови не сопровождается уменьшением риска ССЗ и метаболических заболеваний. В относительно недавнем обзоре наблюдательных и рандомизированных контролируемых исследований (изучавших влияние мочевой кислоты на различные показатели здоровья) найдены убедительные доказательства безусловной роли мочевой кислоты в развитии подагры и нефролитиаза, но не ССЗ [42].
Предыдущие исследования показали, что ИБС может усиливать связь между мочевой кислотой и смертностью; при этом в атеросклеротических бляшках была выявлена как мочевая кислота, так и ксантиноксидаза, причем было показано их участие в атеросклеротическом процессе. Связь между уровнем мочевой кислоты и тяжестью ангиографически подтвержденной ИБС продемонстрирована как у мужчин, так и у женщин, однако выраженность этой взаимосвязи снижалась после поправки на классические сердечно-сосудистые факторы риска [43, 44]. В группе 8832 пациентов с выраженными (≥75% сужением просвета сосудов) коронарными стенозами Okura Т. et al. отметили существенную и независимую взаимосвязь между уровнем мочевой кислоты и ССЗ, а также смертностью в течение 3 лет наблюдения [45]. Результаты ретроспективного исследования (с участием 1916 пациентов, у которых было проведено чрескожное коронарное вмешательство) продемонстрировали тенденцию к значимым взаимоотношениям между содержанием мочевой кислоты и смертностью, однако взаимосвязи гиперурикемии с угрозой возникновения и прогрессирования ССЗ (в том числе инфаркта миокарда) в течение 7 лет наблюдения не выявлено [46].
В исследовании LURIC оценивалась связь между уровнем мочевой кислоты и смертностью от всех причин, сердечно-сосудистой смертностью и внезапной сердечной смертью у 3245 человек, поступивших в стационар для проведения коронароангиографии. Среди больных с наиболее высокой концентрацией мочевой кислоты обнаружено увеличение смертности от всех причин, сердечно-сосудистой смертности, а также внезапной сердечной смерти [47]. В схожем исследовании анализировалась связь между концентрацией мочевой кислоты в сыворотке крови и смертностью в группе из более чем 13 тыс. пациентов с ангиографически подтвержденной ИБС. В этой работе уровень мочевой кислоты значимо коррелировал как с сердечно-сосудистой смертностью, так и смертностью от всех причин; эта взаимосвязь напоминала J-образную кривую с самой низкой смертностью при уровне мочевой кислоты от 5,17 до 6,76 мг/ дл, причем была более выражена у женщин [48]. В относительно недавнем метаанализе (9 исследований более чем 25 тыс. пациентов с ИБС) также найдено, что уровень мочевой кислоты был связан с увеличением сердечно-сосудистой смертности и смертности от всех причин. Каждое увеличение уровня мочевой кислоты на 1 мг/мл сопровождалось повышением риска сердечно-сосудистой и общей смертности на 12 и 20% соответственно [70].
Ряд авторов изучал роль мочевой кислотой при остром коронарном синдроме. Оказалось, что уровень мочевой кислоты тесно коррелирует с классом острой сердечной недостаточности и позволяет предсказывать развитие ХСН, а также смертности как в краткосрочном, так и в долгосрочном периоде [50]. Обнаружена также связь между концентрацией мочевой кислоты и более высокой госпитальной смертностью у больных инфарктом миокарда с подъемом сегмента ST [51]. Еще в одной работе с участием 856 больных инфарктом миокарда с подъемом сегмента ST установлено, что уровень мочевой кислоты тесно связан с риском возникновения осложнений во время пребывания в отделении интенсивной терапии [52].
МОЧЕВАЯ КИСЛОТА И СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Взаимосвязь между концентрацией мочевой кислоты и заболеваемостью, тяжестью или прогнозом ХСН изучалась в ряде исследований и метаанализов [23, 53–57]. Во Фремингемском когортном исследовании (с участием почти 5 тыс. человек) обнаружено, что заболеваемость ХСН почти в 6 раз выше у больных с самым высоким содержанием мочевой кислоты в крови по сравнению с лицами, имеющими самые низкие ее значения. Связь между гиперурикемией и ХСН обнаружена и среди участников исследования, не страдавших метаболическим синдромом [53].
В исследовании Cardiovascular Health Study (с участием лиц пожилого и старческого возраста без ХСН) выявлен более высокий (на 30%) риск развития ХСН у больных с гиперурикемией на протяжении 8-летнего периода наблюдения. Однако связь между гиперурикемией и частотой возникновения ХСН оказалась значимой лишь в подгруппах больных с нормальной функцией почек, у пациентов без АГ, гиперинсулинемии, а также у больных, не принимавших тиазидные диуретики. Каждое повышение уровня мочевой кислоты в сыворотке крови на 1 мг/дл сопровождалось увеличением риска возникновения ХСН на 12%, однако влияния гиперурикемии на риск развития инфаркта миокарда или смертности от всех причин в этом исследовании не отмечено [54].
В одном из метаанализов, включившем 28 исследований, показано, что гиперурикемия сопряжена с повышенным риском возникновения ХСН, смертности от всех причин, сердечно-сосудистой смертности и комбинированного показателя, состоявшего из случаев смерти или неблагоприятных сердечно-сосудистых событий у пациентов с ХСН. При каждом возрастании концентрации мочевой кислоты в сыворотке крови на 1 мг/ дл риск развития ХСН возрастал на 19%, а риск общей смертности или вышеуказанного комбинированного показателя – на 4 и 28% соответственно [56]. В исследовании British Regional Heart Study с участием 3440 мужчин в возрасте 60 до 79 лет без инфаркта миокарда или ХСН в анамнезе повышенный уровень мочевой кислоты в сыворотке крови был связан со значимым увеличением риска развития ХСН, но только у лиц, получавших антигипертензивные препараты. У мужчин с АГ и концентрацией мочевой кислоты более 410 мкмоль/л риск развития ХСН вдвое превышал соответствующий показатель у таких же больных с уровнем мочевой кислоты менее 350 мкмоль/л [55].
У пациентов с уже установленным диагнозом ХСН содержание мочевой кислоты в крови соответствовало тяжести заболевания. В разных исследованиях повышенные концентрации мочевой кислоты коррелировали с эхокардиографическими параметрами как систолической, так и диастолической дисфункции, классом сердечной недостаточности по NYHA, толерантностью к физической нагрузке, нарушениями гемодинамики (в том числе с повышением давления в правом предсердии и в легочной артерии, давлением заклинивания, более высоким индексом легочного сосудистого сопротивления и более низким сердечным индексом), а также с кахексией и эндотелиальной дисфункцией [58–59].
Как уже упоминалось, концентрация мочевой кислоты в крови коррелировала как с общей, так и сердечно-сосудистой смертностью у больных ХСН [56]. В связи с выраженной взаимосвязью между уровнем мочевой кислоты в сыворотке крови и тяжестью ХСН, а также прогнозом этого осложнения, мочевая кислота была включена в несколько прогностических моделей у пациентов с ХСН [60].
Принято считать, что повышению уровня мочевой кислоты в крови при ХСН способствует множество факторов [60]. Среди них особое значение имеют повышенная продукция мочевой кислоты вследствие индуцированной ишемией возросшей активности фермента ксантиноксидазы при сердечной недостаточности, повышенная деградация пурина в условиях ХСН в связи с гипоксией, активация катаболических путей, инсулинорезистентность, стимуляция гибели клеток (прежде всего развитие саркопении и кахексии в терминальных стадиях болезни), а также нарушение почечной экскреции [12, 59, 60].
Наряду с этим существуют и другие точки зрения, согласно которым мочевая кислота не становится причиной сердечно-сосудистой дисфункции и ухудшения прогноза, а служит просто маркером повышенной активности ксантиноксидазы и чрезмерного числа активных форм кислорода [61, 62]. Кроме того, тесная взаимосвязь между активностью мочевой кислоты и ксантиоксидазы, АГ и фибрилляцией предсердий (важными факторами риска развития ХСН) не позволяют пока еще определить истинную роль мочевой кислоты в патогенезе сердечной недостаточности [61, 63].
Терапия ингибиторами ксантиноксидазы (в основном аллопуринолом), направленная на снижение концентрации мочевой кислоты, широко используется для улучшения прогноза ХСН. В ряде исследований показано, что ингибирование ксантиноксидазы оказывает благотворное влияние на ряд суррогатных маркеров сердечной недостаточности, включая механическую эффективность миокарда, энергетический баланс и повышенную концентрацию высокоэнергетических фосфатов, фракцию выброса левого желудочка, ремоделирование сердца, параметры диастолической дисфункции, периферический кровоток, эндотелиальную дисфункцию и снижение уровня натрийуретического пептида [64–66].
Были проведены и клинические исследования по снижению уровня мочевой кислоты у пациентов с ХСН. Однако результаты этих исследований были в основном неудовлетворительными. Так, в исследовании OPT-CHF (405 пациентов с систолической сердечной недостаточностью) ингибитор ксантиноксидазы оксипуринол эффективно снижал уровень мочевой кислоты, но значимо не влиял на улучшение клинического состояния, заболеваемость, смертность и качество жизни больных ХСН [67].
При исследовании 253 больных гиперурикемией и ХСН со сниженной фракцией выброса аллопуринол значительно уменьшал уровень мочевой кислоты, но никак не влиял на клинический статус больных ХСН или фракцию выброса левого желудочка по сравнению с плацебо [68].
МОЧЕВАЯ КИСЛОТА И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Эпидемиологические, клинические и экспериментальные данные свидетельствуют о связи между повышенным уровнем мочевой кислоты и риском развития АГ. При анализе 16 исследований отмечено, что гиперурикемия повышает риск развития АГ в течение 5 лет независимо от других факторов риска [69]. Результаты последующих исследований также свидетельствуют о повышенном риске АГ, вызванном увеличением концентрации мочевой кислоты [70, 71].
Хотя связь между гиперурикемией и АГ взаимна, согласно некоторым наблюдениям, гиперурикемия предшествует развитию АГ, а не является следствием гипертензии как таковой. Гиперурикемия чаще встречается при первичной АГ, чем при вторичной; у 25–60% пациентов с гипертензией, не получающих антигипертензивных препаратов, наблюдается гиперурикемия [69]. При исследовании подростков 12–17 лет в США обнаружено, что высокие уровни мочевой кислоты связаны с последующим развитием АГ независимо от других факторов риска [72].
Снижение уровня мочевой кислоты с помощью ингибиторов ксантиноксидазы способствует уменьшению артериального давления (АД) у пациентов с АГ. В рандомизированном, плацебо-контролируемом исследовании аллопуринол значительно снижал АД и приводил к его нормализации у большинства пациентов с АГ [73]. Наряду с этим показано значительное снижение АД с помощью уратснижающей терапии (аллопуринола и урикозурического агента пробенецида). Препараты, уменьшающие уровень мочевой кислоты, значительно понижали и системное сосудистое сопротивление [74]. Метаанализ, включавший 10 исследований, показал, что аллопуринол значимо снижал как систолическое, так и диастолическое АД у больных АГ по сравнению с контрольной группой [75].
Несмотря на представленные доказательства, указывающие на преимущества снижения мочевой кислоты у пациентов с АГ, в Кокрейновском обзоре сказано, что нет достаточных доказательств для использования аллопуринола или других препаратов, снижающих уровень мочевой кислоты, в качестве стартовой терапии АГ [76].
В соответствии с недавно опубликованным Российским консенсусом по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском этой категории больных рекомендовано назначение аллопуринола в стартовой дозе 100 мг/ сут, с возможным ее последующим титрованием до 300–600 мг/сут (до достижения целевого уровня мочевой кислоты менее 300 мг/сут) [77].
Изменение уровня мочевой кислоты в сыворотке крови можно рассматривать как предсказание ответа на антигипертензивную терапию при АГ. В исследовании систолической АГ у пожилых людей с участием более 4 тыс. пациентов в возрасте 60 лет и старше изменение сывороточного уровня мочевой кислоты меньше чем 0,06 ммоль/л ассоциировалось с 42%-ным снижением частоты эпизодов коронарной недостаточности по сравнению с больными, у которых концентрация мочевой кислоты в сыворотке крови повысилась на 0,06 ммоль/л и более [78]. Исследование LIFE показало, что лозартан превосходит атенолол в уменьшении риска сердечно-сосудистых событий и смертности у пациентов с АГ; этот эффект частично связан с урикозурическим действием лозартана, ингибирующего транспортер мочевой кислоты URAT1 [79].
В последних рекомендациях Европейского общества кардиологов и Российских рекомендациях по диагностике и лечению АГ гиперурикемию рассматривают как независимый фактор риска ССЗ. В соответствии с рекомендациями всем больным АГ рекомендуют определять концентрацию мочевой кислоты в крови, так как гиперурикемия часто наблюдается при АГ и выступает в качестве самостоятельного фактора риска поражения почек [80–81].
МОЧЕВАЯ КИСЛОТА И ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
Результаты ряда исследований указывают на наличие связи между повышенным уровнем мочевой кислоты и риском фибрилляции предсердий [63, 82–91]. Так, в исследовании по изучению атеросклероза ARIC повышение уровня мочевой кислоты сопровождалось более высоким риском фибрилляции предсердий (ФП), причем этот риск был выше у женщин [92]. Сообщалось также о более высоком риске ФП у больных СД с повышенным уровнем мочевой кислоты [89].
В крупном японском исследовании с участием почти 286 тыс. человек отмечена выраженная и независимая взаимосвязь между уровнем мочевой кислоты и риском ФП; у мужчин увеличение риска составило 1,2, у женщин – 1,4 [90]. Результаты метаанализа, выполненного Tamariz L. et al., подтвердили взаимосвязь между повышенным уровнем мочевой кислоты и риском ФП [63].
В одномоментных исследованиях средний уровень мочевой кислоты у больных ФП составлял 6,2 мг/дл, тогда как у пациентов, не страдавших этой аритмией, – 5,1 мг/дл. В когортных исследованиях относительный риск развития ФП составлял 1,67 для больных с высоким уровнем мочевой кислоты в сыворотке крови по сравнению с пациентами с низкой концентрацией мочевой кислоты [63].
Точные механизмы взаимосвязи между мочевой кислотой и риском ФП остаются не вполне ясными. Тем не менее был выделен ряд факторов, предположительно повышающих риск развития этого заболевания. Во-первых, это связь гиперурикемии с классическими факторами риска ССЗ (в частности, с АГ). Определенную роль могут играть также индуцированный мочевой кислотой окислительный стресс, эндотелиальная дисфункция и воспаление [86]. Предложена также электрофизиологическая гипотеза, предполагающая, что мочевая кислота способна увеличивать восприимчивость клеток предсердия к ФП. Согласно этой гипотезе мочевая кислота поступает в клетки предсердия через специальные транспортеры мочевой кислоты и индуцирует экспрессию белка Kv1.5, что приводит к увеличению активности ионов Kv1.5 и сокращает продолжительность потенциала действия предсердных кардиомиоцитов, предрасполагающих к фибрилляции ФП [86].
Как известно, мочевая кислота играет важную роль в окислительном стрессе, что способствует внутриклеточной перегрузке кальцием с уменьшением плотности натриевых каналов и усугублением повреждения клеток. Эти патологические процессы способствуют электрическому ремоделированию левого предсердия [93]. Кроме того, мочевая кислота обладает провоспалительными эффектами, способствуя высвобождению провоспалительных цитокинов (например, интерлейкина-6, интерлейкина-8, фактора некроза опухоли-α и белка хемоаттрактанта моноцитов), а также локальной активации системы ренин-ангиотензин-альдостерон [6]. Хроническое воспаление приводит к активации и повреждению эндотелия, выработке тканевого фактора моноцитами, увеличению активации тромбоцитов и повышению уровня фибриногена [94]. Воспаление также усиливает активность ренин-ангиотензин-альдостероновой системы и способствует повышению уровней ангиотензина II, который активирует янус-киназы и сигнальные преобразователи и активаторы транскрипции (STAT). Путь ангиотензин II/STAT3 служит важным сигнальным механизмом, способствующим возникновению ФП [84]. Как STAT, так и ренин-ангиотензин-альдостероновая система играют важную роль в структурном ремоделировании левого предсердия, способствуя возникновению и прогрессированию ФП [83].
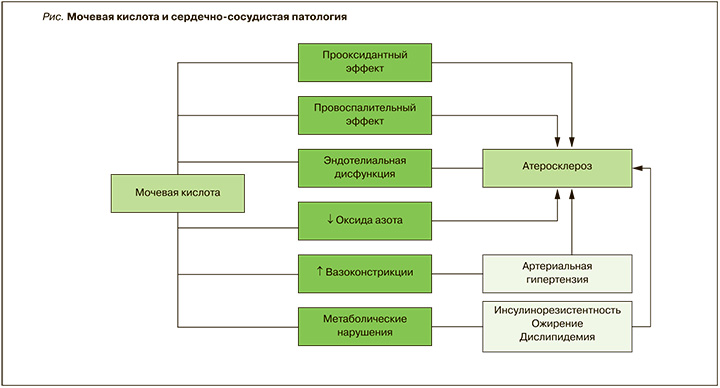
Таким образом, результаты многочисленных исследований, проведенных главным образом в последнее десятилетие, свидетельствуют о значительной распространенности гиперурикемии у больных с различными ССЗ и важной роли мочевой кислоты в развитии и прогрессировании этих патологических состояний (рис.).



