Диагностика
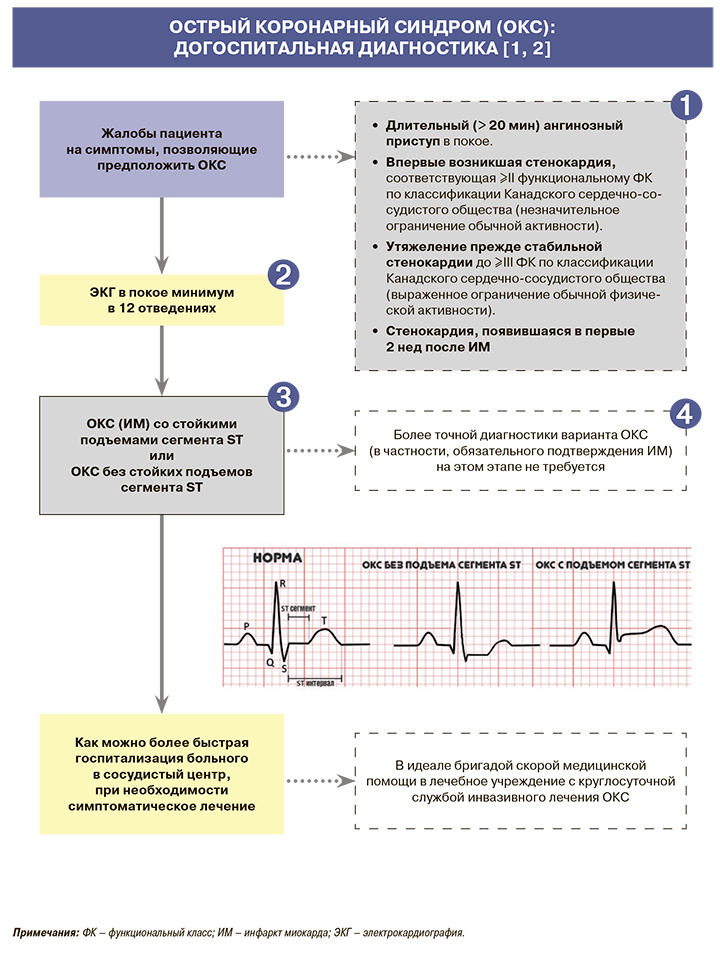
1.
• Для ишемии миокарда характерны чувство сжатия, давления или тяжести за грудиной, которые иногда описываются пациентом как дискомфорт. Возможны иррадиация в левую руку, левое плечо, горло, нижнюю челюсть, эпигастрий, а также нетипичные клинические проявления, такие как потливость, тошнота, боль в животе, одышка, потеря сознания, которые в некоторых случаях являются единственными или доминирующими [1, 2].
• При остром коронарном синдроме (ОКС) симптомы, как правило, сходны по характеру с возникающими при приступе стенокардии, но отличаются по силе и продолжительности; в ряде случаев симптомы полностью не купируются приемом нитроглицерина, а иногда и повторными инъекциями наркотических анальгетиков. Интенсивность болевого синдрома может быть различной – от незначительной до невыносимой; симптомы могут носить волнообразный характер и продолжаться от 20 мин до нескольких часов. При нетипичных клинических проявлениях в зависимости от доминирующей симптоматики у пациентов с развивающимся инфарктом миокарда (ИМ) выделяют астматический, абдоминальный, аритмический, цереброваскулярный варианты, а также малосимптомную (безболевую) форму [1, 2].
• В клинической картине ОКС (ИМ) со стойкими подъемами сегмента ST (ИМпST) могут присутствовать, а иногда и преобладать симптомы его основных осложнений – острой сердечной недостаточности (отек легких, шок), выраженной брадикардии или тахикардии [1, 2].
• Одним из возможных проявлений ИМ, иногда единственным доступным для врачебной оценки, может быть набор симптомов, которые характерны для остановки кровообращения, вызванной желудочковой тахикардией, фибрилляцией желудочков, асистолией или электромеханической диссоциацией. У больных со спонтанно разрешившейся остановкой кровообращения ведущим симптомом может выступать угнетений сознания разной степени [1, 2].
2.
У всех пациентов с подозрением на ОКС рекомендуется в течение 10 мин на месте первого контакта с медицинским работником (как правило, догоспитально) зарегистрировать и интерпретировать электрокардиограмму (ЭКГ) в покое как в минимум в 12 стандартных отведениях и безотлагательно интерпретировать ее квалифицированным врачом. При невозможности квалифицированно интерпретировать ЭКГ на месте ее регистрации рекомендуется наладить систему ее дистанционной передачи и консультирования [1, 2].
3.
• ОКС со стойкими подъемами сегмента ST (ОКСпST) констатируют в тех случаях, когда в дополнение к клинике выявляются стойкие (> 20 мин) подъемы сегмента ST на ЭКГ. Поскольку при ОКСпST обычно в итоге диагностируют ишемический некроз (инфаркт) миокарда, эту форму ОКС часто с самого начала называют ИМпST [1, 2].
• Остальные случаи (включая отсутствие новых изменений ЭКГ) обозначают как ОКС без стойких подъемов сегмента ST (ОКСбпST). Для ОКСбпST характерно наличие признаков ишемии миокарда, о которой свидетельствуют преходящие (<20 мин) подъемы сегмента ST как минимум в двух смежных отведениях ЭКГ, а также преходящие или стойкие депрессии ST (особенно горизонтальные или косонисходящие) как минимум на 0,05 мВ. Выраженные (≥0,2 мВ) симметричные отрицательные зубцы T в прекордиальных отведениях также предполагают наличие острой ишемии миокарда. К неспецифическим признакам относят смещение сегмента ST <0,05 мВ и инверсию зубца T <0,1 мВ [1, 2].
• Отсутствие ишемических изменений на ЭКГ не должно исключать диагноз ОКСбпST. Важный диагностический прием – сравнение с ЭКГ, зарегистрированной до наступления настоящего приступа (если таковая доступна) [1, 2].
• Если изменения на ЭКГ в 12 стандартных отведениях неинформативны, а по клиническим данным предполагается наличие ишемии миокарда, рекомендуется использовать дополнительные отведения, такие как V7–V9, V3R–V4R. При неинформативной ЭКГ у пациентов с сохраняющимся подозрением на ОКС, продолжающимися или возобновляющимися симптомами, для своевременного выявления ишемических изменений на ЭКГ рекомендуется регистрировать повторно (например, с интервалами в 15–30 мин в течение первого часа) или начать дистанционное мониторирование ЭКГ с оценкой смещений сегмента ST в 12 отведениях, если это технически возможно [1, 2].
• Использование дополнительных отведений ЭКГ V7–V9 рекомендуется у больных с подозрением на ИМ нижнебазальной локализации, V3R и V4R – при подозрении на ИМ правого желудочка. Для отведений V7–V9 диагностичными являются подъемы ST 30,05 мВ (30,1 мВ у мужчин моложе 40 лет). В сложных случаях возможно регистрация ЭКГ и в других отведениях (на 2 ребра выше и т.д.). Депрессия сегмента ST >0,1 mV в ≥8 отведениях при подъеме сегмента ST в отведении aVR и/или V1 предполагает поражение ствола левой коронарной артерии (КА) или многососудистое поражение бассейна левой КА [1, 2].
4.
• ОКС – предварительный диагноз, необходимый для быстрого выбора подходов к маршрутизации больного. Выявление ИМ обычно требует дополнительного времени, необходимого для оценки как минимум динамики ЭКГ и уровня биомаркеров некроза миокарда в крови (предпочтительно сердечного тропонина), которые проводятся после госпитализации. Прочие исследования (коронарная ангиография и др.), в том числе для дифференциальной диагностики, также выполняются в стационаре [1, 2].
Лечение

1.
• Пациенты с ОКС нуждаются в длительном приеме оральных антикоагулянтов (варфарин или ривароксабан/апиксабан/дабигатрана этексилат) только при наличии следующих сопутствующих заболеваний/состояний[1, 2]:
– фибрилляция предсердий (ФП) в сочетании с умеренным/тяжелым митральным стенозом;
– механические протезы клапанов сердца;
– неклапанная ФП с суммой баллов по шкале CHA2DS2-VASc ≥2 у мужчин или ≥3 у женщин1;
– тромбоз глубоких вен/тромбоэмболия легочной артерии, требующие лечения антикоагулянтами;
– тромб в левом желудочке.
• При необходимости длительного приема оральных антикоагулянтов (указанные ситуации) пациентам с ОКСбпST, подвергнутым стентированию коронарной артерии, рекомендована тройная антитромбоцитарная терапия в виде сочетания орального антикоагулянта (ОАК) с ацетилсалициловой кислотой (АСК) и клопидогрелом длительностью от 1 до 3 мес с переходом на двойную терапию (ОАК + клопидогрел) вплоть до 12-го месяца и с последующей отменой антитромбоцитарных препаратов для снижения риска коронарных и тромбоэмболических осложнений [1]. У аналогичных пациентов с ИМпST, подвергнутых коронарному стентированию, продолжительность тройной антитромбоцитарной рекомендовано ограничить несколькими (1–7) днями, а после завершения двойной антитромбоцитарной терапии (ДАТТ) через 12 мес продолжить монотерапию ОАК в целевой дозе для профилактики тромбоэмболических осложнений (в случае с ФП) [2, 4–7].
2.
Всем пациентам с ОКСбпST и ИМпST без высокого риска кровотечений в добавление к АСК рекомендованы ингибиторы P2Y12-рецептора тромбоцитов (тикагрелор, прасугрел, клопидогрел) для снижения риска неблагоприятных исходов (уровень убедительности рекомендаций A, уровень достоверности доказательств 1) [1, 2, 8–10]. Такую терапию рекомендовано продолжать на протяжении 12 мес (уровень убедительности рекомендаций A, уровень достоверности доказательств 1) [1, 2, 8–11]. Преждевременное прекращение ДАТТ после ОКС способствует увеличению частоты коронарных осложнений [1, 2].
3.
Длительный (неопределенно долгий) прием АСК рекомендуется всем пациентам с ОКСбпST и ИМпST, не имеющим противопоказаний, вне зависимости от стратегии лечения, для снижения риска суммы случаев смерти и ИМ (уровень убедительности рекомендаций A, уровень достоверности доказательств 1) [1, 2, 12, 13]. У больных, в последнюю неделю регулярно не принимавших АСК, рекомендуется начальная (нагрузочная) доза 150–325 мг (таблетку разжевать и проглотить); постоянная поддерживающая этого антиагреганта составляет 75–100 мг внутрь 1 раз/сут [1, 2].
4.
Тикагрелор рекомендован в добавление к АСК для снижения угрозы неблагоприятных исходов (сумма случаев сердечно-сосудистой смерти, ИМ и инсульта, тромбоз стента для коронарных артерий) у пациентов с ОКСбпST, имеющих средний и высокий риск неблагоприятных исходов, вне зависимости от начальной стратегии лечения и предшествующего использования клопидогрела (уровень убедительности рекомендаций A, уровень достоверности доказательств 2), а также у пациентов с ИМпST, перенесших первичное чрескожное коронарное вмешательство (ЧКВ) [1, 2, 10, 14]. Нагрузочная доза тикагрелора составляет 180 мг, поддерживающая – 90 мг 2 раза/сут. Противопоказания к препарату включают внутричерепное кровоизлияние в анамнезе, продолжающееся кровотечение [1, 2].
5.
Прасугрел (нагрузочная доза 60 мг, ежедневная поддерживающая доза – 10 мг внутрь) рекомендуется в добавление к АСК с целью снижения риска неблагоприятных исходов при коронарном стентировании у пациентов с ОКСбпST и ИМпST, не получавших других ингибиторов P2Y12-рецептора тромбоцитов (уровень убедительности рекомендаций A, уровень достоверности доказательств 2) [1, 2, 9, 15]. Противопоказания к приему препарата – наличие в анамнезе внутричерепного кровоизлияния, ишемического инсульта/транзиторной ишемической атаки (ТИА), а также продолжающееся кровотечение и тяжелая печеночная недостаточность [1, 2].
6.
• Пациентам с ОКСбпST и ИМпST, которые не могут получать прасугрел или тикагрелор или нуждаются в ОАК, в добавление к АСК с целью снижения риска неблагоприятных исходов рекомендуется клопидогрел [1, 2, 8, 11]. Нагрузочная доза препарата 300 или 600 мг/сут, поддерживающая – 75 мг/сут [1, 2].
• Наряду с монопрепраратами в России зарегистрирован ряд фиксированных комбинаций АСК и клопидогрела (100 мг + 75 мг и 75 мг + 75 мг) [16].
7.
• У пациентов с ОКСбпST и ИМпST, не нуждающихся в длительном использовании ОАК, имеющих высокий риск ишемических и низкий риск геморрагических осложнений без инсульта или ТИА в анамнезе, после прекращения парентерального введения антикоагулянтов с целью снижения риска неблагоприятных исходов возможно добавление к сочетанию АСК и клопидогрела ОАК ривароксабана в дозе 2,5 мг 2 раза в сут сроком на 12 мес (в отдельных случаях вплоть до 24 мес) (уровень убедительности рекомендаций B, уровень достоверности доказательств 2) [1, 2, 17]. Однако данный подход не может использоваться у пациентов, нуждающихся в использовании более высоких доз ОАК (в частности, при наличии ФП) [1, 2].
• При высоком риске кровотечений рекомендуется рассмотреть целесообразность уменьшения длительности ДАТТ (сочетание АСК с ингибитором P2Y12-рецептора тромбоцитов) до 6 мес с целью обеспечить наилучший баланс эффективности и безопасности антитромботического лечения [1, 2].
8.
• Если прерывание ДАТТ абсолютно необходимо, следует иметь в виду, что альтернативного более безопасного варианта профилактики тромбоза стента для коронарных артерий не существует. Рекомендуемая минимальная длительность ДАТТ после установки стента без лекарственного покрытия составляет 1 мес, после установки современных типов стентов, выделяющих лекарственные средства, – 3 мес у пациентов с ОКСбпST и 3–6 мес с ИМпST [1, 2].
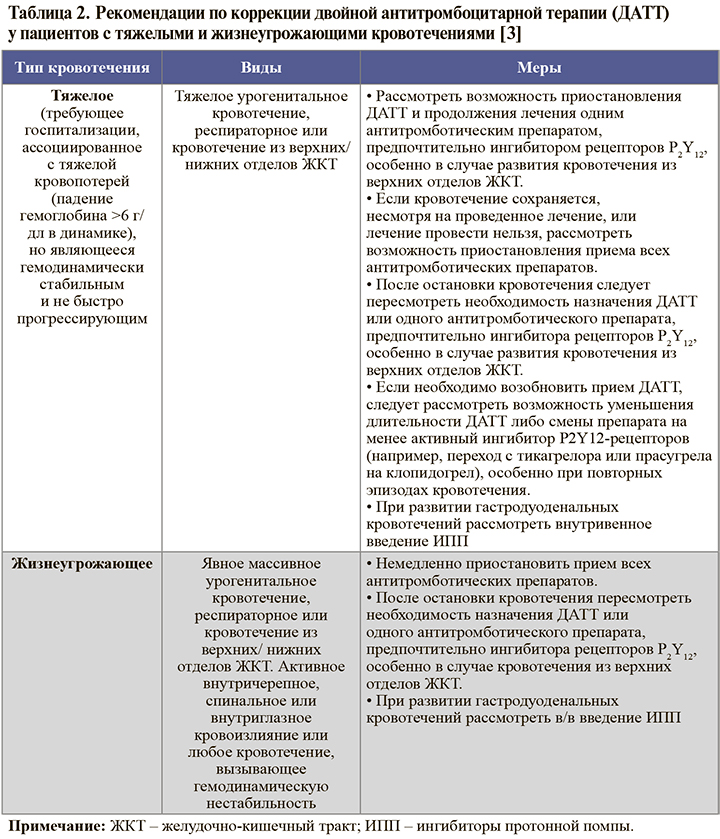
• Принципы коррекции ДАТТ при возникновении различных типов кровотечений в процессе лечения суммированы в таблицах 1 и 2. Наряду с этим в процессе контроля терапии следует осуществлять коррекцию режима применения ОАК (если их прием необходим), своевременную диагностику и коррекцию сопутствующей патологии, вероятно, ассоциированной с кровотечением (например, язвы желудка, геморроидальных кровотечений, опухоли), консультировать пациента на предмет важности соблюдения приверженности терапии, при тяжелых и жизнеугрожающих кровотечениях оценить необходимость переливания эритроцитарной/тромбоцитарной массы, экстренного хирургическое вмешательства или эндоскопической остановки кровотечения в случае, если это будет сочтено возможным [3].
• Как следует из таблиц 1 и 2, для снижения риска кровотечений из верхних отделов ЖКТ во время ДАТТ рекомендуется использовать ингибиторы протонового насоса (уровни убедительности рекомендаций: для ОКСбпST – A, для ИМпST – С; уровни достоверности доказательств: для ОКСбпST – 2, для ИМпST – 3) [1, 2].
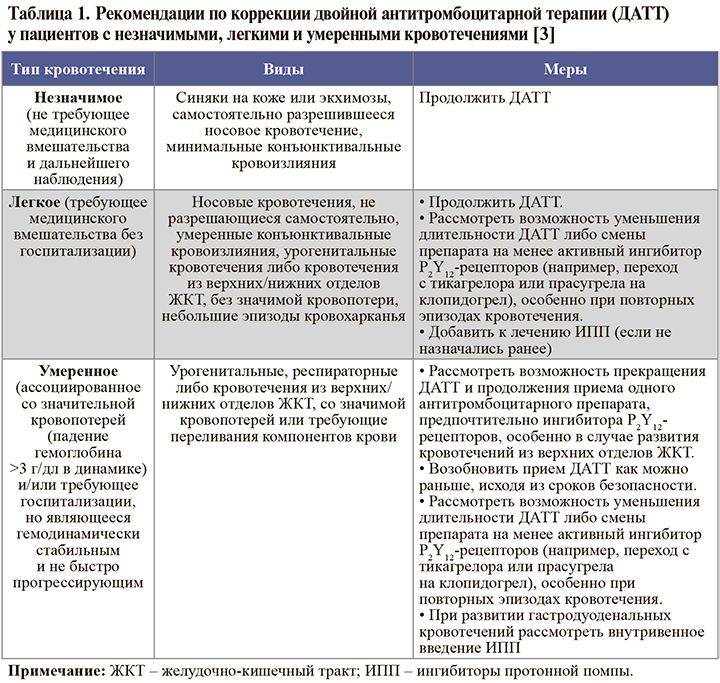
Прием этой группы средств возможен как у всех пациентов, получающих ДАТТ, так и более избирательно, у пациентов с повышенным риском желудочно-кишечных кровотечений (язвенная болезнь или желудочно-кишечное кровотечение в анамнезе, хроническое использование НПВП или кортикостероидов, как минимум 2 из следующих признаков – возраст ≥65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование H. Pylory, хроническое употребление алкоголя). При применении клопидогрела следует учитывать возможность ослабления его антитромбоцитарного эффекта при сочетании с омепразолом или эзомепразолом (но не с пантопразолом или рабепразолом). В то же время нет доказательств, что эти лекарственные взаимодействия оказывают неблагоприятное влияние на клинические результаты лечения [1, 2].

• Минимальный перерыв и временные рамки возобновления ДАТТ у пациентов, нуждающихся в плановых некардиальных хирургических вмешательствах с высоким/умеренным риском кровотечений, приведен на рисунке. При хирургических вмешательствах с низким риском кровотечения досрочно прерывать ДАТТ не следует [1, 2].
• При необходимости экстренной хирургической операции или серьезном кровотечении лечение ингибиторами P2Y12-рецептора тромбоцитов следует прекратить и возобновить при первой возможности после устранения причин кровотечения. В подобных ситуациях оперативное лечение следует проводить в многопрофильных стационарах с возможностью проведения ЧКВ в случаях возникновения периоперационного ИМ [1, 2].
• У пациентов с ОКСбпST и ИМпST, имеющих высокий риск коронарных осложнений и низкий риск кровотечений, рекомендуется рассмотреть возможность продления ДАТТ (сочетание АСК с ингибитором P2Y12-рецептора тромбоцитов) на более длительный срок (>12 мес) для дополнительного снижения риска неблагоприятных исходов (уровень убедительности рекомендаций для ОКСбпST и ИМпST – B, уровень достоверности – 1) [1, 2]. При этом соотношение пользы и риска продления двойной антитромбоцитарной терапии должно регулярно пересматриваться [1, 2, 19, 20]. К пациентам с высоким риском коронарных осложнений относят лиц в возрасте ≥50 лет в сочетании как минимум с одним из следующих факторов риска: возраст ≥65 лет, наличие требующего медикаментозного лечения сахарного диабета, ≥2 перенесенных ИМ, многососудистого коронарного атеросклероза, ХБП с рСКФ <60 мл/мин/1,73 м2 [1, 2]. В свою очередь, факторами высокого риска кровотечений являются внутричерепное кровотечение, ишемический инсульт или другая внутричерепная патология в анамнезе; недавнее желудочно-кишечное кровотечение или анемия из-за потери крови через желудочно-кишечный тракт (ЖКТ), другая патология ЖКТ с повышенным риском кровотечений; печеночная недостаточность; геморрагический диатез или коагулопатия; старческий возраст или старческая хрупкость; хроническая болезнь почек (ХБП), требующая диализа или при расчетной скорости клубочковой фильтрации (рСКФ) <15 мл/мин/1,73 м2 [1, 2].
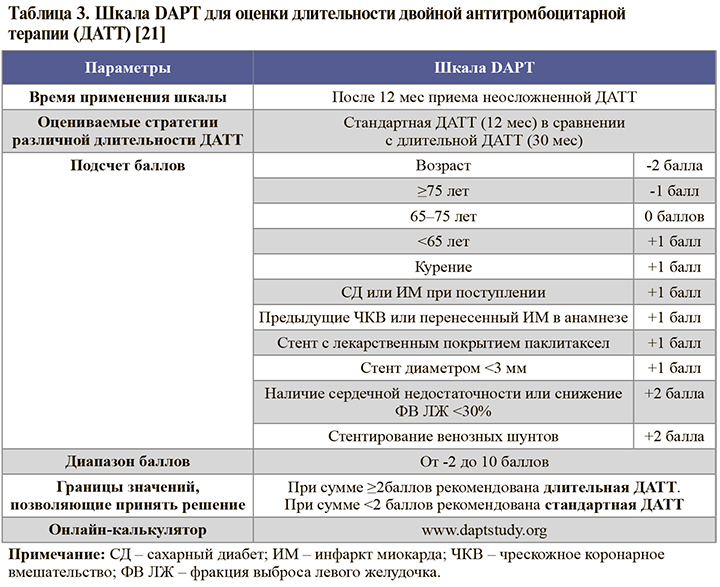
• Для определения длительности ДАТТ после 12 мес терапии можно использовать валидированную шкалу DAPT (табл. 3).
• Через 12 мес у больных, перенесших ОКСбпST и ИМпST, с высоким риском коронарных осложнений, не имевших кровотечений в первый год ДАТТ, рекомендуется рассмотреть возможность ее продления в виде сочетания АСК с уменьшенной дозой тикагрелора (60 мг 2 раза/сут) на дополнительные 36 мес с целью дополнительного снижения риска неблагоприятных исходов [1, 22, 23]. Имеются указания, что у больных ИМпST высокого риска, переживших первый год лечения без осложнений, продление ДАТТ (АСК + тикагрелор 60 мг 2 раза/сут) более 1 года существенно снижает количество ишемических событий [2].
• Через 12 мес после ОКСбпST у пациентов с высоким риском тромботических осложнений атеросклероза и невысоким риском кровотечений рекомендуется рассмотреть возможность перехода на длительное использование сочетания АСК с ривароксабаном в дозе 2,5 мг 2 раза в сутки внутрь с целью дополнительного снижения риска неблагоприятных исходов [1, 24].


