Диагностика
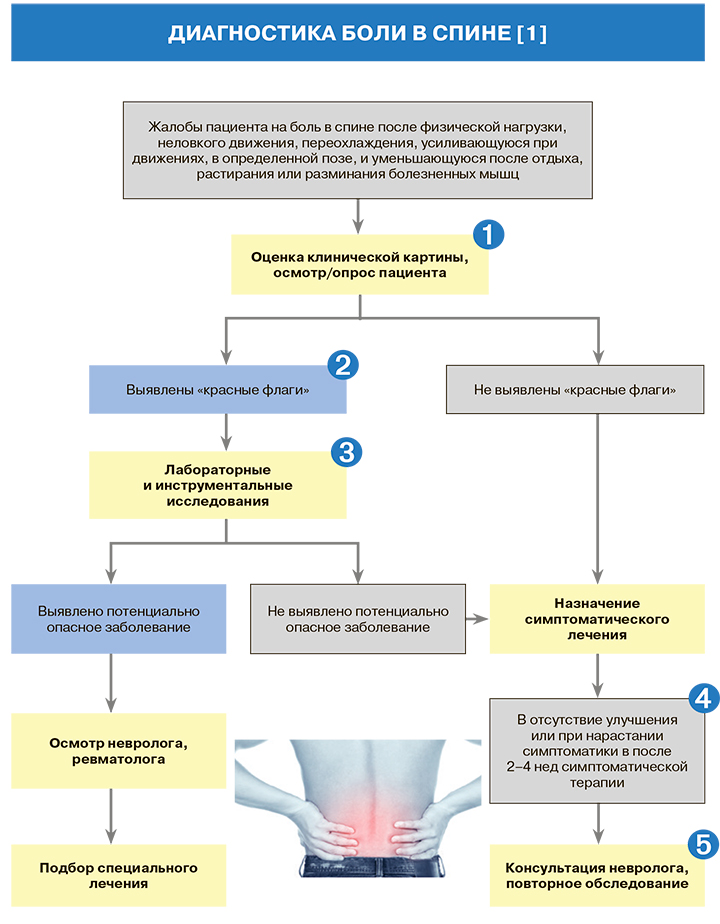
1.
• С практической точки зрения целесообразно выделять три основные вида болей в спине:
– неспецифическую боль (частота встречаемости 85–90%) – боль, у которой не удалось выявить серьезную причинную патологию (заболевание);
– специфическую боль (4–7%) – боль, вызванную опухолями, в том числе метастатическими, спондилоартритом, воспалением, переломами позвонков и заболеваниями внутренних органов;
– боль, вызванную компрессионной радикулопатией, стенозом поясничного канала (7%) [1].
• К факторам риска развития неспецифической боли в спине, которые могут быть установлены в процессе опроса пациента, относятся тяжелый физический труд, частые сгибания и наклоны туловища, подъем тяжестей, сидячий образ жизни, а также вибрационные воздействия. В группе риска находятся лица, чей труд связан с неадекватными для позвоночника нагрузками, а также люди, которые вынуждены длительно находиться в статическом напряжении, сидячем положении (профессиональные водители, офисные работники) [1].
• Чаще всего неспецифическая боль локализуется в нижней части спины. У большинства пациентов она проходит в продолжение нескольких дней или недель, однако в 2–10% случаев принимает хроническое течение [1].
• О вовлечении в патологический процесс корешков можно говорить при выявлении чувствительных, рефлекторных или двигательных нарушений, простреливающих болей, иррадиирующих в нижние конечности [1].
• Стандартное терапевтическое обследование пациента с жалобой на боль в спине обязательно включает дифференциальную диагностику заболеваний и выявление лихорадки, похудания, изменения формы суставов, цвета кожных покровов, лим фаденопатии, гепатолиенального синдрома и др. [1].
• Для оценки интенсивности и динамики болевого синдрома используется 100-балльная визуально-аналоговая шкала (ВАШ; 100 баллов – нестерпимая боль; 0 баллов – отсутствие боли) [1].
2.
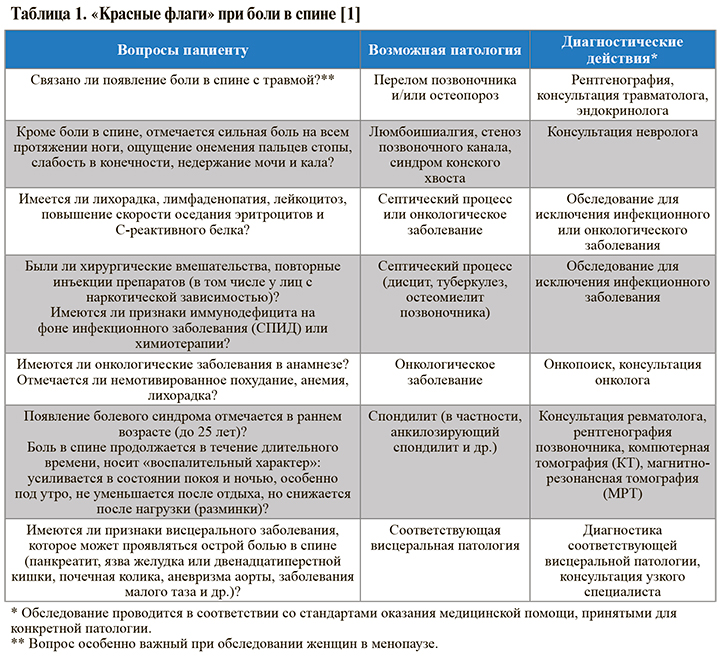
Основные вопросы, которые нужно задать при опросе и осмотре пациента с болью в спине для исключения угрожающей жизни патологии, требующей дополнительного обследования и консультации узкого специалиста («красные флаги»), приведены в таблице 1.
3.
• Минимальный лабораторный диагностический набор включает общий анализ крови и мочи, оценку скорости клубочковой фильтрации (СКФ), концентрации глюкозы, при возможности высокоточного С-реактивного белка [1].
• Минимальный инструментальный набор состоит из измерения артериального давления, электрокардиографии (ЭКГ), рентгеновского исследования органов грудной клетки и ультразвукового исследования (УЗИ) органов брюшной полости и забрюшинного пространства [1].
• Дополнительные инструментальные методы, такие как рентгенография позвоночника, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), сцинтиграфия, денситометрия, могут назначаться терапевтом только при наличии «красных флагов» [1].
4.
Критерием неэффективности симптоматической терапии является отсутствие уменьшения интенсивности боли менее чем на 20% от исходного уровня при использовании адекватных доз лекарственных средств [1].
5.
В компетенции невролога и ревматолога при выявлении специфической боли в спине проведение специальных исследований; привлечение таких узких специалистов, как нейрохирург, кинезитерапевт, психолог, осуществляет невролог [1].
Лечение
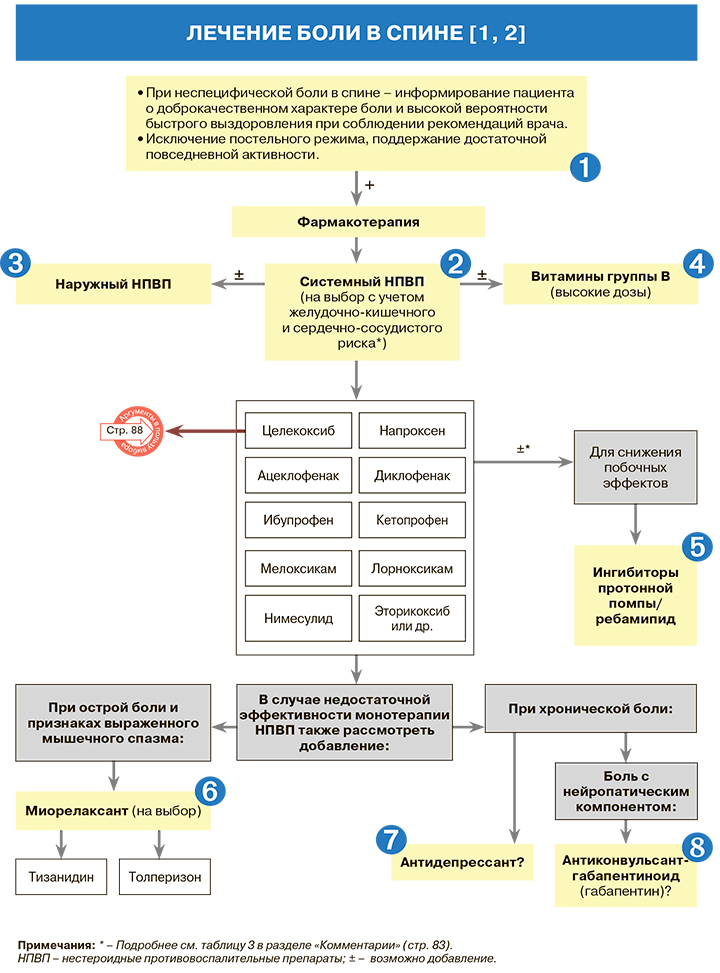
1.
• В тех случаях, когда пациенты из-за интенсивной боли в спине вынуждены лежать, продолжительность постельного режима не должна превышать 2 дней [1].
• Нет оснований рекомендовать пациентам с болью в спине спать на жесткой поверхности. Следует избегать как чрезмерной двигательной и физической активности, так и длительных статических нагрузок [1].
2.
• Системные формы нестероидных противовоспалительных препаратов (НПВП) назначаются сразу же после постановки диагноза неспецифической боли в спине – перорально в средней или максимальной терапевтической дозе [1]. НПВП служат основным фармакологическим средством для купирования острой неспецифической боли в спине [1–4]. По данным метаанализа 65 рандомизированных клинических исследований (РКИ; n=11237), НПВП при этой патологии достоверно эффективнее плацебо по таким показателям, как снижение интенсивности боли, время полного прекращения боли, восстановление функциональной активности и потребность в дополнительных анальгетиках [2, 5].
• Коксибы (целекоксиб, эторикоксиб) обладают селективным действием на циклооксигеназу-2 (ЦОГ-2), регулирующую синтез «болевых» простагландинов в очаге воспаления. Большинство традиционных НПВП в терапевтических дозах блокируют не только ЦОГ2, но и ЦОГ-1, активность которой играет большую роль в поддержании ряда важных функций организма, в частности, устойчивости слизистой оболочки желудочно-кишечного тракта (ЖКТ) к повреждающему действию внешних агрессивных факторов. При этом ряд российских и зарубежных экспертов выделяют среди традиционных НПВП препараты с умеренной селективностью в отношении ЦОГ2 – мелоксикам, нимесулид, этодолак. Остальные представители этой лекарственной группы относятся к неселективным НПВП [2].
• Кроме указанных в схеме традиционных НПВП, в России зарегистрированы следующие системные препараты этой подгруппы, которые могут назначаться для купирования боли в спине: амтолметил гуацин, декскетопрофен, индометацин, кеторолак, пироксикам, теноксикам, фенилбутазон, этодолак. Среди них декскетопрофен и кеторолак используются только короткими курсами – не более 5 дней [6].
• При острой боли в спине эффективность НПВП считается высокой, при хронической – умеренной [2]. В последнем случае применение НПВП может быть признано целесообразным в рамках комплексной терапии [2, 4].
• Эффективность различных НПВП при использовании в средних и высоких терапевтических дозах длительными курсами считается эквивалентной [2]. При этом НПВП более эффективны для купирования боли, чем парацетамол [2, 7].
• При болезнях костно-мышечной системы НПВП не уступают и даже превосходят «мягкие» опиоидные препараты, такие как трамадол и кодеин [2, 8–11]. Примером, доказывающим этот факт именно при дорсопатии, могут служить результаты двух 6-недельных РКИ, в которых сравнивалась эффективность селективного ингибитора циклоксигеназы-2 (ЦОГ2) целекоксиба 400 мг/сут (200 мг 2 раза/сут) и трамадола 200 мг/сут (50 мг 4 раза/сут) у пациентов с хронической неспецифической болью в спине (табл. 2).

• Обезболивающий и противовоспалительный потенциал НПВП в значительной степени определяется дозой препарата. Эта зависимость не всегда линейна, тем не менее применение более высоких доз может обеспечить более выраженный эффект. В качестве иллюстрации можно привести метаанализ 10 РКИ (n=1785), в которых оценивалось действие целекоксиба в дозах 200 и 400 мг при однократном приеме для купирования острой боли. Индекс NNT (число больных, которых надо пролечить для получения одного эпизода улучшения >50% от исходного уровня) составил для этих доз 4,2 и 2,6; повторное обезболивание потребовалось пациентам через 6,6 и 8,4 ч соответственно [2, 12].
• Инъекционные НПВП могут использоваться в течение первых 2–5 дней терапии, согласно инструкции, при наличии выраженной боли или невозможности перорального приема [1]. Применение внутримышечных/внутривенных НПВП может иметь преимущество в скорости наступления обезболивающего эффекта в сравнении с пероральным приемом препаратов. В то же время нет однозначных данных о том, что инъекционные НПВП превосходят пероральные формы по силе анальгезирующего и противовоспалительного действия при проведении лечения более одного дня [2].
• Длительность курса НПВП определяется временем, необходимым для максимально полного купирования боли и восстановления функции опорно-двигательного аппарата [1].
• Критерий неэффективности терапии НПВП – отсутствие снижения интенсивности боли хотя бы на 20% от исходного уровня с помощью адекватных доз в течение 2–4 нед. Это служит основанием для назначения консультации невролога и пересмотра терапии [1].
• Не следует комбинировать два и более различных системных НПВП, а также использовать дозы, превышающие рекомендованные [1].
• Перед назначением системных НПВП всегда следует учитывать риск развития нежелательных явлений, прежде всего кардиоваскулярных и гастроинтестинальных (табл. 2).
• Наименьший риск развития желудочно-кишечных кровотечений, язв, диспепсии и железодефицитной анемии, в том числе у больных с факторами риска, отличает селективный ингибитор ЦОГ-2 целекоксиб (уровень доказательности 1a) [2]. Одним из подтверждений тому служит метаанализ 52 РКИ (n=51 048), в которых сравнивалась безопасность целекоксиба, неселективных НПВП и плацебо. Критерием оценки было суммарное негативное влияние препаратов на ЖКТ, включавшее частоту кровотечений и перфораций верхних отделов ЖКТ, тонкой и толстой кишки, развития клинически выраженных язв и анемии (снижение уровня гемоглобина более чем на 20 г/л), связанного с кишечной кровопотерей. Частота этих осложнений не различалась при использовании целекоксиба и плацебо и была более чем в 2 раза выше при приеме неселективных НПВП: 1,0; 0,9 и 2,3 эпизода на 100 пациенто-лет соответственно [2, 13].
• По данным многочисленных клинических и эпидемиологических исследований, выполненных до 2016 г., наименьший риск нежелательных явлений со стороны сердечно-сосудистой системы был определен для неселективного НПВП напроксена. Это подтверждает, в частности, метаанализ 31 РКИ (суммарно 116 429 больных), в которых изучали кардиоваскулярную безопасность неселективных и селективных НПВП в сравнении с плацебо. Критерием оценки служила частота эпизодов инфаркта миокарда, ишемического инсульта и смерти из-за кардиоваскулярных причин. Суммарный риск этих осложнений был наиболее низким для напроксена – отношение шансов 1,22 (95% доверительный интервал (ДИ) 0,78–1,93). Для других НПВП он составил: целекоксиб – 1,43 (95% ДИ 0,94–2,16), эторикоксиб – 1,55 (95% ДИ 0,74– 3,17), диклофенак – 1,6 (95% ДИ 0,85–2,99), ибупрофен – 2,26 (95% ДИ 1,11–4,89) [2, 14].
• В то же время в РКИ PRECISION (24 081 больной остеоартритом и ревматоидным артритом с высоким риском кардиоваскулярных осложнений) были получены статистически убедительные доказательства того, что при приеме целекоксиба в терапевтических дозах (100–200 мг/сут) в течение 20 мес сердечно-сосудистый риск не выше, чем при использовании напроксена (750–1000 мг/сут) и ибупрофена (1800– 2400 мг/сут). При этом целекоксиб вызывает достоверно меньшее число желудочнокишечных осложнений [15]. В связи с этим приоритетными НПВП для назначения пациентам с умеренным и высоким сердечно-сосудистым риском в настоящее время считаются и напроксен, и целекоксиб (см. табл. 3).
• Среди НПВП напроксен и целекоксиб в меньшей степени способствуют дестабилизации артериальной гипертензии и сердечной недостаточности (уровень доказательности 1a) [2].

• К противопоказаниям для назначения системных НПВП относятся [1, 2]:
– очень высокий риск кардиоваскулярных осложнений;
– язва или эрозии желудочно-кишечного тракта (по результатам эндоскопического исследования);
– хроническая болезнь почек при СКФ <30 мл/мин/1,73 м2;
– воспалительные заболевания кишки (язвенный колит, болезнь Крона);
– аллергия на НПВП; – беременность.
• Возможность назначения НПВП у лиц с очень высоким сердечно-сосудистым риском следует обсуждать лишь в тех случаях, когда предполагаемая польза от применения НПВП превышает вероятный вред, связанный с риском развития кардиоваскулярных осложнений со стороны. Решение вопроса о таком назначении лечащий врач принимает при обязательном согласовании с пациентом. НПВП у больных с очень высоким риском осложнений со стороны сердечно-сосудистых осложнений следует применять в минимальной эффективной дозе кратковременным курсом, достаточным для достижения требуемого клинического эффекта. На сегодня препаратом выбора в этой ситуации следует считать напроксен [2].
• При противопоказаниях к системным формам НПВП в качестве альтернативы ряд источников рассматривает кратковременное применение трамадола или его комбинации с парацетамолом [2, 16]. При этом следует учитывать риск привыкания, физической и психической зависимости при длительном приеме трамадола, что требует тщательного медицинского наблюдения за пациентом при назначении этого лекарственного средства, в частности периодического контроля (если необходимо с перерывами в приеме) для определения дальнейшей необходимости терапии и оптимизации дозы [17]. Другой возможный вариант лечения при противопоказаниях к системным НПВП – использование локальных форм этой группы препаратов [1, 2].
3.
• Эффективность локальных НПВП при анальгетической терапии различных болезней костно-мышечной системы доказана в серии масштабных РКИ, а также в метаанализе 34 РКИ (n=7688) [2, 18]. Следует учесть, что НПВП для наружного применения практически не вызывают класс-специфических осложнений со стороны ЖКТ, сердечно-сосудистой системы и почек; это определяет возможность использования таких препаратов у пациентов с серьезной коморбидной патологией [2].
• Локальные НПВП могут применяться и как альтернатива системным формам этой группы препаратов, и в качестве дополнения к ним [19].
• В России в формах для наружного применения доступны такие НПВП, как ацеклофенак, диклофенак, ибупрофен, индометацин, кетопрофен, кеторолак, мелоксикам, нимесулид, пироксикам и фенилбутазон [6].
4.
• Нейротропные витамины стимулируют процессы, улучшающие функционирование нервной системы и уменьшающие болевой синдром. В частности, тиамин/бенфотиамин (витамин В1) улучшает энергообеспечение нейронов, пиридоксин (витамин В6) контролирует синтез транспортных белков в осевых цилиндрах, цианокобаламин (витамин В12) активирует синтез липопротеинов, служащих структурными элементами миелиновых волокон. Комплекс витаминов В1, В6, В12 тормозит прохождение болевых импульсов не только на уровне заднего рога, но и в таламусе. Во многих исследованиях подтверждено потенцирующее действие витаминов группы B при болях в спине при применении НПВП [1].
• На фармрынке России представлена пара комбинированных пероральных препаратов, объединяющих в своем составе высокие дозы витаминов группы B и диклофенак [6].
5.
• Для предупреждения нежелательных реакций системных форм НПВП при умеренном/высоком ЖКТ-риске могут назначаться следующие ингибиторы протонной помпы: лансопразол, омепразол, пантопразол, рабепразол, эзомепразол и др. [1].
• Для длительной профилактики НПВП-гастропатии у больных с коморбидными заболеваниями, получающих различные фармакологические средства, целесообразно использовать ингибиторы протонной помпы с минимальным риском лекарственных взаимодействий, такие как пантопразол.
• Для профилактики развития НПВП-энтеропатии может быть использован гастроэнтеропротектор ребамипид [2].
6.
• Среди миорелаксантов в комплексном лечении боли в спине при наличии признаков выраженного мышечного спазма и неэффективности монотерапии НПВП могут использоваться [1]:
– тизанидин, обладающий центральным миорелаксирующим и анальгезирующим действием;
– толперизон, у которого механизм действия реализуется за счет подавления рефлекторной активности на уровне спинного мозга.
• Миорелаксанты назначаются короткими курсами – 7–14 дней.
7.
Антидепрессанты рассматриваются как один из возможных вариантов терапии хронической боли в спине во многих мировых клинических рекомендациях [20]. При этом следует помнить, что большинство антидепрессантов, зарегистрированных в России, не содержат в инструкциях соответствующего показания к применению. К исключениям относятся дулоксетин (одно из официальных показаний – «хроническая боль в нижней части спины») и отчасти амитриптилин (отдельные торговые наименований имеют в перечне показаний «хронический болевой синдром, включая нейропатическую боль») [6].
8.
Отдельные исследования продемонстрировали уменьшение степени боли и нарушений чувствительности у пациентов с нейропатическим компонентом боли в спине при добавлении к терапии антиконвульсантов-габапентиноидов (габапентин и др.) [21].


