Диагностика
1.
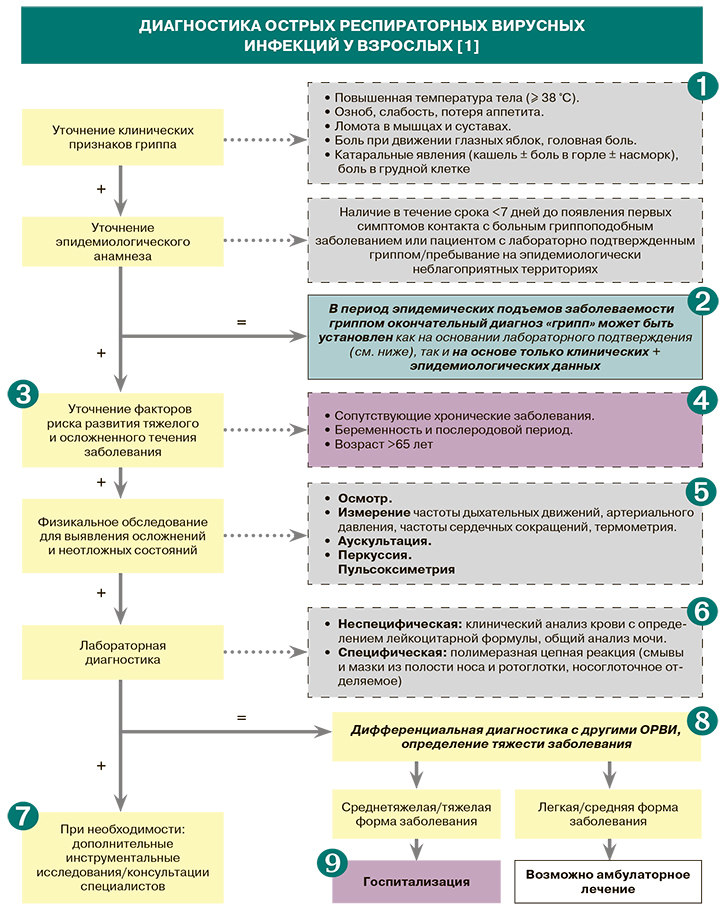
Для гриппа характерно быстрое повышение температуры тела >38 °C, а также гектическая или стабильно высокая лихорадка (>38,5 °C) более трех суток [2]. Особенности клинической картины, позволяющие дифференцировать грипп от других ОРВИ, представлены в таблице 1.
2.
Диагнозу «грипп», установленному на основании клинических и эпидемиологических данных без лабораторного подтверждения (в период эпидемических подъемов), соответствует код (рубрика) J.11.0 по МКБ-10 («Грипп, вирус не идентифицирован»).
3.
Оценка вероятности среднетяжелого/тяжелого осложненного течения гриппа необходима в связи с тем, что пациентам этих групп рекомендована госпитализация [1].
4.
• Среди хронических заболеваний к факторам риска неблагоприятного течения гриппа относятся:
– заболевания легких (бронхиальная астма, хроническая обструктивная болезнь легких и др.);
– заболевания сердечно-сосудистой системы (пороки сердца, гипертоническая болезнь, ишемическая болезнь сердца с признаками сердечной недостаточности и др.);
– нарушения обмена веществ (сахарный диабет, ожирение 2–3 степени и др.);
– хроническая болезнь почек;
– хронические заболевания печени;
– определенные неврологические состояния (включая нейромускульные, нейрокогнитивные нарушения, эпилепсию);
– гемоглобинопатии;
– первичные и вторичные иммунодефициты (ВИЧ-инфекция, прием иммуносупрессорных медикаментов и т.п.);
– злокачественные новообразования [1].
• Ряд российских экспертов к факторам риска неблагоприятного течения гриппа/ОРВИ относит также позднее обращение пациента за врачебной помощью (начиная с третьих суток заболевания) и отсутствие стартовой противовирусной терапии [2]. Рекомендуется обратить внимание на наличие вакцинопрофилактики гриппа у пациента [1].
5.
• При внешнем осмотре оценивают состояние кожных покровов и видимых слизистых оболочек: цвет (гиперемия, бледность, цианоз), влажность, отечность, инъекцию сосудов склер. Также обращают внимание на наличие и характер одышки, мокроты, дистанционных хрипов [1].
• При аускультации легких оценивают типы дыхания, побочные дыхательные шумы (сухие и влажные хрипы, крепитация, шум трения плевры) [1].
• Перкуссию применяют для выявления патологических изменений в легочной ткани и плевральных полостях (сравнительная перкуссия), а также для определения границ легких и сердца (топографическая перкуссия) [1].
• Различия физикальных признаков гриппа и других ОРВИ отражены в таблице 2.
6.
• Клинический анализ крови с определением лейкоцитарной формулы выполняется для диагностики гриппоподобных заболеваний, своевременного выявления осложнений и неотложных состояний и в комплексной оценке степени тяжести болезни:
– для неосложненного течения гриппа характерны нормоцитоз или лейкопения, нейтропения, эозинопения, относительный лимфо- и моноцитоз;
– при бактериальных осложнениях (пневмония, синусит и т.д.) в крови нарастает лейкоцитоз, палочкоядерный нейтрофилез, увеличивается скорость оседания эритроцитов (СОЭ);
– для интерстициального вирусного поражения легких характерны лейкопения, нейтрофилез с палочкоядерным сдвигом, анемия и тромбоцитопения.
• При неосложненном течении гриппа патологических изменений в анализе мочи нет. При выраженной лихорадке, интоксикационном синдроме наблюдаются увеличение плотности мочи, невыраженные лейкоцитурия, протеинурия, цилиндрурия, которые носят транзиторный характер, исчезая при нормализации температуры тела и купировании проявлений общей инфекционной интоксикации [1].
• Специфическое лабораторное обследование для идентификации возбудителя гриппа проводится в обязательном порядке в следующих ситуациях:
– госпитализация пациента по поводу ОРВИ верхних и нижних дыхательных путей (тяжелые и необычные формы заболевания);
– заболевание у пациента с высоким риском неблагоприятного исхода гриппа и ОРВИ (см. пункт 4);
– регистрация очагов ОРВИ со множественными случаями заболеваний в организованных коллективах взрослых с числом пострадавших ≥5 человек в один инкубационный период, при заболевании лиц из организаций с круглосуточным пребыванием [1].
• Полимеразно-цепная реакция (ПЦР) – наиболее эффективный метод лабораторной диагностики гриппа, который позволяет обнаружить нуклеиновые кислоты вируса в среднем до 7 дней, и максимум до 2 нед от начала заболевания (при условии сохранении признаков поражения верхних дыхательных путей). Оптимальный срок сбора клинического материала для ПЦР – в течение 3 сут после манифестации болезни или в первый день госпитализации (в более поздние сроки не исключена возможность суперинфекции при контакте с другими пациентами в стационаре), предпочтительно до начала противовирусной терапии. От одного пациента обязательно забираются мазки из полости носа и ротоглотки и носоглоточное отделяемое. От одного пациента отбирают две пробы: одну для проведения первичного исследования материала методами ПЦР, вторую – для проведения вирусологического исследования. Результаты ПЦР получают в течение 4–6 ч после представления образца. Все виды работ проводят с соблюдением противоэпидемического режима, в строгом соответствии с требованиями действующих нормативно-методических документов [1].
• В эпидемиологических целях для массового скрининга рекомендуется определение антигенов вируса гриппа – иммунохроматографические тесты [1].
• Для выявления бактериальных очагов, не определяемых клиническими методами, с определением возбудителей и их чувствительности к антибиотикам рекомендуется бактериологическое исследование мокроты и крови (обязательно перед началом антибактериальной терапии) [1].
7.
• При осложненном, среднетяжелом/тяжелом течении гриппа/ОРВИ рекомендуются следующие инструментальные исследования:
– для ранней диагностики респираторных нарушений – пульсоксиметрия (на всех этапах оказания медицинской помощи);
– при наличии аускультативных изменений в сердце для уточнения нарушения функции проведения и трофики ткани сердца – электрокардиография (ЭКГ). Выявляет характерные для токсикоза изменения: снижение и зазубренность зубца Р, снижение зубца Т в разных отведениях, относительное удлинение интервала Q–Т, удлинение интервала Р–Q. Изменения не стойкие и проходят в течение 1–2 нед;
– при явлениях бронхита (для исключения очаговой пневмонии) и наличии физикальных признаков поражения легочной ткани (верификация пневмонии);
– рентгенография органов грудной клетки. Может быть выявлено усиление легочного рисунка, уплотнение бронхов. Рентгенологические признаки пневмонии зависят от типа возбудителя пневмонии;
– пациентам с клиническими признаками риносинусита – передняя риноскопия и фарингоскопия;
– для оценки состояния аппарата дыхания и ранней диагностики рестриктивных/ обструктивных нарушений – спирометрия [1].
• Консультирование смежных специалистов рекомендовано при подозрениях на осложнения: невролога (явления менингоэнцефалита), пульмонолога (признаки пневмонии), гематолога (выраженные гематологические изменения и геморрагический синдром), кардиолога (присоединение симптомов миокардита, острой сердечно-сосудистой недостаточности), акушера-гинеколога (беременность) [1].
8.
• Дифференциальная диагностика гриппа с другими ОРВИ представлена в таблицах 1–2. Градация гриппа по степени тяжести приведена в таблице 3.

• Кроме пациентов со среднетяжелым, тяжелым и очень тяжелым гриппом, госпитализация рекомендована больным из групп риска неблагоприятного течения гриппа (см. пункт 4), а также пациентам, проживающим в общежитиях и в условиях неблагоприятных факторов жилой среды. При неосложненном гриппоподобном заболевании госпитализацию следует провести при любом ухудшении или отсутствии улучшения состояния в течение 72 ч [1].
Лечение

1.
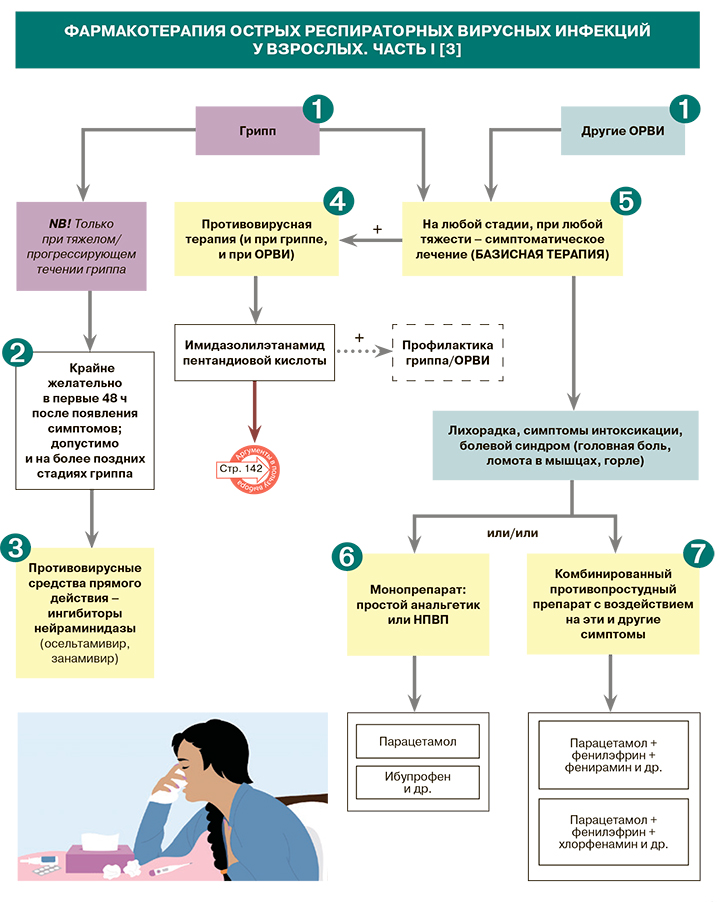
• Подходы к лечению респираторных инфекций в России и за рубежом отличаются. Так, Российские рекомендации включают следующие направления фармакотерапии:
– этиотропные противовирусные средства;
– симптоматические препараты;
– иммуномодулирующие средства [4].
• В свою очередь, международные рекомендации оговаривают целесообразность симптоматической терапии, выбираемой согласно превалирующим симптомам и направленной на уменьшение дискомфорта пациента [5].
• Сроки начала лечения пациентов с предполагаемым или вероятным случаями гриппа не зависят от отсутствия или задержки получения результата диагностического тестирования на грипп [1].
2.
• Наилучший лечебный эффект при гриппе достигается в случае старта противовирусной терапии в первые 12 ч от начала болезни. При отсутствии лечения в ранние сроки (в первые 48 ч от начала заболевания) прием противовирусных препаратов может быть начат на любом этапе разгара болезни, когда предполагается или документально подтверждена возможность текущей репликации вируса гриппа [1, 6].
Система врожденного иммунитета распознает вирусную инфекцию с помощью встроенных в цитоплазматическую мембрану клеток Toll-подобных или цитоплазматических паттерн-распознающих рецепторов (PRRs), ответственных за обнаружение в очаге инфекции компонентов патогенов, атипичных для нормальных клеток, таких как двуспиральные РНК (dsRNA) или липополисахариды (LPS).
Распознавание вирусной инфекции приводит к индукции цитокинового ответа, и прежде всего интерферонов (IFN) I, II и III типа. Защитная функция IFN обусловлена двумя основными факторами: 1) способностью индуцировать синтез множества противовирусных белков в зараженных и окружающих их клетках; 2) иммуномодулирующими функциями – влиянием на миграцию и активацию клеток врожденного иммунитета, определение развития специфического В- и Т-клеточного иммунного ответа [7, 8].
3.
• Режимы применения при гриппе ингибиторов нейраминидазы, зарегистрированных в России, приведены в таблице 4.

• Осельтамивир и занамивир эффективны только в отношении вирусов гриппа A и B. При этом в мире отмечается развитие резистентности вирусов гриппа к ингибиторам нейраминидазы. Применение препаратов этой группы не способствует сохранению постинфекционного иммунитета [9, 10].
• В 2017 г. Комитет экспертов ВОЗ рекомендовал перенести осельтамивир из основного в дополнительный перечень лекарственных средств при гриппе, а его прием ограничить тяжелой болезнью в связи с подтвержденной или предполагаемой вирусной инфекцией гриппа у тяжелобольных госпитализированных пациентов. Причина такого решения в том, что дополнительные данные об осельтамивире при лечении сезонного и пандемического гриппа свидетельствуют о снижении ранее предполагаемой эффективности препарата на соответствующие клинические исходы [6].
4.
• Механизмы противовирусного действия имидазолилэтанамида пентандиовой кислоты включают: a) повышение синтеза интерфероновых (IFN) рецепторов (увеличение плотности IFNAR1 и IFNAR2) на поверхности клеток, что вызывает усиление чувствительности клеток к сигналам IFN (к их минимальному количеству). При этом имидазолилэтанамид пентандиовой кислоты не относится к интерфероногенам (индукторам IFN), которые не эффективны после манифестации гриппа и ОРВИ [3]: в неинфицированных клетках препарат не индуцирует выработку IFN α/β, не приводит к экспрессии мРНК, провоспалительных цитокинов и хемокинов [11, 12]; b) восстановление сигнального пути IFN (система белков Jak-STAT) за счет активации (фосфорилирования) STAT-1, который служит ключевым передаточным звеном IFN-сигнала от рецептора к факторам транскрипции генов, стимулируемых IFN; c) активацию синтеза следующих противовирусных клеточных эффекторных белков:
– MxA. Этот ранний фактор противовирусного ответа связывается с вирусными нуклеокапсидами, способствует их иммобилизации и деградации (у вируса гриппа связывание происходит с NP белком), препятствуя их внутриклеточному транспорту; ингибирует активность РНК-хеликазы UAP56 (фермента, расплетающего спирали РНК вируса); способствует апоптозу инфицированных клеток;
– PKR (блокирует синтез вирусных белков на рибосомах, активирует апоптоз и элиминацию зараженных клеток);
– 2´-5´OAS (вызывает деградацию м-РНК вируса в зараженных клетках, обеспечивая их защиту, что объясняет эффективность в отношении различных респираторных вирусов).
• Имидазолилэтанамид пентандиовой кислоты показан для лечения как гриппа, так и ОРВИ [13]. Режим приема препарата в зависимости от показаний, выраженности симптомов и наличия коморбидных заболеваний приведен в таблице 5.

• С учетом уточнения механизмов действия имидазолилэтанамида пентандиовой кислоты, не связанных с индукцией IFN и опасностью развития «цитокинового шторма» [3], препарат можно рассматривать как препарат этиотропной терапии при гриппе и ОРВИ.
• Препараты адамантанового ряда (амантадин, римантадин), действующие против вирусов гриппа A, но не активные против других респираторных вирусов, в настоящее время не рекомендуются для лечения гриппа из-за повсеместного распространения резистентных к ним штаммов вирусов гриппа. Более 90% современных изолятов вируса гриппа A обладают устойчивостью к этим препаратам [1, 6].
• У вируса пандемического гриппа 2009 г. была исходная резистентность к препаратам адамантанового ряда [6].
• Из других противовирусных средств прямого действия при острых респираторных инфекциях в России используется ингибитор слияния (фузии) умифеновир. Механизм действия этого препарата в отношении вирусов негриппозной этиологии связан с индукцией ИФН [14, 15]. Умифеновир может применяться для неспецифической химиопрофилактики гриппа и ОРВИ [1].
• Противовирусные препараты непрямого действия не имеют достаточной доказательной базы эффективности при гриппе и ОРВИ и не одобрены к применению в Европе и США. Их назначение при эпизодических легких ОРВИ не рекомендовано [3].
• Иммуномодулирующие препараты (индукторы IFN и др.) после манифестации гриппа и ОРВИ не эффективны [3]:
– в динамике инфекции длительная и избыточная продукция IFN может приводить к развитию чрезмерной воспалительной реакции в связи с гиперпродукцией хемокинов (CCL2, CXCL10) и инфильтрацией альвеол провоспалительными моноцитами/макрофагами и плазмоцитоидными дендритными клеткам;
– вирусные/бактериальные частицы (dsRNA/LPS) в зоне воспаления усиливают выработку провоспалительных цитокинов, крайним проявлением которой может стать так называемый цитокиновый шторм (генерализация воспалительного процесса);
– интенсивность повреждения легких зависит не столько от интенсивности вирусной репродукции, сколько от неконтролируемой выработки иммунными клетками провоспалительных цитокинов и чрезмерной инфильтрации тканей легкого клетками врожденного иммунитета;
– индуцируемая IFN типа I экспрессия проапоптотического лиганда TRIAL запускает массовый апоптоз эпителиальных клеток, что может приводить к развитию острого респираторного дистресс-синдрома (ОРДС).
• Препараты IFN/индукторы IFN на пике вирусной инфекции не эффективны, поскольку вирусы подавляют распространение сигналов IFN. Более того, оно может быть опасно по следующим причинам [16–19]:
– IFN, выполняющие защитную функцию в начале инфекции, могут быть разрушительным фактором на пике заболевания (IFN -опосредованная иммунопатология: «цитокиновый шторм»);
– избыток IFN l и ll типа способствует развитию вторичных бактериальных и других осложнений вирусной инфекции;
– развитие IFN-ответа при вирусной инфекции приводит к снижению миграции и фагоцитирующей функции нейтрофилов и макрофагов через проапоптотические механизмы или на уровне эпигенетической регуляции их функций;
– IFN I типа способны подавлять антибактериальную защиту за счет ингибирования продукции Т-клетками интерлейкина-17 (IL-17);
– отсутствие IL-17 ответа снижает выработку антибактериальных пептидов (липокалин 2 и BPIFA1), что приводит к усилению роста бактерий в очаге вирусной инфекции.
• В то же время индукторы IFN могут использоваться в качестве средств профилактики гриппа и ОРВИ в эпидемический период [1]. • Препараты интерферона обладают крайне низкой биодоступностью.
• Клиническая эффективность гомеопатических средств не доказана. Ввиду отсутствия убедительной доказательной базы средства этой группы не включены ни в одни клинические рекомендации (ни в международные, ни отечественные) [3, 20]. Согласно вердикту ВОЗ, «использование гомеопатии не имеет доказательной базы, в случаях применения в качестве альтернативы основному лечению несет реальную угрозу здоровью и жизни людей». Международный обзор 220 рандомизированных плацебо-контролируемых исследований позволил заключить, что применение гомеопатических препаратов сопоставимо по эффективности с плацебо.
5.
• Симптоматическая терапия гриппа и ОРВИ направлена на минимизацию общеинтоксикационных симптомов (лихорадки, слабости, потливости, ломоты в мышцах) и специфических для респираторного поражения симптомов (ринореи, заложенности носа, кашля, бронхиальной обструкции).
• Симптоматическую терапию гриппа и ОРВИ у взрослых необходимо назначать, учитывая следующие факторы:
– известную или вероятную повышенную чувствительность к отдельным компонентам препаратов;
– возможные межлекарственные взаимодействия;
– наличие у пациента значимой сопутствующей патологии: заболеваний сердечнососудистой системы (в первую очередь артериальной гипертензии, нарушений ритма и хронической сердечной недостаточности), легких, печени, почек, сахарного диабета, алкоголизма, нарушений статуса питания и др.;
– беременность и период грудного вскармливания [3].
6.
• Из монопрепаратов, рекомендованных при лихорадке, головной боли, боли в мышцах и суставах, симптомах интоксикации на фоне гриппа и ОРВИ, кроме парацетамола и ибупрофена, может применяться диклофенак в минимальной дозе 12,5 мг. Не рекомендовано назначение ацетилсалициловой кислоты и содержащих ее препаратов из-за риска развития геморрагического синдрома [1, 3].
7.
• Комбинированные парацетамолсодержащие препараты могут быть использованы не только для купирования лихорадки, но и при субфебрильной температуре, а также у пациентов без температурной реакции, поскольку парацетамол обладает анальгетическим эффектом, а другие компоненты (например, фенилэфрин, фенирамин) способствуют уменьшению катаральной симптоматики [3].
В ряде случаев при острой респираторной инфекции вслед за вирусной атакой происходит колонизация и инвазия бактериальных патогенов (ассоциируемая вторичная инфекция):
• при инфицировании вирусами гриппа – S. pneumoniae, S. aureus, S. pyogenes, H. influnzae, M. catarrhalis, Neisseria meningitides;
• RSV – S. pneumoniae;
• аденовирус – S. pneumoniae, H. influenzae, M. catarrhalis;
• риновирус человека – S. pneumoniae, S. aureus, H. influenzae, M. catarrhalis;
• вирус парагриппа – M. catarrhalis, S. pneumoniae;
• hMPV – S. pneumoniae [21].
• Рекомендованная дозировка парацетамола (в составе противопростудных препаратов) определяется температурой тела и весом пациента (табл. 6).

• Использование комбинированных противопростудных симптоматических препаратов представляется более удобным, чем монокомпонентных лекарственных средств, и при этом достаточно безопасным для пациентов [3].
8.
Кроме деконгестантов в форме монопрепаратов, для устранения отечности слизистой оболочки носа и ринореи может применяться ряд комбинированных средств для местного применения (фенилэфрин + диметиндена малеат, ксилометазолин + ипратропия бромид и др.) [11].
9.
• Для лечения непродуктивного изнуряющего кашля, помимо препаратов бутамирата возможно применение декстрометорфана, который содержится в составе ряда многокомпонентных препаратов [1]. При этом следует помнить, что декстрометорфан входит в «Список психотропных веществ, оборот которых в Российской Федерации ограничен и в отношении которых допускается исключение некоторых мер контроля в соответствии с законодательством РФ и международными договорами РФ» [22].
10.
При бронхообструктивном синдроме показано ингаляционное применение комбинаций M-холинолитиков и β2-агонистов короткого действия [3], например, ипратропия бромида и сальбутамола.



