Подагра – хроническое заболевание, связанное с нарушением мочекислого обмена; оно характеризуется повышением в крови уровня мочевой кислоты и отложением в тканях кристаллов натриевой соли мочевой кислоты (уратов). Клинически заболевание проявляется рецидивирующим острым артритом и образованием подагрических узлов (тофусов) [1]. Имеется большое количество исследований, показывающих, что подагра и бессимптомная гиперурикемия относятся к независимым факторам риска сердечно-сосудистых событий и поражения почек [2–4].
Согласно многим эпидемиологическим исследованиям, распространенность бессимптомной гиперурикемии и подагры во многих странах мира продолжает увеличиваться [5–8]. В России встречаемость бессимптомной гиперурикемии составляет 16,8% [9], подагры – 0,3% [10].
В соответствии с современными клиническими рекомендациями Европейской антиревматической лиги (EULAR, 2016), Американской коллегии ревматологов (ACR, 2020) и Ассоциации ревматологов России (АРР, 2019), пациентам с острым подагрическим артритом в качестве терапии первой линии рекомендовано назначение нестероидных противовоспалительных препаратов (НПВП), колхицина, глюкокортикоидов (ГК) или блокаторов интерлейкина-1. Помимо купирования острого подагрического артрита, НПВП рекомендуется применять в рамках профилактической терапии в течение 3–6 мес при назначении пациенту уратснижающих препаратов [11–13]. Считается, что эффективность различных НПВП (как селективных, так и неселективных блокаторов циклооксигеназы) сопоставима, и выбор препарата должен осуществляться лечащим врачом в зависимости от клинической ситуации.
Прием НПВП ограничивают нежелательные явления, обусловленные сердечно-сосудистой патологией, заболеваниями желудочно-кишечного тракта (ЖКТ), системы кроветворения и почек. Учитывая частое и иногда длительное применение НПВП у пациентов с подагрой, актуальным является вопрос о влиянии препаратов этой группы на течение существующих коморбидных состояний и их роли в возникновении данных форм патологии.
Цель исследования – изучить частоту и течение артериальной гипертензии, а также встречаемость острого инфаркта миокарда и хронической болезни почек у пациентов с подагрой до проведения исследования и через 30 дней на фоне лечения различными НПВП.
МАТЕРИАЛ И МЕТОДЫ
 Коллективами Северо-Западного государственного медицинского университета (СЗГМУ) им. И.И. Мечникова и Клинической ревматологической больницы № 25 (г. Санкт-Петербург) на базе облачной электронной системы хранения данных GALENOS (OOO «TexЛаб») ведется Санкт-Петербургский городской регистр пациентов с подагрой и бессимптомной гиперурикемией. Анализ применения НПВП у пациентов с подагрой проводился на основании данных этого регистра за период с 2000 по 2019 г.
Коллективами Северо-Западного государственного медицинского университета (СЗГМУ) им. И.И. Мечникова и Клинической ревматологической больницы № 25 (г. Санкт-Петербург) на базе облачной электронной системы хранения данных GALENOS (OOO «TexЛаб») ведется Санкт-Петербургский городской регистр пациентов с подагрой и бессимптомной гиперурикемией. Анализ применения НПВП у пациентов с подагрой проводился на основании данных этого регистра за период с 2000 по 2019 г.
Критерии включения в исследование:
- наличие информированного согласия пациента на включение в регистр;
- диагноз «подагра», верифицированный в соответствии с критериями EULAR/ACR 2015 г.;
- возраст более 18 лет на момент включения в исследование.
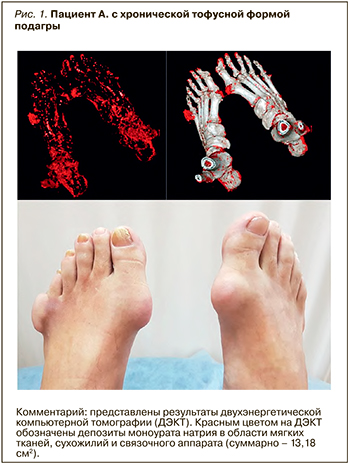
В исследование были включены пациенты с обострением подагрического артрита и хронической тофусной подагрой (рис. 1), имевшие сопутствующую артериальную гипертензию (АГ) с достигнутыми целевыми уровнями артериального давления (АД), ишемическую болезнь сердца в виде стабильной стенокардии напряжения I и II функциональных классов на фоне проводимой комплексной терапии или хроническую болезнь почек (ХБП) 1–3а стадий.
Критериями исключения из исследования служили беременность и вторичный генез подагры, тяжелая патология сердечно-сосудистой системы со значимой степенью недостаточности кровообращения (нестабильная стенокардия, стенокардия напряжения III и IV функциональных классов, значимые нарушения ритма и проводимости сердца, цереброваскулярная болезнь с перенесенными нарушениями мозгового кровообращения), онкопатология, тяжелые заболевания печени и болезни ЖКТ в стадии обострения. Наряду с этим в исследование не включались пациенты с подагрой и сопутствующей АГ, у которых не были достигнуты целевые уровни АД, а также пациенты с ХБП 3б–5 стадий.
Внесение данных пациентов в регистр проводилось в обезличенном виде, не позволяющем идентифицировать отдельного пациента как личность, каждому пациенту присваивался индивидуальный номер. Исследование было одобрено локальными комитетами по этике СЗГМУ им. И.И. Мечникова и Клинической ревматологической больницы № 25 (г. Санкт-Петербург).
В исследовании были проанализированы данные пациентов, которые наблюдались на амбулаторно-поликлиническом этапе в Клинической ревматологической больнице № 25 (г. Санкт-Петербург) в течение 30 сут с обострением подагрического артрита и хронической тофусной формой подагры. Все пациенты получали комплексную терапию, включающую уратснижающие препараты (аллопуринол или фебуксостат), противовоспалительные препараты (НПВП, или НПВП + колхицин, или НПВП + локальные формы ГК), а также лекарственные средства для лечения коморбидных состояний. Перед началом приема любого препарата из группы НПВП каждый пациент проходил период «отмывки» от предыдущей терапии до 5 сут в зависимости от периода выведения заменяемого лекарственного средства. Все пациенты совместно с НПВП получали гастропротективную терапию препаратами из группы ингибиторов протонной помпы.
В зависимости от вида НПВП-терапии были выделены следующие группы пациентов:
- получавшие только диклофенак;
- получавшие диклофенак и другие НПВП поочередно;
- получавшие другие НПВП.
В ходе исследования учитывались длительность приема и используемые дозировки препаратов. Наряду с этим рассчитывался индекс приема НПВП Дугадоса – относительное количество препарата (%), суммарно принятое пациентом за определенный период времени и рассчитанное относительно количества препарата, максимально разрешенного к приему за указанный период. Были проанализированы частота и течение АГ, а также встречаемость острого инфаркта миокарда (ОИМ) и ХБП до начала терапии НПВП и их возникновение de novo на фоне приема различных препаратов этого класса.
Статистический анализ проводился с использованием пакета программного обеспечения STATISTICA 8.0 (StatSoftInc, США). Характер распределения данных оценивали графическим методом и с использованием критерия Шапиро–Уилка. В случае нормального распределения признака его описывали в виде среднее ± стандартное отклонение (M±SD). При распределении данных, отличном от нормального, применяли критерий χ2. Различия и взаимосвязи считали статистически значимыми при p ≤0,05.
 РЕЗУЛЬТАТЫ
РЕЗУЛЬТАТЫ
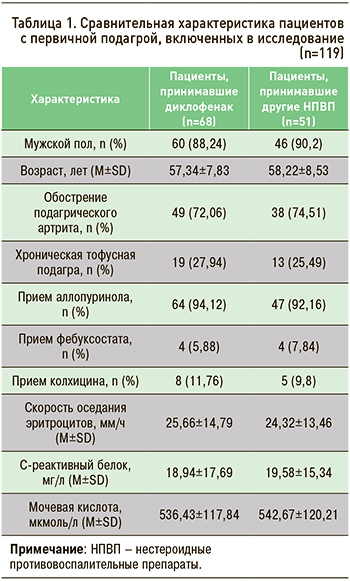
В общей сложности в городской регистр были включены данные обследования и лечения 1725 больных с первичной подагрой. Диклофенак получали 68 (3,94%) пациентов: из них 37 (54,41%) применяли его как единственный НПВП, еще у 31 (45,59%) прием диклофенака чередовался с другими НПВП. Группу сравнения составил 51 (2,96%) пациент с первичной подагрой, которые получали различные НПВП, кроме диклофенака, без чередования с другими НПВП. Таким образом, в исследование и статистический анализ суммарно вошли клинические данные 119 пациентов с первичной подагрой. Показатели принимаемых уратснижающих препаратов и колхицина, уровней мочевой кислоты и С-реактивного белка в крови, скорости оседания эритроцитов, а также клинические формы подагры, пол и возраст в группе пациентов, получавших диклофенак, и группе сравнения были сопоставимы (табл. 1).
До включения в исследование сопутствующая АГ была выявлена у 62 (91,18%) пациентов, принимавших диклофенак, и у 42 (82,35%) больных подагрой, получавших другие НПВП (распространенность в популяции – до 40% среди женщин; до 47% среди мужчин [14]). Перенесенный ОИМ наблюдался у 2 (2,94%) пациентов, принимавших диклофенак, и у 1 (1,96%) пациента, получавшего другие НПВП (распространенность в популяции 129 на 100 тыс. населения [15]). Встречаемость ХБП в группе диклофенака составила 45 (66,18%) случаев против 36 (70,59%) в группе других НПВП (распространенность в популяции 36% [16]). В целом частота АГ, ОИМ и ХБП в исследуемых группах пациентов статистически значимо не различалась (p >0,05), однако достоверно превышала популяционную (p <0,001).
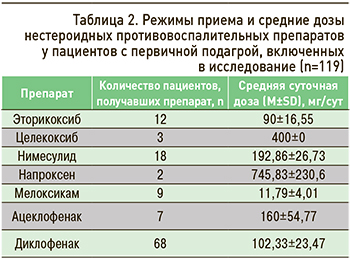 Средняя продолжительность приема диклофенака составила 17,69±4,35 дней, других НПВП из группы сравнения – 16,84±6,32 дня (p >0,05). Индекс приема НПВП (индекс Дугадоса) для диклофенака был равен 4,66%, для других препаратов – 4,38% (p >0,05). Режимы приема и средние дозы НПВП представлены в таблице 2.
Средняя продолжительность приема диклофенака составила 17,69±4,35 дней, других НПВП из группы сравнения – 16,84±6,32 дня (p >0,05). Индекс приема НПВП (индекс Дугадоса) для диклофенака был равен 4,66%, для других препаратов – 4,38% (p >0,05). Режимы приема и средние дозы НПВП представлены в таблице 2.
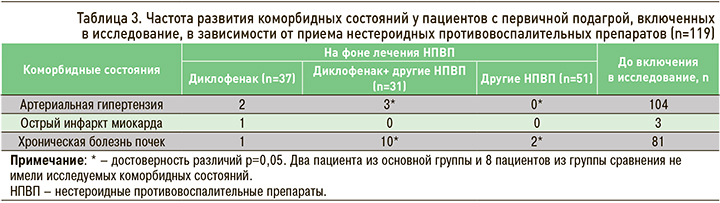
В период наблюдения было проанализировано возникновение de novo АГ, ОИМ и начальных проявлений ХБП у пациентов с первичной подагрой во время приема различных НПВП. В группе больных, получавших только диклофенак, повышение АД было выявлено у 2 (5,41%) человек, ОИМ – у 1 (2,7%) пациента, у 1 (2,7%) пациента отмечались начальные проявления ХБП. В группе больных, чередовавших прием диклофенака с другими НПВП, повышение АД было обнаружено в 3 (9,68%) случаях, в 10 (32,26%) наблюдались начальные проявления ХБП. В группе сравнения начальные проявления ХБП имели место у 2 (3,92%) пациентов. Все группы не различались по частоте первично возникшего ОИМ (p >0,05).
Частота АГ и начальных проявлений ХБП de novo (табл. 3) была достоверно выше в группе пациентов, чередовавших прием диклофенака с другими НПВП, чем в группе сравнения (p <0,05). У остальных пациентов на фоне терапии диклофенаком и другими НПВП не отмечалось прогрессирования АГ, уровень АД оставался стабильным. Не отмечалось прогрессирования и декомпенсации ХБП, хронических заболеваний ЖКТ и хронических заболеваний других органов и систем органов.
ОБСУЖДЕНИЕ
В развитии подагры выделяют следующие стадии: бессимптомная гиперурикемия с отсутствием депозитов моноурата натрия (МУН); бессимптомная гиперурикемия с наличием депозитов МУН, но без симптомов или анамнеза подагры; острый подагрический артрит; межприступный период; хроническая тофусная подагра [11]. Как уже отмечалось, подагра и бессимптомная гиперурикемия выступают независимыми факторами риска сердечно-сосудистых событий и поражения почек [2–4]. Настоящее исследование показало, что встречаемость АГ, ХБП, ОИМ у пациентов с первичной подагрой еще до приема НПВП превышало популяционные значения, что согласуется с нашими более ранними работами [17] и показывает высокий потенциал подагры в плане формирования сопутствующего поражения кардиоваскулярной системы и почек.
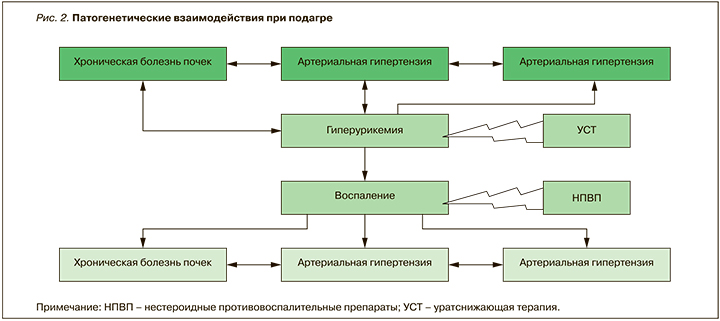
Следует отметить, что АГ, ОИМ и ХБП способны взаимно потенцировать друг друга, формируя «порочные круги»: так, ХБП поддерживает АГ, АГ провоцирует развитие ОИМ и усугубляет ХБП. Кроме того, они тесно связаны с хроническим воспалением, сохраняющимся при подагре из-за не всегда достаточной коррекции гиперурикемии (рис. 2). Таким образом, неконтролируемое воспаление на фоне гиперурикемии способствует высокой сердечно-сосудистой заболеваемости и смертности у пациентов, не получающих адекватную, своевременную и профилактическую терапию уратснижающими препаратами и НПВП.
НПВП широко используются при всех клинических формах подагры – от однократного приема до длительных 6-месячных курсов. По данным анализа применения традиционных НПВП при подагре, наиболее часто среди них назначаются диклофенак (41%) и индометацин (32%) [18].
Диклофенак является производным фенилуксусной кислоты [19]. Натриевая соль диклофенака – это таблетированная форма препарата с медленным высвобождением, которая была впервые произведена в Японии в 1974 г. и предназначалась для лечения ревматических заболеваний и болевого синдрома низкой и умеренной интенсивности [20]. Как и большинство НПВП, диклофенак обладает обезболивающим, противовоспалительным и жаропонижающим действием. Препарат ингибирует циклооксигеназу (ЦОГ) как 1-го, так и 2-го типа [21].
Диклофенак относится к числу наиболее широко используемых НПВП. С момента своего появления на рынке это лекарственное средство применялось более чем у 1 млрд пациентов и занимает 8-е место по продажам среди всех медицинских препаратов в мире [22, 23]. В настоящее время оригинальный диклофенак доступен приблизительно в 120 странах мира [24]. В Дании диклофенак, наряду с ибупрофеном, является самым широко используемым неселективным НПВП [25]. По данным исследования, проведенного в Мексике, именно диклофенак был лекарством, наиболее часто назначаемым для лечения острых приступов подагрического артрита [24].
Диклофенак может иметь преимущество по сравнению с другими НПВП, в связи с тем что обладает относительно низкой токсичностью и потенциально более низким негативным влиянием на сердечно-сосудистую систему, чем ингибиторы ЦОГ-2, а также минимальным воздействием на почки и печень [24]. Согласно результатам метаанализа 24 исследований по применению НПВП у пациентов с подагрой, при оценке боли по визуально-аналоговой шкале эффект диклофенака в дозах 75 мг 2 раза/ сут и 75 мг 4 раза/сут был сопоставим с эторикоксибом, а при приеме в режиме 100 мг 4 раза/ сут – с целекоксибом [26]. Сравнение влияния бетаметазона и диклофенака на изменение интенсивности боли при подагре продемонстрировало их сравнимую эффективность на 7-й день терапии [27].
В нашем исследовании у абсолютного большинства пациентов на фоне терапии диклофенаком и другими НПВП не отмечалось прогрессирования АГ: уровень АД оставался стабильным. Также не было выявлено прогрессирования и декомпенсации ХБП, хронических заболеваний ЖКТ и других органов и систем. Возникновение АГ и начальных проявлений ХБП de novo чаще встречалось у пациентов, чередовавших прием диклофенака и других НПВП. Это может быть связано с более длительным суммарным приемом препаратов и потенцированием их нежелательных явлений. В дальнейшем планируется проведение длительного наблюдения за больными подагрой с сердечно-сосудистой и почечной патологией, получающими различные НПВП, для более подробного изучения их влияния на течение указанных коморбидных состояний.
ЗАКЛЮЧЕНИЕ
АГ, ОИМ и ХБП у пациентов с подагрой встречались одинаково часто в группах пациентов, получающих диклофенак и другие НПВП, превышая распространенность этих заболеваний в популяции. Частота АГ и начальных проявлений ХБП выявлялась достоверно чаще у пациентов, чередовавших прием диклофенака с другими лекарственными средствами из группы НПВП. Распространенность АГ, ОИМ и ХБП у пациентов была значительно выше до начала исследования, что свидетельствует о наибольшем вкладе гиперурикемии и воспалительного процесса в развитие поражения сердечно-сосудистой системы и почек при подагре. Вместе с тем для более подробного изучения влияния различных НПВП на формирование и течение коморбидных состояний в дальнейшем требуется включение в исследования большего количества больных подагрой с сердечно-сосудистой и почечной патологией, принимающих препараты этого класса, и более длительное наблюдение за ними.


