Болезни костно-мышечной системы (БКМС), основным проявлением которых выступает хроническая боль, – одна из наиболее частых причин обращения за врачебной помощью. По данным серии эпидемиологических исследований, 20–30% жителей развитых стран мира испытывают серьезные страдания, связанные с патологией суставов и позвоночника, причем среди лиц старше 65 лет их количество превышает 50%. Весьма показательны данные оценки «Глобального бремени болезней» (GBD) – исследовательской программы Всемирной организации здравоохранения (ВО), в ходе которой был проведен анализ состояния здоровья жителей 195 государств и территорий. Так, общее число зафиксированных случаев БКМС на 2017 г. достигло 1,3 млрд, а суммарная потеря трудоспособности из-за этой патологии составила 138,7 млн DALYs (число лет, проведенных с инвалидностью). Среди БКМС наиболее часто встречалась неспецифическая боль в нижней части спины (НБС) – 36,8%, остеоартрит (ОА) – 19,3%, боль в области шеи – 18,4%, подагра – 2,6%, ревматоидный артрит (РА) – 1,3% [1–3].
Большинство пациентов с такой патологией (прежде всего с НБС и ОА) приходит на прием к врачам общей практики, на которых ложится основная нагрузка по первичной диагностике и назначению терапии в дебюте БКМС. Это подтверждают данные исследования КОРОНА-2, в ходе которого проводилась оценка факторов риска осложнений со стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы (ССС) у пациентов, нуждающихся в обезболивающей терапии. В нем принял участие 2021 практикующий доктор из России и 8 стран СНГ, причем 43,3% из них были как раз врачами общей практики. Согласно полученным данным, среди общего потока пациентов, обращавшихся за медицинской помощью к этой категории специалистов, лица с БКМС составляли более трети – 34,1% [4].
В связи с этим крайне важно, чтобы практикующие врачи имели четкое представление о современной концепции патогенеза болезней суставов и позвоночника, стратегии ведения этой категории больных, и в первую очередь о современных возможностях эффективного и безопасного контроля скелетно-мышечной боли.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ХРОНИЧЕСКОЙ БОЛИ
Боль – основное проявление БКМС, определяющее тяжесть страданий, снижение качества жизни и социальной активности пациентов. Этот синдром отражает основные элементы патологического процесса, такие как повреждение биологических структур, воспаление, периферическая и центральная сенситизация, а также прогрессирующие дегенеративные изменения. Именно поэтому интенсивная хроническая боль является важнейшим маркером усиления ОА. Это демонстрирует, в частности, метаанализ 79 исследований (Bastick A. et al.) [5], в которых изучались факторы риска рентгенологического прогрессирования ОА, такие как узелки Гибердена, варусная деформация колена, высокий уровень биомаркеров, в частности фактора некроза опухоли-α (ФНО-α) и гиалуроновой кислоты. Наиболее значимым фактором риска при этом оказался уровень боли, оцениваемый по индексу WOMAC.
Аналогичное исследование провели de Rooij M. et al. [6], проанализировавшие данные 38 работ, в которых изучались факторы риска клинического прогрессирования ОА (усиление боли и ухудшение функции сустава). Была показана значимость таких биологических маркеров, как билатеральность поражения суставов, прогрессирование рентгенологической стадии, снижение мышечного тонуса и темпа ходьбы, а также коморбидных заболеваний. При этом, как и в работе Bastick A. et al., наиболее значимым фактором риска прогрессирования болезни было признано длительное сохранение выраженной суставной боли.
Близкая ситуация наблюдается и при хронической НБС. Takeyachi Y. et al. [7], наблюдавшие когорту из 816 пациентов с НБС, установили четкую корреляцию между выраженностью и продолжительностью боли в спине и прогрессированием функциональных нарушений позвоночника. Ferrari S. et al. [8], проводившие динамическое наблюдение за группой из 310 пациентов с хронической НБС, отметили взаимосвязь между снижением качества жизни, плохим самочувствием, инвалидизацией и персистенцией интенсивной боли в спине.
Хроническая боль служит мощным стрессорным фактором, обладающим существенным негативным действием на макроорганизм [9]. Системным ответом на длительную болевую стимуляцию становится активация симпатоадреналовой системы, повышение артериального давления и частоты сердечных сокращений, протромботические сдвиги, развитие депрессии и тревожности. Суммация этих негативных эффектов приводит к прогрессированию коморбидных заболеваний, прежде всего кардиоваскулярной системы.
Так, Smith D. et al. [10], отталкиваясь от результатов двух британских когортных исследований – English Longitudinal Study of Ageing (n=6324) и North Staffordshire Osteoarthritis Project (n=10 985), оценили риск летального исхода у лиц ≥50 лет, испытывающих хроническую боль. Выяснилось, что боль, с точки зрения пациентов влиявшая на их жизнь или вызывавшая серьезное беспокойство, ассоциировалась с повышением риска смерти примерно на 30%: относительный риск (ОР) составил 1,29 и 1,3 соответственно. Боль, значительно влияющая на жизнь пациентов, повышала риск смерти на 88% (ОР 1,88).
Американские эпидемиологи Mendy А. et al. [11] представили данные по риску летального исхода в когорте из 51 938 жителей США, 40,6% из которых страдали ОА. Было показано, что наличие этого заболевания ассоциировалось с повышением риска смерти на 43% (ОР 1,43), а раннее начало ОА – на 53% (ОР 1,53). Аналогичные данные были получены Zhu К. et al. [12], которые наблюдали группу из 1484 женщин старше 70 лет с хронической НБС. Стойкие болевые ощущения (ежедневная боль, которая наблюдалась примерно у четверти пациенток) ассоциировались со значительным повышением риска летального исхода вследствие кардиоваскулярных проблем (ОР 2,13).
Учитывая приведенные данные, становится очевидным, что эффективный контроль боли при БКМС следует рассматривать не просто как способ повышения качества жизни, но и как важнейшее направление терапии, призванное сохранить здоровье и снизить вероятность гибели пациентов.
ПАТОГЕНЕЗ ХРОНИЧЕСКОЙ СКЕЛЕТНО-МЫШЕЧНОЙ БОЛИ
Действенный контроль хронической боли возможен лишь при хорошем знании механизма ее развития (рис. 1): это позволяет сформировать индивидуализированный патогенетический подход к проведению анальгетической терапии. В дебюте БКМС основной причиной появления болевых ощущений считается активация периферических ноцицепторов, которая связана с локальной воспалительной реакцией. Воспаление, вызванное иммуновоспалительными (при РА), метаболическими (при подагре) или биомеханическими нарушениями (при ОА и НБС), является мощным фактором стимуляции болевых рецепторов. Клетки воспалительного ответа, среди которых ведущую роль играют представители макрофагального ряда, синтезируют ряд биологически активных субстанций, способных вызывать прямое возбуждение ноцицепторов или существенно повышать их чувствительность к болевым и неболевым стимулам (периферическая сенситизация). Таким действием обладают цитокины – ФНО-α, интерлейкины (ИЛ) 1 и 6, гранулоцитарно-макрофагальный колониестимулирующий фактор и другие, а также медиаторы воспаления – простагландин (ПГ) Е2, лейкотриены, субстанция Р, брадикинин, фактор роста нервов (ФРН) и др. Экспериментальные и клинические работы четко показывают взаимосвязь между выраженностью локальной воспалительной реакций и интенсивностью болевых ощущений [13–15].
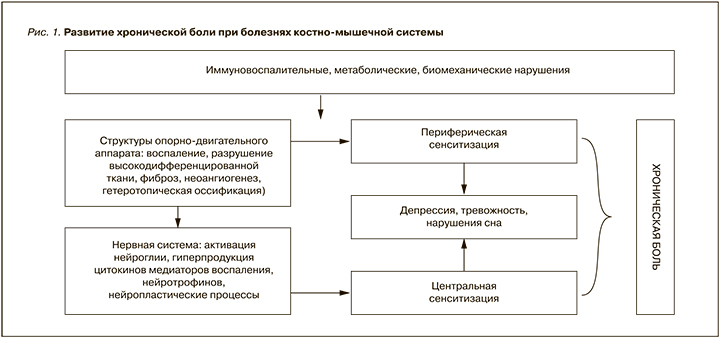
На более поздних стадиях развития БКМС важным моментом, способствующим хронизации боли, выступают дегенеративные процессы. Они возникают как итог разрушения высокодифференцированной ткани опорно-двигательной системы – ее клеток (хондроцитов, остеоцитов, миоцитов, тендоцитов) и структурированного межклеточного матрикса, с замещением последнего грубой фиброзной тканью. Проявления дегенерации включают неоангиогенез, нейрофиброгенез и гетеротопическую оссификацию (формирование остеофитов): это приводит к существенным изменениям биомеханических свойств пораженных структур, делающих их менее устойчивыми к механическому стрессу, и способствует дальнейшей деструкции. Кроме того, хроническое воспаление сопровождается прорастанием в поврежденную ткань новообразованных тонких немиелинизированных нервных волокон ноцицептивной системы, весьма восприимчивых к болевым и неболевым стимулам. В результате этого существенно снижается болевой порог, повышается восприимчивость пораженной области человеческого тела к любым негативным воздействиям [13–15].
Стойкие болевые ощущения, сопровождающиеся длительной активацией нейронов, вызывают изменения самой ноцицептивной системы, подключая центральные механизмы формирования хронической боли. Длительная афферентная стимуляция вызывает снижение трансмембранного потенциала нервных волокон, повышение концентрации в периневральном пространстве и области синапсов ионов K+ и Са2+, а также нейротрансмиттеров (норадреналина, серотонина, ацетилхолина и др.). Это активирует клетки нейронального окружения (нейроглия – астроциты, Шванновские клетки, олигодендроциты, эпиндемальные клетки), которые, в свою очередь, становятся источником синтеза провоспалительных цитокинов, медиаторов и нейротрофинов. Возникает так называемое асептическое нейрональное воспаление, оказывающее значительное влияние на функцию нейронов. Повышение концентрации в периневральном пространстве ФНО-α, ИЛ-1 и -6, ПГ Е2 и ФРН, а также таких нейромедиаторов, как гутамат, приводит к открытию ряда потенциал- и лиганд-зависимых мембранных каналов нервных волокон (в частности, NMDA и P2X), что вызывает трансминерализацию клеток и значительно снижает их потенциал действия. В конечном итоге происходит нарастающее повышение восприимчивости центральных структур ноцицептивной системы к периферическим болевым и неболевым стимулам – развивается феномен центральной сенситизации (ЦС) [13–15].
Появлению ЦС сопутствует значительное снижение болевого порога, расширение зоны болевых ощущений, появление их яркой эмоциональной окраски, напоминающей симптомы при органическом поражении соматосенсорной системы (описание боли как «жгучей», «холодящей», «разрезающий», «как удар током» и т.д.) [16].
ЦС затрагивает не только ноцицептивную систему, но и взаимодействующие с ней отделы центральной нервной системы, ответственные за эмоции и поведенческие реакции. Поэтому хроническая скелетно-мышечная боль нередко сопровождается развитием психоэмоциональных нарушений, утомляемости и нарушений сна. Так, метаанализ Stubbs B. et al. [17], включивший 49 исследований (n=15 855), продемонстрировал, что частота депрессии и тревожности у больных ОА составляет 19,9 и 21,3%. Это на 17 и 35% выше, чем у лиц, соответствующих по возрасту и полу, но не страдающих ОА.
Следует добавить, что эмоциональные переживания и функциональные нарушения, связанные с хронической болью, зависят не только от биологических, но и социальных факторов. Хронизации боли способствует низкий уровень образования и интеллекта, негативный психологический настрой («катастрофизация», «рентные настроения»), недружелюбное социальное отношение, отсутствие возможности моральной и материальной поддержки.
Таким образом, терапия хронической боли должна быть нацелена на две основные мишени – локальное воспаление (и связанную с ним периферическую сенситизацию) и центральные механизмы формирования боли (ЦС, психоэмоциональные нарушения).
КЛЮЧЕВЫЕ АСПЕКТЫ АНАЛЬГЕТИЧЕСКОЙ ТЕРАПИИ
Планируя обезболивающую терапию, необходимо заранее прогнозировать ее возможный результат и довести эту информацию до пациента. Следует учитывать, что даже при использовании эффективных анальгетиков в полной терапевтической дозе не во всех случаях удается добиться быстрого и значительного снижения интенсивности скелетно-мышечной боли. К примеру, оценка результатов применения нестероидных противовоспалительных препаратов (НПВП) при ОА и НБС в серии рандомизированных клинических исследований (РКИ), проведенная в двух последовательных метаанализах Moore R., установила уменьшение боли на 50% лишь у ≈40–50% пациентов [18, 19]. Весьма наглядными представляются и данные Taylor S. et al. [20], изучавших удовлетворенность лечением у 713 больных ОА из Германии, Испании и Англии, получавших НПВП. При умеренно выраженном ОА доля недовольных лечением пациентов составила 31%, при выраженном – 60%. При использовании мощного опиоидного анальгетика тапентадола в течение 12 нед для лечения ОА и хронической НБС, согласно данным метаанализа 4 РКИ (n=4059), количество больных с уменьшением боли на 50% составило лишь 26,9–31,9% [21].
Недостаточная информированность пациентов и их завышенные ожидания от терапии – прямой путь к последующему недовольству и жалобам на «некомпетентного врача». В этом плане очень показательна работа Payne V. et al. [22], которые провели анализ удовлетворенности больных лечением скелетно-мышечной боли по результатам метаанализа 23 РКИ. В итоге 79% (!) пациентов были не удовлетворены эффектом терапии. Причиной этого стало явное расхождение между ожиданиями пациента и реальными возможностями доктора. Так, в среднем пациенты исходно ожидали улучшения на 81–93%, а лечащие врачи планировали достичь улучшения на 44–64% от исходного уровня боли.
Следует помнить, что эффект противоболевой терапии развивается не сразу. При хронической боли значимое улучшение становится заметным лишь через 7–14 дней. Хорошим примером этого положения служит исследование Dougados М. et al. [23], которые сравнили результаты применения НПВП (рофекоксиб по 50 мг или диклофенак по 150 мг/сут) и плацебо у 271 пациента с болью в плече, связанной с тендинитом мышц-ротаторов или субакромиальным бурситом. Согласно полученным данным, через 3 дня лечения число ответчиков на НПВП (снижение боли на 50%) было менее 15%. В то же время на 7-й день терапии хороший результат был отмечен примерно у 54 и 56% больных (на фоне плацебо только у 38%).
Оценивая клиническую ситуацию, необходимо принимать во внимание фенотип боли и преобладающий патогенетический механизм ее формирования. Так, эффективность НПВП будет достаточно высокой, если имеются признаки локального воспаления и связанной с ним периферической сенситизации. В том же случае, когда боль носит чисто механический характер (т.е. возникает только при нагрузке или определенном движении), терапия этими лекарствами может оказаться малоэффективной, и приоритет здесь будет за методами коррекции нарушения биомеханики и дегенеративных изменений (ортезирование, применение препаратов гиалуроновой кислоты, обогащенной тромбоцитами плазмы). Столь же низкой будет эффективность НПВП у пациентов с выраженной ЦС, невропатической болью или существенными психоэмоциональными нарушениями. В этих случаях лечение должно включать антидепрессанты, антиконвульсанты и методы немедикаментозной психологической помощи (такие как когнитивно-поведенческая терапия).
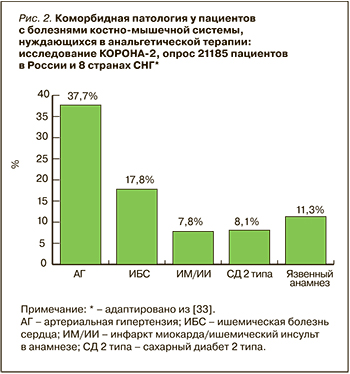 Значимый момент при выборе адекватной тактики противоболевой терапии – оценка коморбидной патологии. Так, заболевания ССС, ЖКТ и почек существенно увеличивают риск развития опасных нежелательных реакций при использовании НПВП. В упомянутом выше исследовании КОРОНА-2 был выполнен анализ факторов риска у 21 185 пациентов с БКМС, нуждающихся в приеме НПВП. Как было установлено, существенная часть больных имела ту или иную коморбидную патологию [24] (рис. 2.).
Значимый момент при выборе адекватной тактики противоболевой терапии – оценка коморбидной патологии. Так, заболевания ССС, ЖКТ и почек существенно увеличивают риск развития опасных нежелательных реакций при использовании НПВП. В упомянутом выше исследовании КОРОНА-2 был выполнен анализ факторов риска у 21 185 пациентов с БКМС, нуждающихся в приеме НПВП. Как было установлено, существенная часть больных имела ту или иную коморбидную патологию [24] (рис. 2.).
ОБЕЗБОЛИВАЮЩИЕ СРЕДСТВА: ПАРАЦЕТАМОЛ
Парацетамол – популярный безрецептурный анальгетик, который широко применяется в клинической практике и повседневной жизни как достаточно безопасное обезболивающее и жаропонижающее средство. Механизм его действия связан с блокадой циклооксигеназы-2 (ЦОГ-2) в ткани ЦНС и, возможно, умеренным стимулирующим влиянием на нисходящие антиноцицептивные системы, в частности эндоканнабиноидную [25].
Реальный анальгетический потенциал парацетамола можно оценить по результатам метаанализа 10 РКИ, в которых он сравнивался с плацебо при ОА (n=3541). При использовании этого препарата в дозе от 2 до 4 г/сут (длительность приема от 3 нед до 3 мес) средний уровень снижения боли составил 23 пункта по визуальной аналоговой шкале (ВАШ) 0–100 пунктов, что лишь на 3,23 пункта (!) превышало показатели плацебо. Число нежелательных реакций в группах парацетамола и плацебо не различалось, за исключением эпизодов повышения аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), которые почти в 4 раза чаще отмечались при использовании парацетамола: 7 и 1,8% соответственно. Но при этом серьезных, клинически выраженных осложнений со стороны печени на фоне приема парацетамола выявлено не было [26].
Как видно, эффективность парацетамола относительно невелика, поэтому его прием целесообразен лишь при умеренно выраженной скелетно-мышечной боли или в комбинации с другими анальгетиками. Главным достоинством этого препарата является низкий риск системных нежелательных реакций со стороны ССС и ЖКТ, что позволяет применять его у пациентов с коморбидными заболеваниями. Следует учитывать риск гепатотоксических реакций при использовании парацетамола, вероятность которых может быть достаточно велика у больных с заболеваниями печени. И, конечно, необходимо помнить о реальной опасности фатального поражения печени при значительной передозировке парацетамола (более 10 г/сут) [27, 28].
ОБЕЗБОЛИВАЮЩИЕ СРЕДСТВА: НПВП
НПВП были и остаются наиболее популярным средствами для купирования острой и контроля хронической скелетно-мышечной боли. Их основное действие связано с блокадой ЦОГ-2 – фермента, ответственного за синтез предшественника одного из главных медиаторов воспаления, ПГ Е2. Этот фармакологический эффект определяет способность НПВП подавлять развитие воспалительного процесса, сенситизацию периферических ноцицепторов, ЦС и проявлений дегенерации высокодифференцированной ткани, таких как неоангиогенез и гетеротопическая оссификация [29].
Эффективность НПВП при ОА доказана многочисленными РКИ и соответствующими метаанализами. Например, da Costa B. et al. [30] провели метаанализ 76 РКИ (n=58 451), в которых оценивался терапевтический потенциал различных НПВП при ОА. Было показано, что эффективность этих препаратов существенно превосходит плацебо и парацетамол. Согласно проведенным расчетам, применение НПВП в терапевтических дозах, в частности, диклофенака 50 мг/сут и эторикоксиба 60 мг/сут, позволяет достичь облегчения страданий (хотя бы в минимально значимой степени) у всех пациентов.
НПВП рассматриваются как основное средство для купирования острой и подострой НБС. Правда, далеко не все эксперты считают НПВП высокоэффективными при данной патологии. Так, в 2020 г. была опубликована работа представителей Кохрановского общества van der Gaag W. et al. [31], представляющая метаанализ 32 РКИ (n=5356), в которых действие НПВП при острой НБС сравнивалось с плацебо. Было установлено, что реальное отличие в эффекте НПВП и плацебо было очень невелико, хотя статистически достоверно: отличие средних составило -7,29 (95% ДИ: от -10,98 до -3,61) по ВАШ 0–100 пунктов. Аналогичная ситуация была отмечена в отношении восстановления функции (опросник Роланда–Морриса, 0–24 балла): отличие средних значений составило всего -2,02 (95% ДИ: от -2,89 до -1,15).
Применение НПВП при хронической скелетно-мышечной боли показывает значимые, но скромные результаты. Gregori D. et al. [32] оценили действие различных фармакологических средств в плане длительного контроля боли при ОА (не менее 12 мес), выполнив анализ 47 РКИ (n=22 037). Было продемонстрировано, что среднее преимущество в снижении боли (по сравнению с плацебо) для НПВП составляло не более 5 мм по 100-миллиметровой ВАШ. Метаанализ 6 РКИ (n=1354), проведенный Enthoven W. et al. [33], показал, что отличие эффекта НПВП от плацебо при хронической НБС составляет лишь -3,3 (95% ДИ: от -5,33 до -1,27) мм по 100-миллиметровой ВАШ.
НПВП способны вызывать серьезные нежелательные реакции, прежде всего со стороны ЖКТ (НПВП-гастро- и энтеропатия), ССС (дестабилизация артериальной гипертензии и сердечной недостаточности, кардиоваскулярные катастрофы) и почек (развитие острой и прогрессирование хронической почечной недостаточности). Риск данных осложнений особенно велик у людей старших возрастных групп со множественной коморбидной патологией. Поэтому НПВП необходимо назначать, тщательно взвешивая предполагаемую пользу и потенциальный вред, связанный с нежелательными явлениями.
Одним из наиболее сбалансированных по соотношению эффективности и безопасности препаратов из группы НПВП является мелоксикам. Этот препарат отличает доказанная эффективность, удобство применения (1 раз в день), наличие форм для парентерального (внутримышечного, в/м) и перорального приема. Так, весьма популярной является «ступенчатая» схема использования мелоксикама, когда лечение в остром периоде начинается с короткого курса в/м инъекций, а затем пациент переводится на прием таблеток для длительного контроля боли [34]. Два метаанализа, опубликованные в последние годы, подтверждают низкую частоту осложнений со стороны ЖКТ, ССС и почек при использовании этого препарата [35, 36].
Следует избегать назначения системных НПВП больным с очень высоким кардиоваскулярным риском, в частности, при наличии в анамнезе инфаркта миокарда, ишемического инсульта и подтвержденной ишемической болезни сердца [29]. Альтернативой в этом случае может стать применение локальных форм НПВП. Серия РКИ и соответствующий метаанализ подтверждает умеренную (но значимую) эффективность этой группы средств при скелетно-мышечной боли. При этом мази и гели с НПВП практически не вызывают системных осложнений со стороны ЖКТ, ССС и почек [37, 38].
При наличии язвенного анамнеза, диспепсии, признаков гастроэзофагеальной рефлюксной болезни или сопутствующего приема антитромботических средств, НПВП целесообразно сочетать с гастропротекторами – ингибиторами протонной помпы или ребамипидом [29].
ОБЕЗБОЛИВАЮЩИЕ СРЕДСТВА: ОПИОИДЫ
Опиоидные анальгетики традиционно считаются наиболее сильными обезболивающими средствами для купирования боли самого различного происхождения. Они широко назначаются в западных странах (прежде всего в США) для контроля неонкологической, в том числе скелетно-мышечной, боли. Так, в 2020 г. были представлены рекомендации Германского общества боли по применению этого класса анальгетиков, где в качестве основных показаний к их использованию указана хроническая боль при ОА, НБС и РА [39].
С другой стороны, в настоящее время на Западе идет активная кампания по сокращению применения опиоидов в клинической практике. Это связано с серьезными злоупотреблениями и нецелевым использованием наркотических анальгетиков, а также высоким риском угрожающих жизни осложнений, связанных с этими препаратами: депрессией дыхания, нарушением функции ЖКТ, психоэмоциональными расстройствами и развитием зависимости [40].
Отметим, что эффективность опиоидов при БКМС вызывает определенные сомнения. В работе Busse J. et al. [41], представляющей метаанализ 9 РКИ от 1 до 6 мес (n=1431), было выполнено сравнение результатов применения опиоидов и НПВП при скелетно-мышечной боли. В соответствии с полученными данными количество пациентов, у которых на фоне использования этих лекарств было достигнуто клинически значимое улучшение боли (не менее 1 см по 100-миллиметровой ВАШ), достоверно не различалось: 74,2 и 84,3% соответственно. Среднее различие эффекта опиоидов и НПВП составило 10,1%, при этом отмечался большой разброс данных: 95% ДИ составил от -6,8 до +19,9%.
Согласно результатам метаанализа 20 РКИ (n=7925), применение опиоидов в среднем обеспечивало снижение боли при НБС на 10,1 (95% ДИ 7,4–12,8) мм по 100-миллиметровой ВАШ. При этом примерно у половины больных прием наркотических анальгетиков пришлось прервать из-за нежелательных реакций или недостаточного эффекта [42].
В нашей стране в связи с очень жесткой системой юридического контроля за оборотом медицинских опиоидов эти препараты используются в терапевтической практике очень редко. Тем не менее в ряде случаев они необходимы. В частности, речь идет о пациентах с интенсивной скелетно-мышечной болью (тяжелый ОА в ожидании эндопротезирования, последствия переломов крупных костей и позвоночника, не купируемая другими средствами хроническая НБС), у которых отмечается неэффективность НПВП или есть противопоказания к их назначению.
ОБЕЗБОЛИВАЮЩИЕ СРЕДСТВА: МИОРЕЛАКСАНТЫ
Миорелаксанты – группа препаратов с различным механизмом действия, способных уменьшать болезненное напряжение скелетных мышц и усиливать эффект анальгетических препаратов, прежде всего НПВП. Миорелаксанты, из которых в России зарегистрированы тизанидин, толперизон, баклофен, широко используются в комбинированной терапии НБС, при ОА и воспалении околосуставных мягких тканей.
По данным метаанализа 5 РКИ (n=495), проведенного Abdel Shaheed С. et al. [43], применение миорелаксантов при НБС обеспечивало снижение интенсивности боли в среднем на 21,3 (95% ДИ: 13,5–29,0 мм) по ВАШ. При этом число нежелательных явлений не отличалось от плацебо: 14,1 и 16,0% соответственно.
В работе Л.И. Алексеевой с соавт. [44] было показано, что применение НПВП в комбинации с миорелаксантом (толперизон) более эффективно при ОА, чем монотерапия НПВП. Через 14 дней лечения 40 пациентов с ОА в группе комбинированной терапии снижение суммарного индекса WOMAC составило 25%, в группе монотерапии НПВП – 14% (p <0,05).
ОБЕЗБОЛИВАЮЩИЕ ПРЕПАРАТЫ: ЛОКАЛЬНЫЕ ИНЪЕКЦИИ ГЛЮКОКОРТИКОИДОВ
Внутрисуставные и околосуставные инъекции глюкокортикоидов (ГК), таких как бетаметазон, триамцинолон и метилпреднизолон, позволяют быстро уменьшить локальное воспаление и устранить боль при ОА и местном воспалении околосуставных мягких тканей (при тендинитах, энтезитах, бурситах). Однако действие ГК сохраняется лишь в течение относительно короткого времени. Это продемонстрировал метаанализ 13 РКИ (Juni Р. et al.; n=1737) [45], в которых изучалась эффективность внутрисуставного введения ГК при ОА коленного сустава. Обезболивающий эффект после инъекции было максимальным в первые 2 нед: стандартизированное различие средних значений (СРС) составило 0,48. Через 4–6 нед эффект были ниже, но все же значимым: 0,41. При наблюдении сроком до 13 нед и до 26 нед результат инъекции ГК практически сходил на нет (СРС 0,22 и 0,07).
Применение ГК может вызывать серьезные системные нежелательные реакции, такие как артериальная гипертензия, гипергликемия, повышение риска септических осложнений. Регулярное использование этого класса препаратов оказывает негативное действие на метаболизм тканей сустава, приводя к более быстрому прогрессированию ОА [46, 47]. Это требует ограничивать использование локальных инъекций ГК 2–3 процедурами (в одну анатомическую область) в течение года.
МЕДЛЕННО ДЕЙСТВУЮЩИЕ СИМПТОМАТИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА
Медленно действующие симптоматические средства (SYSADOA, хондропротекторы) относятся к числу основных препаратов для лечения ОА различной локализации. Способность этих препаратов снижать выраженность скелетно-мышечной боли и улучшать функцию пораженных суставов доказана серией РКИ и соответствующими метаанализами [48–50]. Применение SYSADOA входит в рекомендации по лечению ОА Ассоциации ревматологов России и международной группы экспертов ESCEO [51].
Лечебный эффект медленно действующих симптоматических средств наступает не сразу: при использовании пероральных форм значимое снижение боли отмечается через 1–1,5 мес после начала приема. Анальгетический эффект SYSADOA достаточно умеренный, и в этом плане они, конечно, не могут считаться конкурентами НПВП и опиоидов. В то же время SYSADOA имеют очень важное преимущество: при длительном использовании они замедляют развитие структурных изменений суставов. Еще одно преимущество этих препаратов заключается в том, что они очень редко вызывают серьезные нежелательные явления и могут безопасно использоваться у пациентов с серьезными коморбидными заболеваниями ЖКТ и ССС. Кроме этого, на фоне длительного приема медленно действующих симптоматических средств отмечается снижение потребности в НПВП, что позволяет существенно снизить риск развития осложнений, связанных с последними [51–53].
SYSADOA с успехом применяются в комплексном лечении ОА коленных и тазобедренных суставов, суставов кистей, а в последнее время и хронической НБС, развитие которой во многих случаях определяется ОА суставов позвоночника (фасеточные суставы) и воспалительно-дегенеративными изменениями позвонков и межпозвонковых дисков [54].
НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ СКЕЛЕТНО-МЫШЕЧНОЙ БОЛИ
Физиотерапия и реабилитация рассматриваются сегодня как важнейший компонент лечения хронических БКМС, прежде всего ОА и НБС [51, 55]. Существует серьезная доказательная база эффективности и безопасности таких методик, как магнитотерапия, применение низкоинтенсивного лазерного излучения, тепловых процедур, чрескожной электронейростимуляции и др. [56]. Например, недавно Wu Z. et al. [57] представили метаанализ 12 РКИ, в которых изучалась эффективность пульсирующего магнитного поля при ОА (n=749). Магнитотерапия обеспечивала более значимое уменьшение боли, чем плацебо (ложная магнитотерапия), при ОА коленных суставов и кистей: СРС составило -0,54 (95% ДИ: от -1,04 до -0,04; p=0,03) и -2,85 (95% ДИ: от -3,65 до -2,04; p <0,00001) соответственно. При этом число нежелательных реакций на фоне использования настоящей и ложной магнитотерапии не различалось.
Все пациенты с БКМС должны заниматься лечебной физкультурой (ЛФК) и поддерживать активный двигательный режим. Это позволяет снижать выраженность биомеханических нарушений, повышать тонус и функциональную способность мышц, уменьшать риск развития метаболических расстройств [58]. Принципиально важно, что многие методики немедикаментозного лечения (в частности, магнитотерапия и ЛФК) доступны в амбулаторных условиях и могут использоваться самими пациентами в рамках «ответственного самолечения». Кроме этого, они позволяют снизить потребность пациентов с БКМС в потенциально небезопасных анальгетиках, таких как НПВП и опиоиды.
ЗАКЛЮЧЕНИЕ
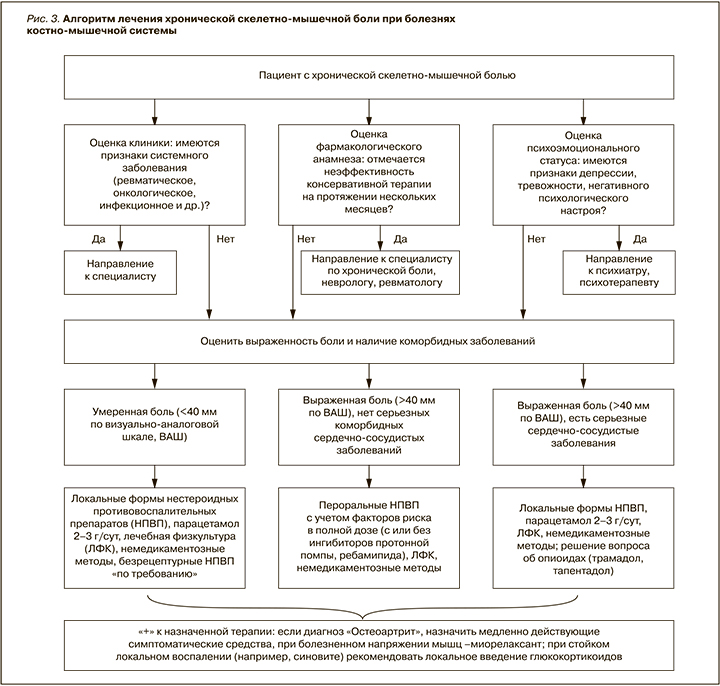
Эффективный контроль скелетно-мышечной боли – одно из главных направлений терапии БКМС. В арсенале современного практикующего врача имеется достаточно средств, чтобы решить эту задачу. Однако добиться успеха можно лишь при четком понимании механизмов развития хронической боли, точной оценке клинической ситуации, определении коморбидных заболеваний и факторов риска фармакотерапии. Результатом терапевтического анализа должна стать индивидуальная схема лечения конкретного пациента, учитывающая характер заболевая, фенотип боли, возможность и рациональность применения тех или иных фармакологических и нефармакологических методов (рис. 3).



