Разрывы сердца как осложнение острого инфаркта миокарда (ИМ) происходят в первые 1–2 нед заболевания, чаще это разрыв некротизированной стенки желудочка (обычно левого). В более поздние сроки, включая постинфарктный период, разрывы вызваны нарушением образования (консолидации) миокардиального рубца, например, при истинной аневризме либо связаны с присутствием псевдоаневризм, в том числе субэпикардиальных.
Псевдоаневризма (ложная аневризма) представляет собой неполный (локальный) разрыв эндокарда и миокарда с формированием организованного тромба и гематомы, которые вместе с адгезивным перикардом закрывают место разрыва и предотвращают, таким образом, развитие гемоперикарда. В отличие от истинной аневризмы, которая всегда частично состоит из ткани миокарда, стенки псевдоаневризмы включают организованную гематому и ткань перикарда, т.е. миокард не входит в ее состав. Образование псевдоаневризмы возможно при подостром течении разрыва. Стенки псевдоаневризмы представлены организованными тромботическими массами, эпикардом и частично перикардом. Псевдоаневризма имеет узкий вход (шейку) с характерными потоками крови через место разрыва – из полости левого желудочка (ЛЖ) в полость псевдоаневризмы и обратно [1]. Встречаются псевдоаневризмы с широкой шейкой [2, 3], полость которых со временем увеличивается, иногда превышая объем ЛЖ [3]. Застой крови в псевдоаневризме может вызывать образование тромботических масс и тромбоэмболические осложнения.
Описаны случаи разрыва свободной стенки сердца не на всю толщину, а достигающего только эпикардиального слоя и приводящего к развитию субэпикардиальной аневризмы [4]. В результате геморрагической диссекции в область инфаркта кровь проникает в миокард, вызывая расслоение, и формирует под эпикардом мешковидное образование, похожее на дивертикул. Субэпикардиальные ложные аневризмы протекают с разрывом миокарда (не всегда полным) и включают устье, узкую шейку, однако стенка субэпикардиальной аневризмы состоит из эпикарда с тонким слоем миокарда или без него [5]. Этот вид аневризм также имеет высокий потенциал разрыва в любые сроки ИМ и сопровождается развитием осложнений – застойной сердечной недостаточности, митральной регургитации, желудочковых аритмий, системных эмболий. Также в этом случае возможно формирование истинной аневризмы сердца [6].
Истинные аневризмы осложняются разрывом достаточно редко.
Таким образом, на сегодня существует информация о возможности развития при коронарной болезни, помимо истинной, еще двух типов аневризм: ложной (при разрыве трех оболочек сердца – эндокарда, миокарда, эпикарда) и субэпикардиальной, протекающей с разрывом эндомиокарда. При этом первым в большинстве случаев разрывается все же эндокард.
Детальный анализ разрывов стенки сердца при ИМ на примере 50 секционных случаев [7] показал принципиальную возможность существования в 44% сердец наряду с основным (фатальным) разрывом оболочек сердца, дополнительных микроскопических разрывов эндокарда (от одного до пяти), не проникающих в миокард и обычно локализованных вблизи основного разрыва. Некоторые из дополнительных разрывов включали недавно образовавшиеся или организующиеся тромбы. Из числа разрывов внутренних структур сердца известны отрывы (разрывы) папиллярной мышцы, межжелудочковой перегородки (МЖП) – изолированные или сочетанные, в том числе с внешними разрывами [8].
Случаи изолированного разрыва (отрыва) эндокарда у пациентов с ишемической болезнью сердца, диагностированные клинически или выявленные при патологоанатомическом исследовании, нам неизвестны.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
В этом отношении представляет интерес случай больного Б., 46 лет, работающего инвалида 3 группы, который поступил с жалобами на одышку, боль и тяжесть в правом подреберье, тошноту, вздутие живота, отек ног, желтушность кожи, сонливость. Печень выступала из-под края реберной дуги на 2 см, имела гладкую поверхность, была умеренно болезненной.
Более двух лет назад пациент перенес ИМ, находился на стационарном лечении. Эхокардиография (ЭхоКГ) на том этапе не выполнялась. После выписки из стационара Б. чувствовал себя удовлетворительно, переносимость физических нагрузок оставалась хорошей.
Ухудшение состояния наступило примерно за 2 нед до повторного обращения, когда после перенесенной ОРВИ больной отметил нарастание общей слабости и одышки, появление отеков, приступов удушья по ночам, боль в правом подреберье. Был госпитализирован в кардиологическое отделение, в котором в течение двух недель прошел обследование (см. ниже) и лечение, был выписан с улучшением в виде увеличения толерантности к физической нагрузке, с рекомендацией обращения к гастроэнтерологу в связи с появлением и нарастанием желтухи, повышением активности аминотрансфераз.
Пациент страдает гипертонической болезнью с медикаментозной компенсацией до 100–110/80 мм рт.ст.
При лабораторном и инструментальном исследовании в отделении кардиологии были выявлены:
- нейтрофильный лейкоцитоз (12,85–13,92×109/ л) при нормальном содержании количества тромбоцитов;
- протеинурия (1,60–1,75 г/л), повышение уровня креатинина (150 мкмоль/л);
- преобладание проатерогенных липидов над антиатерогенными (коэффициент атерогенности >6);
- повышение более чем в 50 раз уровня мозгового натрийуретического пептида (Pro-BNP) до 10521,0 пг/мл;
- повышение уровня D-димера (2,6 мкг/мл), снижение фибринолитической активности крови;
- небольшая гипергликемия натощак, двукратное увеличение общей креатинкиназы (КФК), 5-кратное повышение лактатдегидрогеназы (ЛДГ) при нормальных уровнях тропонина Т, МВ-КФК и миоглобина;
- снижение количества свободного тироксина (Т4; 8,9 пмоль/л), повышение тиреотропного гормона (ТТГ; 7,0 мМЕ/мл);
- повышение активности аспартатаминотрансферазы (АСТ; 243 Ед./л) и аланинаминотрансферазы (АЛТ; 450 Ед./л), уровня билирубина (40,9 мкмоль/л с наличием прямой фракции) при отсутствии маркеров вирусных гепатитов и антинуклеарных антител;
- на электрокардиограмме (ЭКГ) покоя обнаружены синусовая тахикардия, отклонение электрической оси влево, полная блокада левой ножки пучка Гиса, рубцовые изменения в миокарде переднеперегородочно-верхушечной области ЛЖ. При суточном мониторировании ЭКГ на фоне приема амиодарона выявлены синусовый ритм со средней частотой сердечных сокращений (ЧСС) 76/мин, невысокая эктопическая активность;
- по данным эхокардиографии (ЭхоКГ) установлены увеличение полостей левого предсердия и ЛЖ, гипокинез миокарда ЛЖ в целом, гипокинез средних сегментов ЛЖ (заднего, нижнего и нижнеперегородочного, переднего и переднеперегородочного) и верхушечных сегментов (переднего, перегородочного, нижнего и бокового). Также выявлены снижение глобальной сократительной способности миокарда (фракция выброса ЛЖ 42% по Тейхольц), повышенная трабекулярность ЛЖ. В полости ЛЖ на уровне нижней и средней трети визуализирована линейная гиперэхогенная, флотирующая с током крови структура, крепящаяся к боковой стенке левого желудочка, возможно, фрагмент надорванной аномально расположенной хорды (рис. 1).
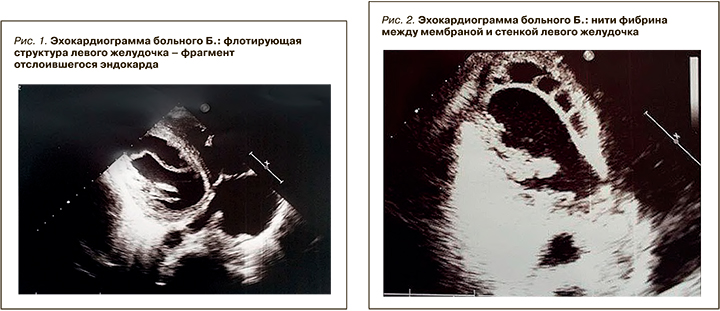
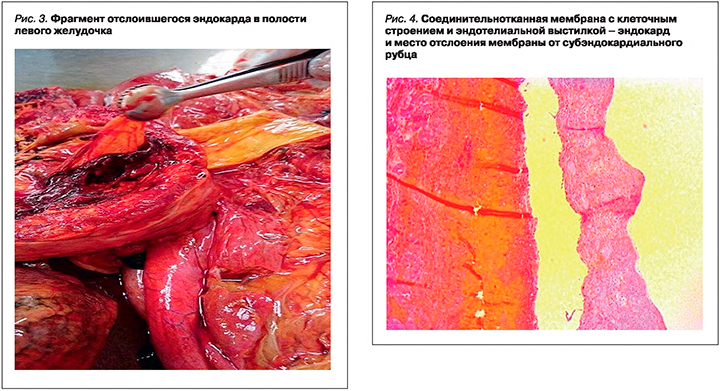
Динамическая ЭхоКГ, выполненная только через 2 нед (при госпитализации в краевую больницу), показала прогрессирующее снижение сократительной и насосной функций миокарда (фракция выброса ЛЖ снизилась до 33%), наличие акинеза миокарда в области верхушки, ее повышенную трабекулярность и неровность внутреннего контура. В полости ЛЖ ближе к верхушке определено линейное подвижное гиперэхогенное образование – мембрана с признаками небольшой перфорации и наличием незначительного кровотока в ее проекции при отсутствии общего кровотока за мембраной. Между мембраной и верхушкой лоцировались нити фибрина, ограничивающие подвижность верхушки (рис. 2). В области верхушки правого желудочка (ПЖ) за модераторным пучком определялся тромб 23×19 мм (ранее 20×15 мм) с неровным контуром. Установлено наличие легочной гипертензии (САД 56 мм рт.ст.), трикуспидальная регургитация 2–3 степени, митральная – 3 степени. Обнаружены склеротические изменения стенок и клапанов аорты, кальциноз основания задней створки митрального клапана.
О происхождении структуры в полости ЛЖ предварительно было высказано два предположения:
1) аномалия развития (дополнительный эндокард);
2) отслоившийся фрагмент эндокарда в области задней стенки/верхушки – над зоной постинфарктного рубца.
Методом контрастной мультиспиральной компьютерной томографии (МСКТ) в ЛЖ был выявлен большой дефект наполнения плотностью до 70 HU, который соответствовал отграниченному перегородкой (мембраной) от основной части желудочка скоплению жидкости (кровь без контраста), подтверждающему наличие в ЛЖ дополнительной полости и ее относительную изолированность от полости желудочка. Найдены тромбы в полости ПЖ.
После непродолжительного эпизода транзиторной артериальной гипотензии (уменьшения артериального давления со 100/80 мм рт.ст., к которому пациент был адаптирован, до 80/40 и даже до 70/40 мм рт.ст.) произошло увеличение интенсивности желтухи, вырос уровень билирубина (сначала до 86,3 мкмоль/л, затем до 125,2 мкмоль/л) с преобладанием прямой фракции, повысилась активность АСТ до 441,9 Ед./л и АЛТ до 1014,7 Ед./л, увеличилась активность щелочной фосфатазы и гамма-глутамилтрансферазы. Также повысились уровни С-реактивного белка (39,9 мг/л), креатинина (173,0 мкмоль/л), мочевины (19,8 ммоль/л), D-димера (12,52 мкг/ мл). Снизились показатели общего белка и альбумина сыворотки крови, протромбинового индекса до 67 и 55%, уровня фибриногена до 0,94 и даже до 0,6 г/л. Наметилось отчетливое снижение уровня тромбоцитов: до 112 и 96×109/л, затем до 48 и 28×109/л. При плановом обследовании был выявлен полиморфизм гена – антагониста тканевого активатора плазминогена PAI-1 (гомозигота) и полиморфизм гена тромбоцитарного рецептора к коллагену – ITGA2-α2 в гетерозиготном состоянии.
У пациента развилась гипертермия (до 38 °С и выше), появились клинические признаки печеночной энцефалопатии – заторможенность, сонливость. При аускультации живота был выслушан систолический шум. Заподозрен тромбоз (эмболия?) чревного ствола, осложненный ишемическим гепатитом. Предположение нашло подтверждение в данных аортоартериографии, при которой чревный ствол оказался окклюзирован от устья на протяжении 6 см, заполняясь дистальнее через хорошо развитые коллатерали из бассейнов верхней и нижней брыжеечных артерий. Верхняя брыжеечная артерия, отходящая от аорты, оказалась стенозирована в устье до 80% и была успешно стентирована с увеличением объемного кровотока в артерии селезенки на 100%, в печеночных артериях – на 50%.
Также был выявлен неокклюзирующий тромбоз правой внутренней яремной вены (тромб на катетере).
С учетом клинической картины и результатов лабораторного обследования диагностирован синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром). Проводилась посиндромная консервативная терапия, включающая криоплазму, применение низкомолекулярного гепарина, сердечных, мочегонных средств, антиагрегантов, препаратов для лечения печеночной недостаточности (Гептрал, Гепа-Мерц, лактулоза, антибиотики), трансфузии компонентов крови, эвакуацию геморрагического плеврального выпота.
В клинической картине у Б. стали преобладать явления эндотоксикоза, тромбогеморрагического синдрома и недостаточности функции печени при сохранении проявлений тяжелой сердечной недостаточности. По данным ультразвукового исследования (УЗИ) было отмечено уменьшение размеров печени, расцененное как проявление печеночной дистрофии ишемического генеза.
В результате больной умер при невозможности контроля артериального давления вазопрессорами и нарастающей печеночной недостаточности.
Заключительный клинический диагноз
- Основной: ишемическая болезнь сердца (ИБС): постинфарктный кардиосклероз (ИМ двухлетней давности). Мембрана полости левого желудочка (отрыв эндокарда?) с отграничением части полости желудочка и пристеночным тромбозом, тромбоз полости правого желудочка, хроническая сердечная недостаточность (ХСН) 2Б стадии, IV ФК, вторичная легочная гипертензия, двусторонний гидроторакс. Атеросклероз аорты и ее абдоминальных ветвей.
- Осложнение: окклюзия (тромбоз, эмболия?) чревного ствола, стеноз верхней брыжеечной артерии (80%). Острый ишемический гепатит с развитием тяжелой печеночной недостаточности и гепаторенального синдрома. Подострый ДВС-синдром. Тромбоз правой яремной вены. Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) со стентированием верхней брыжеечной артерии.
Основные патологоанатомические находки
1. Тонкая желтовато-белая мембрана в полости ЛЖ размером 7×3 см, отходящая от верхней трети задней стенки и прикрепляющаяся к боковой и передней стенкам (рис. 3) хордальной нитью длиной 2 см, мембрана соединяется с задней сосочковой мышцей, отделяя часть полости ЛЖ ниже хордальных нитей от верхушечной. По структуре соединительнотканная мембрана имеет клеточное строение, напоминает эндокард. Между мембраной и заднебоковой поверхностью сердца, представленной миокардом с субэндокардиально расположенной рубцовой тканью, расположены тромботические массы на участке (7×3 см), равном по площади мембране (см. рис. 3, 4).
2. Множественный пристеночный тромбоз эндокарда – на передней стенке ЛЖ, в нижней половине желудочка на МЖП. Пристеночный тромб в ушке правого предсердия с геморрагическим пропитыванием стенки, пристеночный тромбоз эндокарда задней стенки правого желудочка ближе к верхушке, пристеночный тромб на интиме аорты над устьем верхней брыжеечной артерии в проекции чревного ствола длиной 2,5 см, пристеночный тромб в правой яремной вене. Тромб в просвете микрососуда головного мозга (микроскопически).
3. Значительное расширение всех полостей сердца. Миокард передней стенки ЛЖ с субэндокардиальными белесыми прослойками (рубец) на участке 5×3,5 см; белесые прослойки в задней стенке, межжелудочковой перегородке со стороны ЛЖ на участке 6×8 см – местами по всей толще стенки (трансмурально). На остальном протяжении миокард дряблый, коричневато-желтый с толщиной до 1,6 см (ЛЖ), 0,4 см (ПЖ) и 1,5 см (МЖП). Стенки коронарных сосудов утолщены с кальцинозом в правой коронарной артерии с проходимым просветом.
4. Печень уменьшена в размерах (24×17×12×6 см), весом 1230 г (норма 1500–1700 г), с гладкой поверхностью, дряблой консистенции, на разрезе с едва заметной мелкой зернистостью желтовато-коричневого цвета с мелкими желтыми очагами под капсулой: формирующийся кардиальный фиброз печени с некрозами и фиброзированием в центрах долек.
5. Щитовидная железа не увеличена, в правой ее доле белесые прослойки, микроскопически очаги фолликулярного рака в рубце.
6. Легкие: гемосидероз, венозное полнокровие, респираторный дистресс-синдром (РДС) 4 стадии.
ОБСУЖДЕНИЕ
Таким образом, у пациента Б. имело место сочетание нескольких видов патологии, одна из которых – фрагмент эндокарда, отделенный от стенки желудочка (эктопированный эндокард), соответствующий по размеру зоне постинфарктного рубца с наличием пристеночного (под эндокардом) и распространенного внутрисердечного тромбоза. Помимо этого, наблюдались: а) тромбоз артериальных и венозных сосудов, микрососудов, включая окклюзию чревного ствола, острое ишемическое поражение печени на фоне застойного (кардиального) фиброза, клинически осложненное энцефалопатией; б) рак щитовидной железы (патологоанатомическая находка) с лабораторными проявлениями гипотиреоза; в) полиморфизмы некоторых генов тромбофилии.
Причинами заболевания Б. можно считать ранний атеросклероз с поражением коронарных сосудов и развитием обширного трансмурального ИМ за 2–3 года до настоящего события. В качестве факторов, способствующих ранней манифестации ИМ, можно предположить рак щитовидной железы (паранеопластический гиперкоагуляционный синдром) и наличие полиморфизмов генов – PAI-1 и ITGA2-α2, ответственных за снижение фибринолитической активности крови, повышение агрегации тромбоцитов и представляющих собой мультигенную форму наследственной тромбофилии с синергичной модификацией риска развития тромбоза. Наличие этих двух видов патологии могло привести к манифестации коронарного процесса около двух лет назад.
Умеренная недостаточность кровообращения в исходе перенесенного ИМ (в течение двух лет Б. продолжал работать) внезапно начала прогрессировать. Застойные явления в малом и большом кругах кровообращения увеличились, появились признаки недостаточности функции печени смешанного генеза (застойной + ишемической в результате тромбоза аорты в проекции чревного ствола, его окклюзии), что активировало тромботический процесс. Одновременная находка флотирующей структуры в ЛЖ характеризовала отрыв части эндокарда в зоне трансмурального постинфарктного рубца (задняя стенка ЛЖ) с формированием полости, частично изолированной от кровотока в ЛЖ, и процесса локального тромбообразования, клинически подтвержденного данными ЭхоКГ. В последующем тромботический процесс принял генерализованный характер.
Какова же была причина отслоения эндокарда? Что могло вызвать такое необычное осложнение?
Не исключена возможность надрыва («нефатального» разрыва) эндокарда, инициированного высоким внутрижелудочковым давлением, наличием вихревых потоков крови в проекции постинфарктного рубца ЛЖ, и дальнейшее его отслоение, которое связано с особым морфологическим состоянием субэндотелия эндокарда, его мышечно-эластического и наружного соединительнотканного слоев в краевой (пограничной) зоне бывшего ИМ, имеющей особую уязвимость, по крайней мере в острой фазе ИМ [9], и, вероятно, сохраняющейся в постинфарктном периоде, а также с качеством трансмурального постинфарктного рубца в этой области, высокой активностью локального кровотока. Причиной отрыва эндокарда могло стать избыточное натяжение хордальной нити, соединенной с задней сосочковой мышцей при дилатации полости ЛЖ.
Подобные микроразрывы эндокарда в остром периоде ИМ могут вызывать пристеночный тромбоз, что и было доказано секционными данными [8]. Отдаленные последствия таких разрывов неизвестны. Можно предположить, что недостаточная эндотелизация старых дефектов эндокарда при определенных условиях способна вызвать неконтролируемый процесс отслоения части внутренней оболочки сердца и образование субэндотелиальной/субэндокардиальной гематомы (аневризмы).
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящем наблюдении представлен один из неизвестных ранее вариантов внутреннего разрыва сердца у больного с коронарной болезнью: разрыв эндокарда с формированием расслаивающей субэндокардиальной аневризмы ЛЖ – четвертого из ранее описанных видов (наряду с истинной, ложной и субэпикардиальной) аневризм сердца.


