В настоящее время значение сердечно-сосудистых заболеваний (ССЗ) в развитии и прогрессировании морфофункциональных изменений центральной нервной системы (ЦНС) не вызывает сомнений. Опубликовано довольно большое количество работ, посвященных изучению связи таких заболеваний и состояний, как фибрилляция предсердий (ФП), артериальная гипертония (АГ), клапанные пороки, с когнитивными расстройствами [1–5].
Воздействие сердечно-сосудистой патологии на ЦНС многогранно. Так, в качестве одного из патологических механизмов в генезе когнитивных нарушений при ССЗ, в особенности при АГ, выделяют лейкоареоз – разобщение связей лобных долей с другими отделами головного мозга (ГМ) в результате диффузных изменений белого вещества, возникающее, в частности, на фоне снижения перфузии вещества ГМ [6]. Лобные доли, как известно, отвечают за регуляцию произвольной деятельности и обеспечивают переключаемость и устойчивость внимания, адекватность поведенческих реакций. Таким образом, патология лобных отделов коры приводит к нарушению исполнительного контроля и развитию в данном случае «регуляторных» когнитивных нарушений. Среди наиболее вероятных патофизиологических механизмов связи ФП и когнитивных расстройств, помимо широко известных острых нарушений мозгового кровообращения вследствие церебральных тромбоэмболий, выделяют также «немые» микротромбоэмболические ишемии и гипоперфузию ГМ в результате колебания сердечного выброса [7].
Что касается негативного влияния ХСН на ЦНС, то здесь, как правило, главным патогенетическим фактором считают снижение сердечного выброса, способное приводить к церебральной гипоперфузии. Возможным звеном патогенеза является также возникающее при миокардиальной дисфункции повышение давления в венозной системе, вызывающее переполнение интракраниальных венозных синусов и яремных вен. Итогом этого может быть нарушение абсорбции цереброспинальной жидкости и ее накопление в субарахноидальном пространстве, мозговых цистернах (наружная гидроцефалия) и иногда в мозговых желудочках (внутренняя гидроцефалия). Это, в свою очередь, также нарушает перфузию ГМ. Следующей причиной развития когнитивной дисфункции у пациентов с ХСН пациентов может выступать повышенный уровень тромбин-антитромбинового комплекса, бета-тромбоглобулина и D-димера, что способствует состоянию гиперкоагуляции [8] и последующей микроэмболии сосудов ГМ, в особенности на фоне дилатации полостей сердца [9–10].
Ранее нами был проведен ряд пилотных исследований, посвященных изучению проблемы возникновения и прогрессирования когнитивной дисфункции у пациентов с сердечно-сосудистой патологией; при их выполнении обращали на себя внимание редкие и слабые корреляции величины фракции выброса левого желудочка (ФВ ЛЖ) с показателями когнитивных тестов [11–14]. В свете вышеизложенного представляется своевременным и актуальным определение значимости наиболее часто используемых в современных классификациях признаков тяжести ХСН, таких как функциональный класс (ФК) и ФВ ЛЖ, в качестве маркеров когнитивной дисфункции.
Цель исследования – изучить значение величины ФВ ЛЖ и ФК ХСН как потенциальных маркеров и предикторов развития морфофункциональных расстройств ЦНС у пациентов с ХСН ишемического генеза.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось в соответствии с принципами надлежащей клинической практики и было одобрено локальным этическим комитетом.
Критериями включения в исследование служили наличие у пациентов ХСН, возникшей на фоне подтвержденной ишемической болезни сердца (ИБС); возраст не старше 65 лет; применение ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов рецепторов ангиотензина II и бета-адреноблокаторов в стабильной дозе в течение четырех недель до включения в исследование.
 В исследование не включали больных, у которых наблюдались острые или подострые формы ИБС; сахарный диабет; острое нарушение мозгового кровообращения (в том числе и в анамнезе); атеросклеротические бляшки брахиоцефальных артерий, приводящие к развитию гемодинамически значимых стенозов (сужение более 50% просвета артерии), по данным дуплексного исследования сосудов; признаки деменции по шкале Mini Mental Score Examination (MMSE); злоупотребление алкоголем; прием в течение 90 дней до включения пациента в исследование нейрометаболических, нейротрофических препаратов, а также каких-либо иных веществ, способных прямо или косвенно повлиять на когнитивные функции пациентов; миокардиты; нарушения функции щитовидной железы; выраженные клапанные пороки, лабораторные признаки выраженного нарушения функций печени и почек; другие соматические заболевания, которые способны быть самостоятельной причиной развития когнитивных нарушений; противопоказания к ядерно-магнитной резонансной томографии (ЯМРТ). Выбор таких критериев исключения был обусловлен необходимостью максимально исключить все возможные заболевания и состояния, способные привести к нарушению структуры и функции ГМ.
В исследование не включали больных, у которых наблюдались острые или подострые формы ИБС; сахарный диабет; острое нарушение мозгового кровообращения (в том числе и в анамнезе); атеросклеротические бляшки брахиоцефальных артерий, приводящие к развитию гемодинамически значимых стенозов (сужение более 50% просвета артерии), по данным дуплексного исследования сосудов; признаки деменции по шкале Mini Mental Score Examination (MMSE); злоупотребление алкоголем; прием в течение 90 дней до включения пациента в исследование нейрометаболических, нейротрофических препаратов, а также каких-либо иных веществ, способных прямо или косвенно повлиять на когнитивные функции пациентов; миокардиты; нарушения функции щитовидной железы; выраженные клапанные пороки, лабораторные признаки выраженного нарушения функций печени и почек; другие соматические заболевания, которые способны быть самостоятельной причиной развития когнитивных нарушений; противопоказания к ядерно-магнитной резонансной томографии (ЯМРТ). Выбор таких критериев исключения был обусловлен необходимостью максимально исключить все возможные заболевания и состояния, способные привести к нарушению структуры и функции ГМ.
Данные анамнеза и клинического осмотра пациентов заносились в формализованную историю болезни. Все исследования проводились в утренние часы, после процедуры подписания информированного согласия. В итоге в исследование были включены 54 пациента (табл. 1).
Кроме общеклинического обследования, пациентам проводили допплерэхокардиографию (ДЭхоКГ) с оценкой следующих характеристик: конечного систолического размера левого предсердия (КСР ЛП), конечного диастолического размера левого желудочка (КДР ЛЖ) и конечного диастолического размера правого желудочка (КДР ПЖ).
Верификация ИБС проводилась посредством клинического анализа анамнеза (учитывались информация о наличии перенесенного инфаркта миокарда и/или данные коронароангиографии).
Для оценки морфологического состояния ГМ пациентов с помощью аппарата PHILIPS ACHIEVE 1,5 Tl применяли ЯМРТ ГМ. Измеряли толщину серого вещества в затылочном, лобном, теменном, височном отделах ГМ, размеры желудочков мозга (толщину третьего желудочка и передних, задних и височных рогов боковых желудочков ГМ), а также объемы правого и левого гиппокампов – части лимбической системы ГМ, участвующей в механизмах формирования эмоций и консолидации памяти. Состояние белого вещества ГМ косвенно определялось при измерении толщины средних ножек мозжечка. Дополнительно к стандартной диффузионно-взвешенной методике визуализации ГМ посредством ЯМРТ проводили вычисление коэффициента диффузии (КД) молекул воды в сером и белом веществе затылочного, лобного, теменного, височного отделов и в гиппокампах. Как известно, диффузионно-взвешенная МРТ помогает количественно измерить броуновское движение водяных молекул во внутриклеточном и внеклеточном пространстве и непосредственно саму диффузию (т.е. прохождение молекул воды сквозь мембраны клеток). Под воздействием некоторых заболеваний (как собственно ГМ, так и экстрацеребральных) диффузионные процессы могут изменяться, возникает их ускорение или, напротив, замедление. Показателем данного изменения служит вычисляемый коэффициент диффузионных процессов. При его изменениях можно делать выводы о возникновении первых признаков структурных нарушений в органах еще до появления в них макроморфологических изменений [15].
Когнитивные функции в исследовании оценивались с применением вербального и невербального субтестов Векслера (5-й и 7-й варианты), корректурной пробы Бурдона. Для исключения деменции использовали шкалу MMSE – краткую шкалу оценки психического статуса.
Статистический анализ выполнялся с помощью программы Statistica 8.0. Для количественных переменных определялось среднее значение ± стандартное отклонение, а также использовался t-критерий Стьюдента для независимых выборок. Категориальные переменные сравнивались с помощью критерия хи-квадрат (χ2) или точного критерия Фишера. Связь между функциональными и морфологическими изменениями ГМ и ФВ ЛЖ, ФК ХСН оценивалась посредством непараметрической корреляции (критерий Кендалла) и канонического анализа. В качестве показателя статистической значимости принималось значение р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
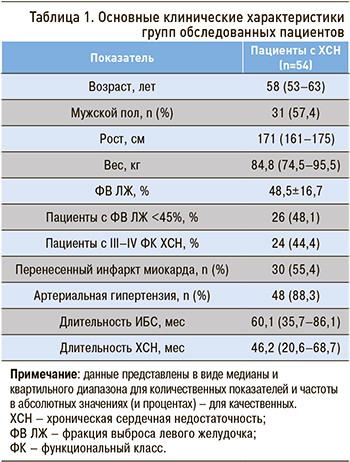
Влияние ХСН на «субстрат» интеллекта представляется возможным уточнить при исследовании взаимосвязи тяжести этого заболевания и состояния серого вещества ГМ. Нами были рассчитаны средние результаты когнитивных тестов и показателей ЯМРТ серого вещества ГМ отдельно для пациентов со II и III–IV ФК ХСН (табл. 2).
Согласно данным, представленным в таблице 2, значимое снижение результатов когнитивных субтестов Векслера (5-й и 7-й варианты), меньшая толщина серого вещества теменных долей и меньший объем правого гиппокампа отмечаются у пациентов с III–IV ФК ХСН. Это подтверждает значимость ФК в оценке степени выраженности церебральных расстройств, обусловленных ХСН. Представляется логичным объяснение, что более выраженная ХСН может привести более тяжелому ухудшению мозгового кровотока, которое, в свою очередь, приводит к последующему формированию атрофии коры ГМ. Очевидно, что последнее вносит немаловажный вклад в снижение когнитивных способностей. В некотором роде результаты нашего исследования согласуются с данными, полученными Mueller K. et al., которые описали снижение толщины серого вещества в лобной и теменной областях у пациентов с более высоким ФК ХСН [16]. Кроме того, в 2015 г. были опубликованы результаты работы группы американских исследователей, в которой у пациентов с ХСН толщина серого вещества лобных, теменных, височных и затылочных долей оказалась значительно ниже, чем у участников группы контроля [17].
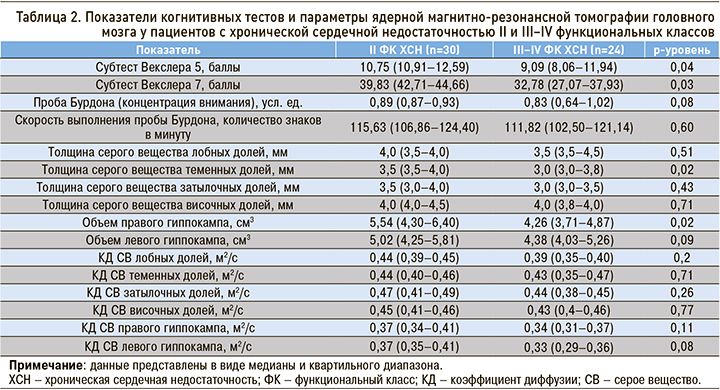
Сравнительный анализ изменений показателей состояния ЦНС у пациентов с ХСН с относительно сохранной систолической функцией (ФВ ≥45%) и у больных ХСН со сниженной систолической функцией, достоверных отличий не выявил (табл. 3).
При изучении значимости отличий показателей когнитивных тестов и параметров ЯМРТ ГМ у больных ХСН с ФВ ≤35% и с ФВ>35% были получены схожие данные.
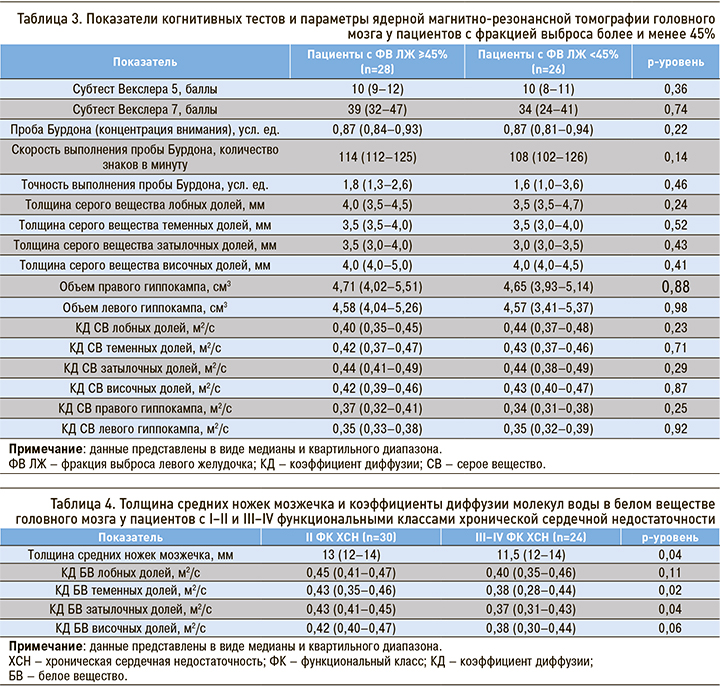
Были рассчитаны медианы и квартили толщины средних ножек мозжечка и КД молекул воды в белом веществе ГМ отдельно для пациентов со II и III–IV ФК ХСН. В результате был получен ряд достоверных отличий (табл. 4).
Меньшие КД молекул воды в белом веществе теменных и затылочных долей и меньшая толщина средних ножек мозжечка были выявлены в группе пациентов с III–IV ФК ХСН.
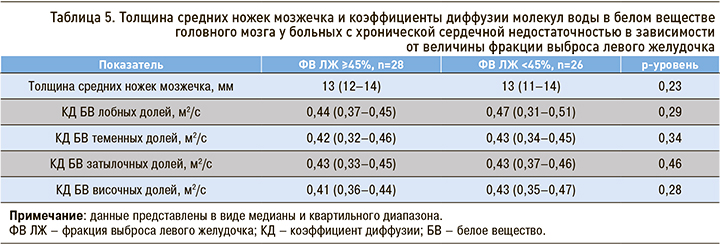
При сравнительном анализе толщины средних ножек мозжечка и КД молекул воды в белом веществе ГМ у пациентов, имеющих ФВ ЛЖ ≥45%, и у пациентов с ФВ <45% достоверных отличий установлено не было (табл. 5).
Определенное нами снижение толщины средних ножек мозжечка, ассоциированное с нарастанием тяжести ХСН, может свидетельствовать о наличии некоторой степени атрофии белого вещества, опосредованной ХСН. Вероятно, эта атрофия, связанная с уменьшением числа нервных волокон и увеличением межволоконных пространств, приводит к облегчению диффузии молекул воды в этих пространствах и увеличению скорости молекул. Кроме того, под действием гипоперфузии происходит нарушение целостности гематоэнцефалического барьера, а также экстравазация компонентов плазмы в сосудистую стенку и прилегающие области мозга с развитием периваскулярного отека и активацией микроглии. Помимо этого, как уже упоминалось выше, у пациентов с ХСН может отмечаться развитие периваскулярного вазогенного отека из-за нарушения внутрикраниального венозного оттока при правожелудочковой сердечной недостаточности и стабильно прогрессирующей гиперактивации ренин-ангиотензин-альдостероновой системы, вызывающей среди прочего увеличение проницаемости сосудистой стенки [18–19].
Следовательно, периваскулярный отек может выступать важным фактором развития патологии белого вещества при ХСН. Это предположение в некоторой степени подтверждается и данными проведенного нами корреляционного анализа параметров, характеризующих ХСН, и косвенных показателей внутричерепной гипертензии. Так, нами были установлены средней силы связи между размером задних рогов боковых желудочков ГМ и КДО ЛЖ (R=0,33), КСР ЛП (R=0,42), КДР ПЖ (R=0,46), КСР ПП (R=0,51), ФК ХСН (R=0,39), а также между размерами височных рогов боковых желудочков ГМ и ФК ХСН (R=0,37). В целом, это указывает на нарастание размеров боковых желудочков ГМ при увеличении размеров полостей сердца и прогрессировании ФК ХСН, что, в свою очередь, может свидетельствовать о гидроцефальных церебральных явлениях, развитию которых способствует сердечная недостаточность.
ЗАКЛЮЧЕНИЕ
В целом результаты нашего исследования показали, что величина ФВ ЛЖ при всей своей большой прогностической значимости является параметром, отражающим степень систолической дисфункции, но не всегда коррелирующим с клиническими проявлениями ХСН и обусловленными ею расстройствами органов и систем организма. Вероятно, ФК ХСН следует рассматривать как более точный маркер когнитивной дисфункции и патологических изменений ГМ. Это можно объяснить тем, что, наряду с оценкой клинической тяжести ХСН, ФК позволяет в некоторой степени оценить состояние периферического звена системы кровообращения и степень компенсации нарушения насосной функции.
Поскольку статистически значимых отличий показателей функциональных и морфологических изменений ГМ среди пациентов со сниженной и средней/сохранной ФВ ЛЖ выявлено не было, можно заключить, что клинические проявления ХСН и их выраженность служат более надежными маркерами когнитивных нарушений и структурных изменений ЦНС у пациентов с коронарной болезнью сердца, чем инструментальная оценка систолической дисфункции сердца. Очевидно, что в дальнейшем целесообразно проведение более масштабных (в том числе морфологических) исследований для уточнения результатов данной работы.



