По современным представлениям, неблагоприятные сердечно-сосудистые исходы ассоциированы не только с высокими цифрами артериального давления (АД), но и низкими [1, 2]. Особый интерес представляет падение АД, сопровождающееся нарушением самочувствия. Очевидно, что симптомные эпизоды гипотонии (СЭГ) выступают проявлением значимого нарушения кровотока жизненно важных органов. Причины, патогенез и клиническое значение подобных эпизодов на настоящее время до конца не ясны [3].
Эпизоды существенного снижения АД, вероятно, являются элементами вариабельности этого параметра. В настоящее время наиболее изучена транзиторная гипотония, зафиксированная при помощи суточного мониторирования АД (СМАД), что можно рассматривать как проявление краткосрочной вариабельности АД. В то же время имеются неоднозначные данные о прогностической значимости суточной вариабельности АД [4, 5]. Остается также неясным, выступают ли СЭГ самостоятельным неблагоприятным фактором, возникают ли на фоне функциональных особенностей или же отражают тяжесть поражения органов-мишеней при артериальной гипертонии (АГ).
Цель исследования – изучить взаимосвязь СЭГ и параметров суточного профиля АД по данным СМАД у пациентов с АГ в зависимости от наличия поражения органов мишеней.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 69 пациентов с АГ в возрасте от 40 до 80 лет. Все они подписали информированное согласие перед вступлением в исследование. Основными критериями исключения служили наличие любой формы мерцательной аритмии, сниженной фракции выброса левого желудочка (менее 40%), блокады сердца 2 и 3 степени, острого инфаркта миокарда и/или инсульта, вторичной АГ, деменции, инсульта, соответствующего 4–5 баллам по модифицированной шкале Рэнкина, других тяжелых заболеваний, способных повлиять на АД. Протокол исследования был одобрен локальным Этическим комитетом.
В ходе беседы с пациентами, анализа медицинской документации были собраны демографические данные, информация об имеющихся факторах кардиоваскулярного риска и сердечно-сосудистых заболеваниях. При этом учитывалось наличие в анамнезе инфаркта миокарда и ишемического инсульта. Эти состояния анализировались как компоненты комбинированного сердечно-сосудистого события для увеличения статистической мощности исследования. Также учитывались группы антигипертензивных препаратов, принимаемых пациентами.
Всем участникам проводилось СМАД с использованием суточного регистратора АД BR-102 plus (SсhillerAG, Швейцария). Технические характеристики прибора позволяют регистрировать АД аускультативным и осциллометрическим методом. При анализе принимались во внимание средние значения систолического (САД) и диастолического АД (ДАД), частоты сердечных сокращений (ЧСС), минимальные значения этих показателей, вариабельность АД, подсчитанная как стандартное отклонение от среднего. Верхними допустимыми пределами вариабельности АД приняты значения 15/15 мм рт.ст. для систолического АД и 14/12 мм рт.ст. для диастолического (день/ночь) [6]. Также определялось среднее АД с использованием формулы: АД ср. = ДАД + (САД – ДАД)/3. Для определения периода сна использовался метод индивидуального определения времени сна и бодрствования на основании дневников пациентов [7].
Для выявления пациентов, страдающих СЭГ, применялся разработанный авторами опросник, включавший вопросы о наличии этого состояния, его частоте, уровне АД и клинических проявлениях. Под СЭГ подразумевались эпизоды падения АД не менее чем на 15% ниже индивидуальных средних значений, зафиксированные пациентом ранее при самостоятельном измерении в домашних условиях и сопровождающиеся значимым ухудшением самочувствия (головокружением, выраженной общей слабостью, головной болью, неприятными ощущениями в области сердца), которые возникали не реже одного раза в 3 мес и не были связаны с какими-либо очевидными причинами (травмами, обезвоживанием, передозировкой лекарств и т.п.). Чтобы выделить пациентов, страдающих СЭГ, мы выбрали ретроспективную оценку по данным опросника, а не фиксацию эпизодов гипотонии по результатам СМАД.
Нами были выделены группы участников исследования без инфарктов миокарда и/или инсультов в анамнезе (условно мы назвали эту часть исследуемых пациентами с неосложненной АГ) и участников, перенесших кардио- и цереброваскулярные события (пациенты с осложненной АГ).
У 3 из 69 пациентов, подписавших информированное согласие, результаты СМАД оказались не пригодными для корректного исследования. Таким образом, мы отобрали 66 участников. Средний возраст изучаемой выборки составил 66,5±8,8 лет, 29 (43,9%) исследуемых были мужчинами, 37 (56,1%) женщинами. 24 пациента имели кардио- и цереброваскулярные события (инфаркт миокарда и/или инсульт) в анамнезе, у 42 наблюдалась неосложненная АГ.
Статистическая обработка материала выполнялась с помощью программ Excel (пакет программ Microsoft Office 2003–2016) и Statisticа 10.0 (Statsoft Inc., США). Использовались стандартные методы описательной статистики – вычисление средних и стандартных отклонений для количественных переменных с нормальным распределением. Для предварительной оценки взаимосвязей применялся корреляционный анализ с расчетом коэффициента Gamma. Для сопоставления средних значений прибегали к дисперсионному анализу. Сопоставление частотных показателей проводилось на основании метода кросстабуляции и критерия Pearson Chi-square. Различия и взаимосвязи считались статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Основные характеристики групп обследуемых представлены в таблице 1.

Из 66 больных СЭГ отмечались у 40(%) обследованных. Среди 42 пациентов с НАГ эти явления наблюдались у 22 (52,4%), в подгруппе с ОАГ– в 18 (75%) случаях из 24 (p=0,05).
В ходе исследования обнаружена значимая (p <0,05) взаимосвязь наличия СЭГ и некоторых учитываемых параметров СМАД. Результаты СМАД представлены в таблице 2.
Пациенты с СЭГ отличались по уровню вариабельности дневного САД в подгруппах с осложненной и неосложненной АГ.
Среди больных с неосложненной АГ без СЭГ (рис. 1) высокая вариабельность дневного САД отмечалась в 80% случаев и в среднем составила 16,3 мм рт.ст. При наличии СЭГ вариабельность АД была достоверно ниже (14,3 мм рт.ст.), и доля участников с вариабельностью АД, превышающей норму, оказалась меньше – 36% (p <0,05).

При осложненной АГ наблюдалась противоположная тенденция: наличие СЭГ ассоциировалось с повышенной вариабельностью как дневного (18,0 мм рт.ст.), так и ночного (14,5 мм рт.ст.) САД (p <0,05). При отсутствии СЭГ показатели вариабельности АД не отклонялись от нормы. Также в группе с сочетанием осложненной АГ и СЭГ большее количество испытуемых отличались вариабельностью АД, превышающей верхнюю границу нормы (рис. 2).
В группе пациентов с неосложненной АГ и СЭГ снижение колебаний АД проявилось относительно высоким уровнем минимального дневного САД по сравнению с лицами без СЭГ (p=0,03).
При осложненной АГ и СЭГ минимальное САД в течение также было выше, чем в отсутствие СЭГ. В отношении минимального уровня ДАД наблюдалась противоположная закономерность (p <0,05).
Во всех подгруппах исследуемых ЧСС в ночные часы было достоверно ниже у лиц, имеющих СЭГ (p <0,05).
Наряду с прочим нами оценивался уровень среднего АД как основного показателя перфузии жизненно важных органов. Во всех подгруппах при наличии СЭГ этот показатель оказался ниже, чем при его отсутствии. Относительно низкое среднее АД было ассоциировано с более высокими показателями пульсового АД (табл. 3).
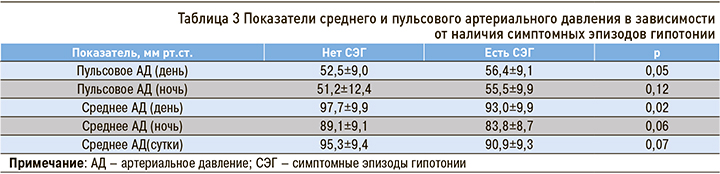
В случае дневных показателей среднего и пульсового АД различия были достоверны.
В группе пациентов с осложненной АГ и СЭГ минимальные показатели среднего АД в течение ночи находились на субнормальном уровне (66,9 мм рт.ст.); у лиц, не испытывающих СЭГ, среднее АД оставалось в пределах нормального диапазона (>65 мм рт.ст.) [8].
Для объяснения возможных причин различий в уровнях ЧСС и АД учитывались группы кардиоваскулярных препаратов, принимаемых пациентам. Значимых различий в антигипертензивной терапии выявлено не было, однако пациенты с наличием в анамнезе инфаркта или инсульта чаще принимали статины и антиагреганты (p <0,05).
ОБСУЖДЕНИЕ
Исследуемые выборки существенно не отличались по возрасту и полу, что делает их в достаточной мере сопоставимыми. Закономерно, что среди пациентов, имеющих в анамнезе кардио- и цереброваскулярные события, чаще наблюдались стенокардия напряжения и признаки ХСН. Также у них несколько чаще встречался сахарный диабет. Частота случаев СЭГ среди обследованных принципиально соответствовала таковой в более крупных выборках [9]. Полученные данные еще раз подтверждают, что транзиторная гипотония – весьма частое явление среди типичных пациентов с АГ.
Неблагоприятная роль повышенной вариабельности АД хорошо известна [10, 11], равно как и негативное значение гипотензии. Хорошо изучено негативное влияние ортостатической, постпрандиальной гипотонии в отношении развития инсульта, кардиоваскулярных событий, течения хронической болезни почек [12, 13]. Однако в большинстве работ не учитывалось наличие симптомов при колебаниях АД и, в частности, во время эпизодов гипотонии. В данном исследовании предпринята попытка изучить взаимосвязь эпизодов именно симптомной гипотензии и суточной вариабельности АД, а также попытаться проанализировать их ассоциацию с перенесенными кардиоваскулярными событиями.
В группе пациентов с неосложненной АГ получены несколько неожиданные результаты: более выраженные колебания АД по данным СМАД не сопровождались неприятными субъективными ощущениями при значимой гипотензии. И наоборот, симптомы возникали у лиц с менее значительными колебаниями АД.
Очевидно, что субъективное восприятие колебаний АД связано нарушениями механизмов ауторегуляции кровотока в жизненно важных органах, особенно в головном мозге [14]. Известно, что мозговой кровоток обладает высокой способностью к ауторегуляции. При этом установлены как нижний, так и верхний порог ауторегуляции (среднее АД от 65–70 до 140 мм рт. ст.) [8]. Границы колебаний АД, не изменяющих перфузии и соответственно самочувствия, отражают состояние органов-мишеней и регуляторных механизмов. При прогрессировании сосудистой патологии (АГ, атеросклероза) происходит структурное ремоделирование сосудов, что, в свою очередь, влечет за собой сужение границ ауторегуляции кровотока. В этих условиях, вероятно, даже незначительные колебания АД могут привести к снижению циркуляции крови в органах и нарушению самочувствия больного (СЭГ).
Следовательно, в отношении пациентов с неосложненной АГ может быть справедливым следующее предположение: повышенная вариабельность АД и относительно низкое минимальное САД в подгруппе без нарушения самочувствия является индикатором сохранной ауторегуляции кровотока в жизненно важных органах. У пациентов с СЭГ в течение суток АД было в среднем более устойчиво, однако значения среднего АД, наиболее важного для оценки перфузии, было наименьшими. Последнее, вероятно, было одной из ведущих предпосылок к СЭГ на фоне измененного порога ауторегуляции и даже небольших колебаний АД.
У пациентов же с осложненной АГ и СЭГ, по всей видимости, уже имеется значительное расстройство механизмов ауторегуляции кровотока. Выраженные колебания АД (дневная вариабельность САД 18,0 мм рт.ст.) сопровождаются значимым нарушением кровотока в органах, что, в частности, проявляется СЭГ. Как известно, высокая вариабельность АД у этой категории пациентов обусловлена структурными изменениями в сосудах, головном мозге и сердце, что приводит к нарушению автономных, центральных и рефлекторных механизмов регуляции АД. Ранее установлена взаимосвязь вариабельности АД и маркеров атеросклероза стенозом коронарных артерий [15]. Очевидно, что при этом больные с осложненной АГ имеют более ограниченные возможности для сохранения постоянства кровотока в жизненно важных органах при колебаниях АД.
Таким образом, повышенная вариабельность АД, рассматриваемая в литературе как фактор риска кардиоваскулярных событий, при неосложненной АГ, возможно, должна оцениваться в совокупности с клиническими симптомами, сопровождающими колебания АД. И весьма вероятно, что бессимптомные падения АД свидетельствуют о сохранных механизмах ауторегуляции кровотока жизненно важных органов.
Появление СЭГ при неосложненной АГ может рассматриваться как прогностически неблагоприятный фактор. Такое заключение в определенной мере соответствует результатам наших предыдущих исследований, где было выявлено, что наличие частых СЭГ можно считать предиктором первично возникших инфарктов и инсультов [9].
Учитывая клинические проявления отклонений АД от средних значений, допустимо предположить, что зависимость кардиоваскулярных исходов от вариабельности АД не является линейной. Причины и прогностическое значение вариабельности АД при осложненной и неосложненной АГ, вероятно, отличаются. Не исключено, что именно этим объясняется неоднозначность данных о влиянии суточной вариабельности АД на кардиоваскулярные исходы, полученных в крупных метаанализах [4, 5].
Вне зависимости от наличия в анамнезе инфаркта и/или инсульта, пациенты с СЭГ отличались более высоким уровнем пульсового АД в течение дня и сравнительно более низкими показателями среднего АД. Пульсовое АД характеризует степень прессорного воздействий на органы-мишени, связано с жесткостью сосудистой стенки и выступает независимым фактором риска сердечно-сосудистых исходов. У наших пациентов как с СЭГ, так и без них уровень пульсового АД превышал верхнюю границу нормы, однако среди исследуемых с СЭГ этот уровень был достоверно выше. Представляется, что данное наблюдение также подтверждает гипотезу о неблагоприятном прогностическом значении СЭГ, зависимости этого феномена от состояния сосудистой стенки и нарушений ауторегуляции кровотока.
Говоря о среднем АД, необходимо отметить, что у всех участников исследования этот показатель не выходил за пределы нормы, однако, у больных с СЭГ в среднем был относительно низким. Среднее АД еще называют «перфузионным давлением». Сохранение постоянства кровотока в органах-мишенях поддерживается при достаточно широком диапазоне значений среднего АД – от 65 до 140 мм рт.ст., но вместе с тем эти значения могут быть весьма индивидуальны. У наших пациентов с СЭГ среднее АД оказалось значимо ниже, чем у исследуемых без СЭГ при приблизительно равном САД. Не исключено, что относительно более низкие уровни среднего АД могут указывать на большую чувствительность кровотока в жизненно важных органах к транзиторной гипотонии.
Наше исследование показало, что отличия профиля суточного уровня АД в изучаемых группах не могут быть полностью объяснены влиянием фармакотерапии, так как значимого различия в применяемых группах антигипертензивных препаратов выявлено не было.
Таким образом, важным результатом нашего исследования стало, что СЭГ – это достаточно частые явления, особым образом ассоциированные с вариабельностью АД в зависимости от наличия перенесенных сердечно-сосудистых катастроф. Наши предположения о патофизиологических основах выявленных взаимосвязей носят лишь гипотетический характер и могут служить лишь одним из возможных объяснений обнаруженных закономерностей. Более полные ответы на поставленные вопросы могут быть получены в ходе крупных проспективных исследований.
ЗАКЛЮЧЕНИЕ
Более половины пациентов с АГ отмечают у себя СЭГ, которые не однонаправленно связаны с вариабельностью АД; характер этой взаимосвязи зависит от наличия перенесенных кардиоваскулярных катастроф.
Среди пациентов без инфарктов или инсультов в анамнезе, страдающих СЭГ, уровень вариабельности дневного САД ниже, чем при отсутствии СЭГ. Напротив, для пациентов с сердечно-сосудистыми событиями в анамнезе и СЭГ вариабельность дневного САД превышала норму и была больше, чем в отсутствие СЭГ.
Вне зависимости от наличия перенесенных кардиоваскулярных катастроф, пациенты, страдающие СЭГ, отличались более низкими показателями среднего дневного АД, а также повышенным пульсовым АД.
Полученные данные могут быть подтверждением неблагоприятного прогностического значения СЭГ и позволяют выдвинуть гипотезу, что нарушение самочувствия при эпизодах гипотонии зависит от нарушения механизмов ауторегуляции органного кровотока и повышенной ригидности сосудистой стенки.


