С 2014 г. 13 октября отмечается Всемирный день тромбоза. В этот день в 1821 г. родился Рудольф Вирхов (Rudolf Virchow) – классик патофизиологии тромбоза, автор труда «Тромбоз и эмболия», в котором представлен новаторский для своего времени и актуальный до сих пор взгляд на процесс тромбообразования – «Вирховская триада» [1]. По Вирхову, нарушение состава крови служит пусковым фактором тромбоза, а изменения кровотока и сосудистой стенки – способствующими ему факторами [2].
Тромбоз – распространенная, склонная к рецидивированию патология, лежащая в основе многих заболеваний, в том числе ишемической болезни сердца, ишемического инсульта и венозной тромбоэмболии (ВТЭ), под которой понимают тромбоз глубоких вен (ТГВ) и/или легочную эмболию (ЛЭ). Проблема тромбоза актуализирована масштабными эпидемиологическими исследованиями. Число пациентов с ВТЭ ежегодно достигает 10 млн во всем мире [3, 4]. При этом осведомленность мировой общественности об эмболии легочной артерии (54%) и ТГВ (44%) значительно ниже, чем о сердечном приступе (88%) и инсульте (85%) [5].
Систематический обзор литературы о глобальном бремени ВТЭ в странах Западной Европы, Северной Америки, Австралии и на юге Латинской Америки (Аргентина) продемонстрировал устойчивую вариабельность ежегодных показателей заболеваемости от 0,75 до 2,69 на 1000 населения с увеличением до 2–7 на 1000 у пожилых людей (старше 70 лет). В то же время относительно ЛЭ в параллельных, продольных исследованиях выявлена тенденция роста ежегодных показателей заболеваемости [4, 5]. Связанная с ВТЭ госпитализация была основной причиной потери лет жизни с поправкой на инвалидность (DALYs) в странах с низким и средним доходом и второй по частоте причиной в странах с высоким уровнем дохода, превосходя потери DALYs от госпитальной пневмонии, катетер-ассоциированных инфекций и побочных эффектов лекарственной терапии [1].
Исследование глобального бремени болезней, травм и факторов риска (GBD, 2010) показало, что четверть смертей от всех причин в 2010 г. были обусловлены тромботическими событиями, но не предоставило данных о ВТЭ как причине смерти и инвалидности [3]. Тем не менее известно, что в США от ВТЭ погибает от 100 до 300 тыс. человек в год [6], в Европе этот показатель составляет 544 тыс. [7]. В целом выживаемость после ВТЭ хуже, чем ожидалось, а выживаемость после ЛЭ намного хуже, чем после одного только ТГВ [8]. Риск ранней смерти при ЛЭ в 18 раз выше по сравнению с изолированным ТГВ [9]. Глобальная тенденция в области тромбоз-ассоциированных состояний выглядит как возрастание заболеваемости (в ряде случаев за счет гипердиагностики ЛЭ) параллельно со снижением смертности за последние 15 лет [10].
Современные представления о тромбозе значительно расширились. В частности, стали известны факторы риска тромбообразования: возраст более 40 лет; травмы и переломы нижних конечностей, ожирение, беременность и послеродовой период, прием оральных контрацептивов и гормональная терапия, варикозное расширение вен, онкологические заболевания, тяжелые заболевания легких, обезвоживание, длительная иммобилизация или пребывание в вынужденном положении, в том числе в связи с длительными путешествиями, острые и хронические инфекции, сепсис, генетическая предрасположенность и хроническая сердечная недостаточность [3–5, 11]. Выявлены также независимые предикторы снижения ранней выживаемости после ЛЭ, которые включают пожилой возраст, мужской пол, сниженный индекс массы тела, пребывание в стационаре на момент развития осложнения, застойную сердечную недостаточность, хроническую болезнь легких, тяжелое неврологическое заболевание и активный рак [12].
Антикоагулянтные лекарственные средства, снижающие свертываемость крови, издавна применялись для лечения тромбозов, а теперь и для профилактики их развития в группах риска. Существует мнение, что внедрение и широкое использование более эффективных методов профилактики и более тщательное соблюдение рекомендаций могут оказать положительное влияние на заболеваемость и прогноз [13]. В настоящее время с этой целью в различных клинических ситуациях используют нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ), антагонисты витамина К (АВК), а также ингибиторы факторов свертывания – прямые ингибиторы тромбина и селективные ингибиторы Xa-фактора, или так называемые прямые оральные антикоагулянты (ПОАК).
Последовательность появления антикоагулянтов на арене борьбы за жизнь отражает историю создания и внедрения в практику фармакологических новаций, обладающих очевидными преимуществами в эффективности, безопасности и комфортности применения как при тромбозах, так и тромбоэмболиях. В таблицах 1–3 кратко представлены этапы эволюции профилактики инсульта и системных эмболий у больных фибрилляцией предсердий (ФП), а также профилактики и лечения венозных тромбоэмболий.
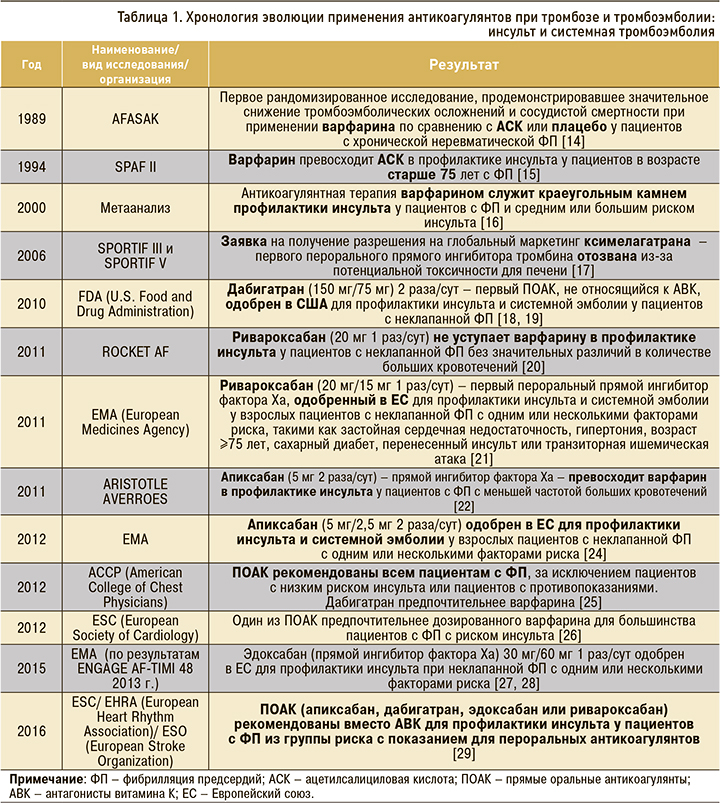
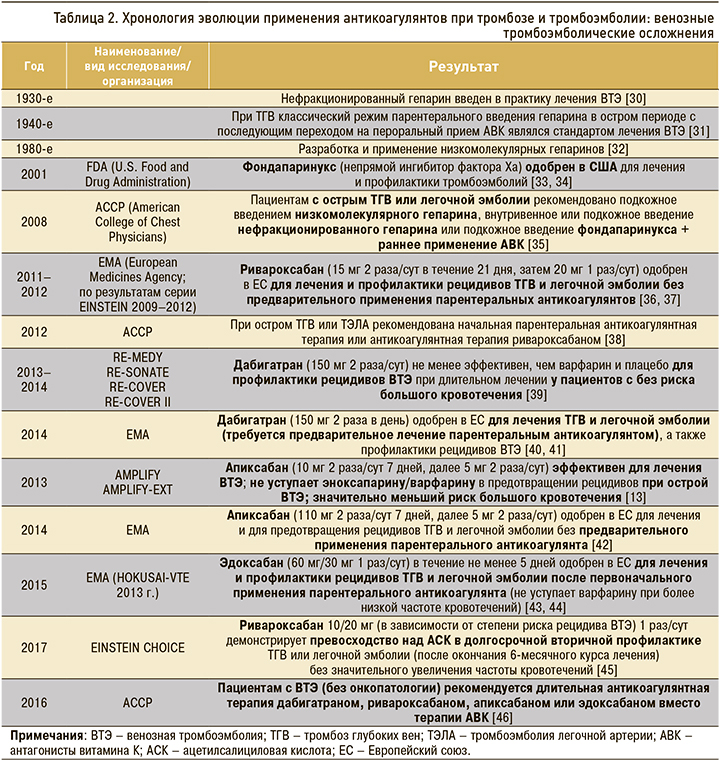

ПРЯМЫЕ ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Алгоритмы выбора ПОАК Европейского общества кардиологов (ESC), американских кардиологических сообществ, а также Евразийского общества кардиологов предполагают преимущество ПОАК перед АВК у пациентов, подходящих для их назначения (ПОАК не рекомендованы при тяжелой хронической болезни почек, антифосфолипидном синдроме, у пациентов с механическими протезами клапанов сердца, во время беременности и лактации). При этом стоит проблема выбора между несколькими ПОАК: апиксабаном, дабигатраном, эдоксабаном, ривароксабаном [10, 52].
Больные ФП с отягощенной коморбидной патологией (особенно «хрупкие» пациенты, больные хронической болезнью почек или хронической почечной недостаточностью, лица пожилого и старческого возраста) имеют высокий риск инсульта и соответственно нуждаются в эффективной протекции, которая в равной мере должна быть безопасна ввиду повышенного риска кровотечений. Среди ПОАК профиль, характеризующий чистую клиническую выгоду (net clinical benefit, NCB) от применения максимально эффективной дозы при комбинации тромбоэмболических осложнений со всеми большими кровотечениями и смертельными исходами, является положительным только у апиксабана. Его расчет в основных клинических исследованиях ПОАК позволяет сделать вывод об апиксабане как о предпочтительном антикоагулянте у определенных групп пациентов: пожилых, с отягощенной коморбидностью, при сочетании фибрилляции предсердий (ФП) с хронической сердечной недостаточностью, а также с повышенным риском желудочно-кишечных кровотечений (ЖКК) [53, 54].
Частота ЖКК у пациентов, получающих ПОАК, имеет неравномерный характер: наименьшие показатели таких кровотечений, по сравнению с АВК, достигаются на фоне приема апиксабана 5 мг; относительный риск (ОР) 0,89, доверительный интервал (ДИ) 0,70–1,15. Для сравнения: у дабигатрана 150 мг этот показатель равен 1,49 (ДИ 1,21–1,84), у ривароксабана 20 мг – 1,61 (ДИ 1,30–1,99). Позиция выбора наиболее безопасного препарата с точки зрения ЖКК отражена в практических рекомендациях уже на протяжении нескольких лет: в качестве препарата первой линии установлен апиксабан в стандартной дозировке 5 мг или дабигатран в сниженной дозе 110 мг. Стоит обратить внимание, что апиксабан не требует снижения дозировки и сохраняет свой профиль безопасности при максимальной терапевтической эффективности. Кроме того, он лишен гендерной стороны риска, в то время как, например, прием ривароксабана ассоциирован с более частыми ЖКК у мужчин [55].
Если говорить о геморрагических рисках, то в случае апиксабана речь идет только о так называемых досаждающих кровотечениях (носовых – в 68% случаев, из десен – в 25% и подкожных – в 7%) без увеличения риска больших кровотечений и инсульта. К сожалению, эти события иногда становятся необоснованной причиной отказа от продолжения антикоагулянтной терапии. В данном контексте необходимо помнить, что лечение пациентов с ФП без перерыва сопровождается возникновением инсультов и системной эмболии в 1,7% случаев, при временном перерыве в лечении – уже в 6,2%, а при длительной отмене – в 25,6% [55, 56].
ПРЯМЫЕ ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ У ПАЦИЕНТОВ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ И ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ
Терапия пациентов с сочетанием ФП и острого коронарного синдрома (ОКС) или перенесших чрескожное коронарное вмешательство (ЧКВ) не является взаимозаменяемой. Еще не так давно рекомендации по применению антитромботической терапии у данных групп больных были противоречивы и недостаточно понятны. Однако современные отечественные протоколы ведения этих состояний соответствуют актуальным европейским рекомендациям, поскольку эра ПОАК ознаменовалась целой серией фундаментальных исследований: PIONEER AF-PCI (ривароксабан), RE-DUAL PCI (дабигатрана этексилат), ENTRUST (эдоксабан) и AUGUSTUS (апиксабан).
В исследовании PIONEER AF-PCI продемонстрирована более высокая безопасность двойной антитромботической терапии по сравнению с тройной, несмотря на применение в последнем случае сниженной дозировки ривароксабана [57]. В наиболее крупном исследовании с уникальным сложным дизайном – AUGUSTUS – участвовали 4614 больных ФП из 33 стран, которые имели ОКС или перенесли ЧКВ и должны были принимать ингибитор P2Y12. Пациентов случайным образом распределяли в группы приема апиксабана или АВК (варфарина) в течение 6 мес, которые, в свою очередь, были поделены на подгруппы аспирина или плацебо. Первичной конечной точкой служило большое или клинически значимое небольшое кровотечение, вторичной – смерть или госпитализация, а также совокупность ишемических событий. В итоге антитромботический режим на основе комбинации ингибитора P2Y12 и апиксабана приводил к меньшему числу и меньшей тяжести кровотечений, а также снижению случаев госпитализаций без значимых различий в частоте ишемических событий по сравнению с режимами, которые включали АВК (варфарин), аспирин или и то, и другое.
Основной вывод всех четырех исследований – превосходство двойной терапии над тройной – нашел свое подтверждение в обновленных рекомендациях ESC [10]. Еще одно заключение, следующее из результатов исследования AUGUSTUS, касается продолжительности двойной терапии: у стабильных пациентов после первичного коронарного вмешательства может быть достаточно 6 мес двойной терапии, после чего возможен переход на монотерапию ПОАК [57].
ПРЯМЫЕ ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ОНКОПАТОЛОГИИ
Активный онкологический процесс и венозные тромбоэмболические осложнения (ВТЭО) тесно связаны. Злокачественное новообразование увеличивает вероятность возникновения венозного тромбоза в 3–7 раз [51]. Частота регистрации ВТЭ у пациентов с верифицированным раком достигает 10–20% [58].
Венозный тромбоз и ЛЭ могут возникать как у пациента с уже верифицированным раком, так и предшествовать диагностике злокачественного новообразования, косвенно свидетельствуя о наличии прогрессирующей формы рака с отдаленными метастазами [58]. Существуют отдельные сведения о том, что риск развития ВТЭО может сохраняться повышенным на протяжении 10–15 лет после диагностики рака [51], и, наоборот, вероятность выявления отдельных злокачественных новообразований (рак толстой кишки, поджелудочной железы, миелома) остается увеличенной через 6 лет и более после первичного эпизода ВТЭО [59].
Комплекс молекулярных и клеточных механизмов определяет развитие «онкогенной тромбофилии» при активном онкологическом процессе, присутствие которой можно подтвердить с помощью глобальных тестов для оценки системы гемостаза. В частности, тест тромбодинамики позволил выявить гиперкоагуляцию у 65% больных колоректальным раком, которая статистически значимо коррелировала с риском развития послеоперационных ВТЭО [60].
Онкопроцесс выступает фактором риска умеренной силы, реализующим свой тромбогенный потенциал под воздействием прочих триггеров (табл. 4).
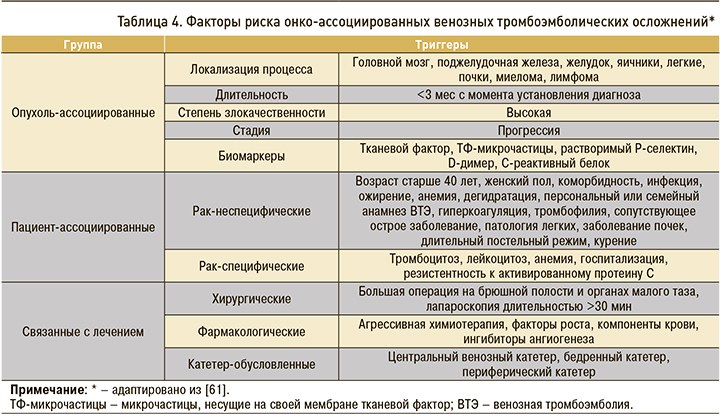
Лечение онко-ассоциированных ВТЭ – непростая задача, так как подобные больные отличаются повышенной склонностью к развитию как ЛЭ, так и тяжелого кровотечения [62]. В случае злокачественного новообразования длительность трех известных периодов антикоагулянтной терапии при ВТЭ относительно увеличена: инициального – до 5–10 дней, длительного – до 6 мес, продленного – свыше 6 мес. При этом минимальный срок лечения составляет 6 мес, а показанием к продленному использованию антикоагулянтов является сохранение активности онкологического процесса (наличие отдаленных метастазов и/или продолжающаяся специфическая терапия) [63]. Помимо фаз и общей продолжительности лечения, меняются также перечень рекомендованных препаратов и режим их дозирования.
«Золотым стандартом» антикоагулянтной терапии онко-ассоциированного венозного тромбоза вплоть до недавнего времени служили НМГ, длительное использование которых позволяло уменьшить риск рецидива ВТЭО без влияния на опасность геморрагических осложнений и летального исхода по сравнению с результатами применения АВК [64]. Основа этому подходу была заложена в 2003 г. публикацией исследования CLOT, в котором применение далтепарина в дозе 200 МЕ/ кг массы тела на протяжении первого месяца и 150 МЕ/кг массы тела в течение последующих 5 мес в сравнении с традиционным применением АВК позволило уменьшить риск рецидива ВТЭО на 52% без влияния на показатели кровотечения и смертности [65]. Главным недостатком длительного применения НМГ является низкий комплаенс больных, приводящий в лучшем случае к переходу на альтернативные препараты, а в худшем – к преждевременному прекращению лечения. По результатам анализа страховых заявок было выявлено, что средняя длительность использования НМГ при онко-ассоциированных ВТЭО составляет 3,3 мес (7,9 мес – при использовании оральных антикоагулянтов), а рекомендованный курс в 6 мес завершают только 37% пациентов (61% при использовании оральных антикоагулянтов) [66].
ПОАК изменили ситуацию с лечением онко-ассоциированных ВТЭ. В сравнении с АВК они обладают более высокой эффективностью при сопоставимом (или улучшенном для отдельных препаратов) профиле безопасности. Недавно были опубликованы результаты исследований, сравнивающих результаты применения ПОАК и далтепарина у онкологических пациентов: SELECT-D (ривароксабан), HOKUSAI-VTE Cancer (эдоксабан), ADAM VTE (апиксабан), CARAVAGGIO (апиксабан) (табл. 5). Ривароксабан продемонстрировал более высокую эффективность при сопоставимом риске больших кровотечений и увеличенной частоте небольших, но клинически значимых кровотечений [48, 49]. Эдоксабан оказался не менее эффективным, но увеличивал частоту развития больших кровотечений [47]. Апиксабан не смог доказать бо'льшую эффективность в исследовании ADAM VTE, куда включались пациенты не только с подтвержденным ТГВ нижних конечностей или ТЭЛА, но и с ТГВ верхних конечностей, а также тромбозом спланхнических и мозговых вен [50]. Вместе с тем в более позднем исследовании CARAVAGGIO апиксабан продемонстрировал не меньшую эффективность и сопоставимую безопасность с дальтепарином [67]. Примечательно, что во время лечения апиксабаном не наблюдалось увеличения риска большого ЖКК по сравнению с дальтепарином. В это исследование включали пациентов как с активным раком, так и с анамнестическим указанием на заболевание, но исключали лиц с первичным или метастатическим поражением головного мозга, поскольку в этой ситуации однозначных решений не бывает. Из консенсуса по лечению и профилактике ВТЭО у пациентов с раковыми заболеваниями из The Lancet Oncology 2019 г. следует, что применение ПОАК или НМГ при доказанной ТЭЛА у пациентов с опухолями головного мозга допустимо при отсутствии противопоказаний, но не показано в случае предстоящего нейрохирургического вмешательства. В исследование CARAVAGGIO рандомизировали 1170 больных. Конечные точки эффективности включали рецидивы ВТЭ, безопасность оценивалась по частоте развития больших кровотечений. Лечение продолжалось в течение 6 мес с дополнительным сроком наблюдения в один месяц. Апиксабан не хуже дальтепарина предотвращал рецидивы ТГВ или ТЭЛА. С точки зрения безопасности статистически значимых различий по большим и небольшим, но клинически значимым кровотечениям не обнаружено. Более того, на апиксабане, как и на ривароксабане (в SELECT-D) наблюдалась положительная тенденции в виде снижения летальности по сравнению с применением дальтепарина (см. табл. 5).
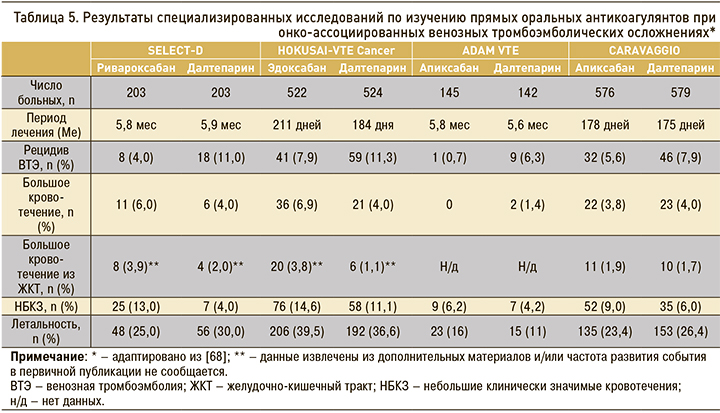
С учетом вышесказанного можно резюмировать, что баланс пользы и риска при использовании ПОАК у онкологических пациентов может быть смещен в сторону увеличения эффективности ценой небольшого повышения опасности кровотечения, главным образом желудочно-кишечного и урогенитального. Вероятнее всего, это связано с фиксированной дозой орального антикоагулянта, которая применялась на протяжении всего периода лечения, тогда как доза активного компаратора уменьшалась на 25% через 30 дней. Это подтверждают кривые дожития, значительно расходящиеся по истечению первого месяца наблюдения.
При интерпретации обсуждаемых исследований необходимо помнить, что прямое сравнение между собой их результатов недопустимо из-за имеющихся различий в структуре онкологических заболеваний и длительности терапии. Именно с этих позиций следует принимать клинические решения, учитывая персональный набор клинико-анамнестических характеристик конкретного больного.
В современных рекомендациях специализированных медицинских сообществ ПОАК, в частности, ривароксабан и эдоксабан (последний не зарегистрирован в РФ), рекомендуются к применению для лечения ВТЭО у онкологических пациентов (табл. 6). По-видимому, новые данные завершившихся на момент подготовки статьи исследований о достаточной эффективности и безопасности апиксабана будут способствовать обновлению клинических рекомендаций.
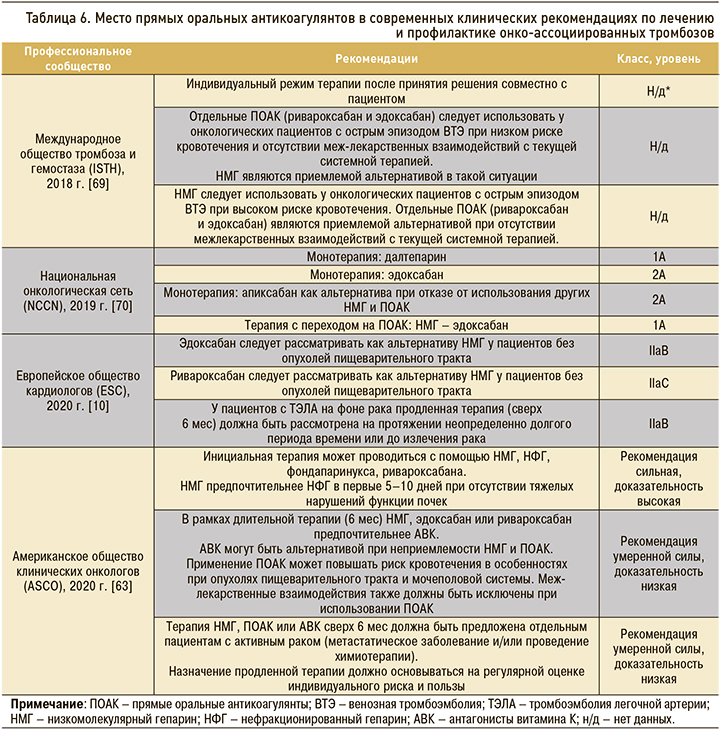
Если говорить о длительности антикоагулянтной терапии ВТЭ в целом, то современная схема применения антикоагулянтов у пациентов с ТГВ и/или ТЭЛА предполагает использование высоких (лечебных) доз антикоагулянтов не менее 3 мес. Затем должно быть принято решение о необходимости продления терапии с учетом особенностей конкретного больного. В частности, для дистальных ТГВ нижних конечностей дальнейшее использование антикоагулянтов не требуется. Проксимальный ТГВ нижних конечностей, как и ТЭЛА, более склонен к рецидивам и требует взвешенного врачебного решения. В этом решении могут помочь обновленные рекомендации по ЛЭ Европейского кардиологического общества 2019 г., разделившие риск рецидива на 3 группы: низкий, средний и высокий [52]. Наиболее благоприятной является ситуация, в которой ведущий фактор риска ТЭЛА относится к очень сильным и в последующем устранен (хирургическое вмешательство, острое нехирургическое заболевание). В этом случае не только европейские, но и американские коллеги рекомендуют 3-месячную антикоагулянтную терапию [52, 71]. На другом конце спектра находятся пациенты с сохраняющимся высоким риском рецидива, который может быть обусловлен имеющимися злокачественными новообразованиями, антифосфолипидным синдромом или повторными эпизодами ТГВ и/или ТЭЛА. В этом случае формулировка длительности терапии звучит как «неопределенно долгое время». Категория среднего риска включает наиболее разнородную группу пациентов, в которой длительность лечения также зачастую остается неопределенно долгой, но в любом случае речь идет, скорее, о годах, чем о месяцах. Когда можно безопасно отменить антикоагулянты у таких больных – вопрос, на который у экспертов пока нет точного ответа [52, 63].
ПРЯМЫЕ ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ COVID-19
Гиперкоагуляция достаточно часто наблюдается у пациентов с тяжелым COVID-19 и способствует повышению риска неблагоприятных исходов, таких как прогрессирующая дыхательная недостаточность, острый респираторный дистресс-синдром (ОРДС) и смерть [71–78].
Наиболее распространенная картина коагулопатии, наблюдаемая у пациентов, госпитализированных с COVID-19, характеризуется повышением уровня фибриногена, D-димера, умеренным удлинением протромбинового времени (ПВ) и активированного частичного тромбопластинового времени (АЧТВ). Это коррелирует с сопутствующим повышением маркеров воспаления (например, C-реактивного белка). В отличие от картины классического синдрома диссеминированного внутрисосудистого свертывания, наблюдаемого при бактериальном сепсисе или травме, степень повышения АЧТВ часто ниже, чем повышение ПВ (вероятно, из-за повышенного уровня фактора VIII), тромбоцитопения – умеренная (уровень тромбоцитов около 100 тыс./мкл), микроангиопатия отсутствует. Для обозначения данного состояния Американское общество гематологов (American Society of Hematology) предложило использовать термин «коагулопатия, ассоциированная с COVID-19» [74].
Повышенный уровень D-димера при поступлении и значительное (в 3–4 раза) увеличение его уровня в течение госпитализации ассоциировано с высокой смертностью, что, вероятно, отражает активацию факторов свертывания в результате инфекции и/или сепсиса, «цитокинового шторма» и надвигающейся полиорганной недостаточности [74].
Для профилактики тромботических осложнений у пациентов с COVID-19 эмпирически применяются парентеральные антикоагулянты: инъекции НМГ, фондапаринукса натрия, в их отсутствие – НФГ [73, 75, 79]. В клинической практике для этой цели все чаще по причине удобства применения используют ПОАК. Этому способствует включение некоторых ПОАК (ривароксабана и апиксабана) во временные методические рекомендации Минздрава России и протоколы ведения пациентов с COVID-19, опубликованные рядом клиник и профессиональных сообществ [73, 74, 79–81].
Анализ данных о применении ПОАК для профилактики тромботических осложнений, наблюдающихся у пациентов с COVID-19, в соответствии с результатами опубликованных клинических исследований, национальными руководствами по ведению пациентов с новой коронавирусной инфекцией и протоколами университетских клиник позволяет сформулировать следующие положения.
1. У пациентов с COVID-19, получающих лечение амбулаторно и не нуждающихся в назначении антикоагулянтов по другим показаниям, следует оценивать риски ВТЭ и кровотечений. При высоком риске тромбоэмболических осложнений и низком риске кровотечений могут быть рассмотрены к назначению НМГ или НФГ в профилактических дозах, а также апиксабан 2,5 мг 2 раза/сут или ривароксабан 10 мг 1 раз/сут [80].
2. Госпитализированным пациентам с COVID- 19, не нуждающимся в приеме ПОАК по другим показаниям, таким как, например, ФП, недавние ТГВ или ТЭЛА, целесообразно рассмотреть назначение НМГ/фондапаринукса натрия как минимум в профилактических дозах. В качестве альтернативы профилактическому применению НМГ госпитализированными пациентами с COVID-19 может быть рассмотрено применение ПОАК в профилактических дозах (апиксабан 2,5 мг 2 раза/ сут или ривароксабан 10 мг 1 раз/сут). При выборе антитромботической терапии следует учитывать потенциальные межлекарственные взаимодействия между назначенными пациенту лекарственными препаратами и ПОАК.
3. Госпитализированным пациентам с COVID- 19, принимающим ПОАК по показаниям, зарегистрированным в инструкции по медицинскому применению, следует оценивать наличие потенциальных взаимодействий с применяемыми во время госпитализации лекарственными препаратами. При наличии значимых взаимодействий целесообразно рассматривать возможность временного перехода с ПОАК на парентеральные антикоагулянты, например НМГ. По завершении применения препаратов, значимо изменяющих фармакокинетику ПОАК, целесообразно возобновить прием ПОАК.
4. При переводе на амбулаторный режим пациентов, не нуждающихся в постоянном приеме антикоагулянтов, следует оценить риск венозных тромбозов и кровотечений. При высоком риске венозных тромбозов и низком риске кровотечений целесообразно рассмотреть возможность пролонгированной (до 45 дней) фармакологической профилактики ВТЭ лекарственным препаратом, применявшимся в период госпитализации. Может быть рассмотрен прием апиксабана 2,5 мг 2 раза/сут или ривароксабана 10 мг 1 раз/сут (в соответствии с результатами исследований продленной профилактики ВТЭ у нехирургических пациентов).
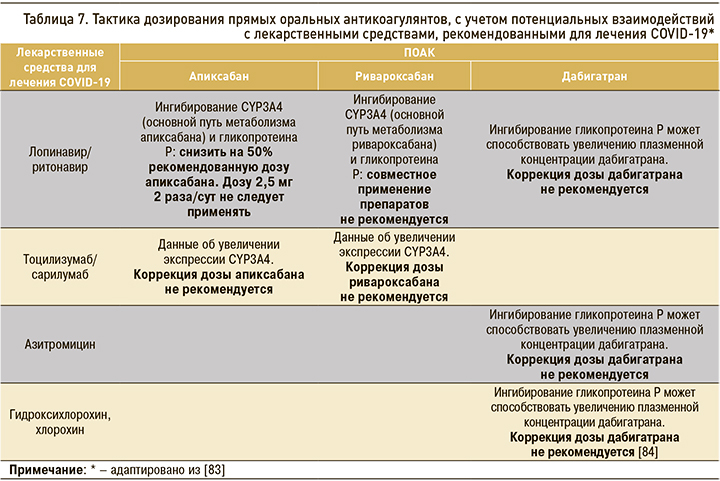
При назначении ПОАК больным COVID-19 важно помнить об их возможных потенциальных взаимодействиях с ингибиторами гликопротеина P (табл. 7), приводящих к повышению плазменных концентраций ПОАК, что клинически может выражаться в развитии кровотечений, в том числе жизнеугрожающих. По данным исследования Testa S. et al., наименьшая равновесная концентрация ПОАК у пациентов, госпитализированных по поводу COVID-19 и получавших противовирусную терапию, более чем в 6 раз превышала наименьшую равновесную концентрацию ПОАК до госпитализации [82].
ЗАКЛЮЧЕНИЕ
Несмотря на множество сохраняющихся белых пятен в вопросах антикоагулянтной терапии и профилактики заболеваний, ассоциированных с тромбозом, не вызывает сомнений обоснованность в рамках доказательной медицины обновленных рекомендаций ESC (2019), ASCO (2019) и ASH (2020), подчеркивающих значимые преимущества ПОАК как в эффективности, так и в безопасности их применения у различных групп пациентов с тромбоз-ассоциированными состояниями.



