Остеоартрит (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. Распространенность ОА составляет около 12% в популяции [1].
Являясь заболеванием, на долю которого приходится 60–70% всех болезней костно-мышечной системы, ОА представляет серьезную медико-социальную проблему в связи с хроническим прогрессирующим течением, нарушением функциональной способности опорно-двигательного аппарата и ухудшением качества жизни больного [2].
Посттравматический остеоартрит (ПТОА) относится к достаточно распространенным вариантам ОА (около 20% от всех его видов). Важнейшая его особенность – частое (около 40%) наличие механических факторов патогенеза: дисконгруэнтности суставных поверхностей, нестабильности суставов, наличия в их полости посторонних тел и спаек. Типичными повреждениями, способствующими формированию ПТОА, являются полные или частичные разрывы капсульно-связочных структур, а также внутрисуставные переломы костей, формирующих сустав [1, 2]. По результатам собственных многолетних исследований нами выделены следующие факторы, предрасполагающие к прогрессированию ПТОА:
- посттравматическая нестабильность суставов;
- наличие внутри сустава посторонних тел (фрагментов поврежденных связок, менисков, суставного хряща, костных отломков, организовавшихся гематом);
- рубцовое перерождение суставной капсулы и окружающих сустав мягких тканей – мышц, сухожилий, жировой клетчатки;
- нарушения конгруэнтности суставных поверхностей;
- нарушения кровоснабжения тканей суставов, прежде всего субхондральной кости и суставного хряща.
Повреждение суставного хряща может происходить в период сразу после травмы, в ближайшее время или развиваться через несколько лет после нее. Даже при проведении жесткой фиксации внутрисуставных переломов, реконструкции поврежденных связок с успешным восстановлением биомеханики сустава риск развития посттравматического гонартроза колеблется в пределах от 20 до 50% [2].
Сверхвысокопольные магнитно-резонансные (МР) томографы (3 Тесла) представляют собой современные диагностические системы экспертного класса на основе сверхпроводящего магнита. Они позволяют выполнять трехмерную изотропную импульсную последовательность с высоким пространственным разрешением и чувствительностью к мельчайшим патологическим нарушениям, меньшей по времени длительностью обследования и высоким отношением «сигнал–шум», что существенно улучшает точность оценки состояния хряща [3]. Методика цветового Т2-картирования хряща включает проведение МР-исследования с последующей реконструкцией и построением цветных Т2-карт. Количественная оценка времени Т2-релаксации служит неинвазивным маркером дегенерации суставного хряща, так как этот параметр зависит от степени гидратации ткани и ее биохимического состава. Вода суставного хряща находится в связанном состоянии с окружающими макромолекулами, что обусловливает его низкую интенсивность на Т2-взвешенных изображениях. Повреждение протеогликан-коллагенового комплекса у пациентов с хондромаляцией приводит к уменьшению микровязкости и соответственно к увеличению содержания свободной жидкости, что отражается увеличением времени Т2-релаксации [3].
Лечение пациентов с ПТОА предполагает в первую очередь хирургическое устранение механических факторов патогенеза, без чего консервативная терапия не может быть по-настоящему успешной. Возможности хирургического лечения профильных пациентов в настоящее время достаточно широки, но при терминальных стадиях ПТОА эндопротезирование суставов не имеет эффективной альтернативы.
К основным типам оперативных вмешательств у пациентов с поздними стадиями ОА крупных суставов относятся восстановление внутрисуставного и околосуставного связочного аппарата суставов и их стабильности; артроскопические операции на пораженных суставах: лаваж (промывание), дебридмент, абразивная хондропластика, лазерная вапоризация; корригирующие остеотомии с целью исправления механической оси конечностей и перераспределения нагрузки на различные отделы суставного хряща; эндопротезирование суставов с использованием современных имплантатов, срок службы которых рассчитан на 20–25 лет.
Вместе с тем имплантированные искусственные суставы не полностью удовлетворяют 20% пациентов, а в отношении купирования боли – 10% больных; они могут вызывать ряд осложнений и со временем требуют замены. В связи с этим лечение пациентов с ПТОА должно быть комплексным и включать консервативную составляющую, направленную прежде всего на сохранение суставного хряща и снижение выраженности болевого синдрома для предупреждения или отсрочки выполнения радикальных операций.
Уменьшение выраженности симптомов ОА на сегодняшний день – далеко не единственная цель медикаментозной терапии. Ведется поиск лекарственных препаратов, обладающих доказанными структурно-модифицирующими эффектами, влияющими на основные проявления заболевания и замедляющими его прогрессирование. Особенно актуальным представляется решение этой задачи на самых ранних этапах развития ПТОА [4, 6].
К препаратам, способным не только уменьшить болевой синдром, но и, возможно, замедлить прогрессирование ОА, относится Алфлутоп. Он содержит хондроитин-4-сульфат и хондроитин-6-сульфат; наличие этих соединений позволяет использовать Алфлутоп в рамках обновленного алгоритма (ESCEO, 2019) лечения больных ОА на основании принципов доказательной медицины.
Механизм действия хондроитина сульфата сложен, многогранен и охватывает почти все ключевые стороны патогенеза ОА: он улучшает трофику и уменьшает резорбцию субхондральной кости, определяет вязкость синовиальной жидкости и эластичность хряща. Также необходимо отметить его влияние на метаболизм субхондральной кости, гидрофобность и стимуляцию синтеза гиалуроновой кислоты, что способствует осуществлению хрящом его основной функции.
Кроме того, структурно-модифицирующее действие препарата Алфлутоп связывают с улучшением вязко-эластических свойств синовиальной жидкости, повышением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща (металлопротеиназ 3, 9, 13 и 14 типа), эластазы, катепсина-бета, угнетении медиаторов воспаления (таких как интерлейкин-1, циклооксигеназа-2, простагландин Е2, NF-kB), снижении апоптоза, концентрации оксида азота и свободных радикалов [4].
Алфлутоп способен одновременно увеличивать синтез гиалуроновой кислоты и уменьшать ее деградацию путем снижения активности гиалуронидазы. Этот препарат представляет собой биоактивный концентрат из 4 видов мелкой морской рыбы, состоящий из гликозаминогликанов, аминокислот, пептидов и микроэлементов – ионов Na, K, Ca, Mg, Fe, Cu, Zn. Помимо указанных свойств, препарат стимулирует регенераторные процессы в суставном хряще, восстанавливает гомеостаз хондроцитов в поврежденном хряще, ингибирует образование супероксидных радикалов. Алфлутоп способен уменьшать проявления вторичного синовита при ОА, который формируется в результате адсорбции провоспалительных цитокинов на крупных молекулах гиалуроновой кислоты [4].
Цель исследования – оценка эффективности влияния различных групп лекарственных препаратов на клиническое течение посттравматического гонартроза (ПТГА) и биохимическое состояние хрящевой ткани с использованием магнитно-резонансной томографии (МРТ) с цветовым Т2-картированием.
МАТЕРИАЛ И МЕТОДЫ
Работа проводилась на базе ревматологического отделения Северо-Западного государственного медицинского университета им. И.И. Мечникова, Городской поликлиники № 114 (г. Санкт-Петербург) и российско-финской клиники «Скандинавия». Промежуточные результаты исследования (точки 6 и 12 мес) были опубликованы в журнале Терапия (2019; № 6, с. 44–49). С учетом перспективного характера было принято решение пролонгировать исследование и добавить конечную точку – 36 мес наблюдения.
В исследование был включен 61 пациент с достоверным диагнозом ПТГА коленного сустава, давший письменное согласие на участие. В структуре больных заметно преобладали женщины – 45 (74%), мужчин было 16 (26%). Средний возраст пациентов составил 46,2±4,1 лет, продолжительность заболевания – 3,3±1,4 лет. Рентгенологическая стадия 0 была зарегистрирована на момент рандомизации у 25 (41%) пациентов с ПТГА, стадия I – у 36 (59%). Диагноз ОА устанавливался в соответствии с критериями Американской коллегии ревматологов (ACR) [4, 5]. Рентгенологическую стадию оценивали согласно классификации Келлгрена–Лоуренса [4, 5]. В отсутствие рентгенологических признаков диагноз ОА устанавливался на основании совокупности клинических симптомов (боль механического характера, скованность в коленных суставах менее 30 мин, нарушение функции сустава).
При отборе пациентов критериями невключения служили проводимая ранее терапия ОА симптоматическими препаратами замедленного действия (SYSADOA), глюкокортикоидами; двусторонний ОА коленных суставов или односторонний ОА III, IV рентгенологической стадии; тяжелые коморбидные состояния; любые внутрисуставные инъекции; применение антикоагулянтов, антиагрегантов, фибринолитиков.
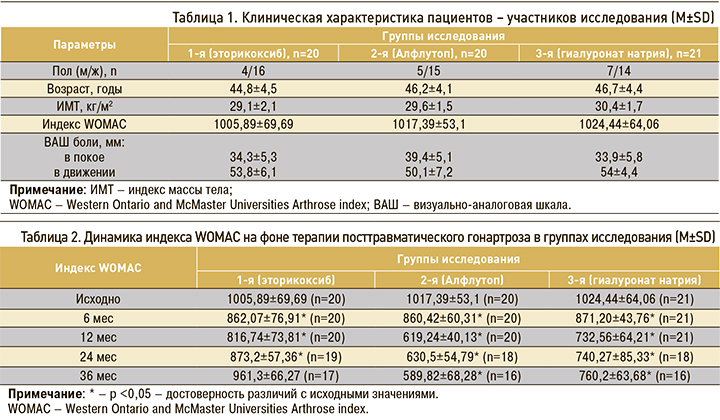
Пациенты были рандомизированы слепым методом (метод конвертов) на 3 группы, сопоставимые по полу, возрасту и основным клиническим проявлениям (табл. 1):
- 1-я группа (n=20) получала перорально эторикоксиб по 60 мг/сут; начиная с 12 месяца применение этого НПВП осуществлялось «по требованию»;
- 2-я группа (n=20) получала Алфлутоп внутримышечно по 1 мл/сут, курс лечения составлял 20 инъекций каждые 6 мес;
- 3-ей группе (n=21) проводились внутрисуставные введения 2 мл 1,5% гиалуроната натрия трижды с интервалом в 7 дней каждые 6 мес.
Всем больным 2 и 3 групп при наличии выраженного болевого синдрома дополнительно назначался парацетамол по требованию. Терапия больных проводилась в соответствии с национальными стандартами лечения ОА, принятыми в России.
Дизайн исследования включал 6 визитов (исходно, через 3, 6, 12, 24 и 36 мес), в ходе которых оценивались выраженность болевого синдрома, функциональная активность суставов с использованием визуально-аналоговой шкалы (ВАШ) боли в покое и при ходьбе (в мм), а также индекса WOMAC (Western Ontario and McMaster Universities osteoarthritis Index). Для определения влияния проводимого лечения на хрящевую ткань, а именно на ее биохимическое состояние и степень гидратации, все пациенты прошли МР-исследование коленных суставов до и после терапии через 12 и 36 мес. Это исследование включает проведение методики цветового Т2-картирования и измерения времени Т2-релаксации области медиальных мыщелков бедренной и большеберцовой кости, отражающее количество свободных молекул воды в структуре хряща.
МРТ с Т2-картированием может выполняться в рутинной клинической практике, оно не требует введения контрастного препарата и увеличивает продолжительность исследования не более чем на 6–8 мин. Основное преимущество такой методики – возможность неинвазивного динамического наблюдения за состоянием хрящевой ткани на фоне консервативного лечения. На первом этапе проводится МР-исследование коленных суставов с последующим выбором зоны проведения картирования. В данном случае такой зоной интереса послужил бедренно-подколенный сегмент хрящевой ткани, хорошо отражающийся на сагиттальных срезах.
В дальнейшем проводится реконструкция полученных изображений и построение цветных Т2-карт (T2MAP) с вычислением времени Т2-релаксации.
Статистический анализ полученных в процессе исследования данных осуществлялся с использованием программы STATISTICA for Windows (версия 10; лицензия BXXR310F964808FA V) и включал общепринятые методы параметрического и непараметрического анализа. Статистическая значимость определялась как р <0,05.
РЕЗУЛЬТАТЫ
К 6 мес во всех группах обследованных наблюдалось значимое снижение индекса WOMAC. У пациентов, получавших эторикоксиб, к концу исследования сохранилась тенденция уменьшения показателя WOMAC, не достигшая, однако, статистической значимости по сравнению с 12 месяцем наблюдения. В группах больных, которым вводились Алфлутоп или гиалуронат натрия, уменьшение индекса WOMAC продолжилось и оказалось значимым к 12 мес наблюдения; при этом в группе Алфлутопа оно достигло более низких показателей по сравнению с группами эторикоксиба и гиалуроната натрия (р <0,05).
Прием эторикоксиба по 60 мг в режиме «по требованию» привел к усилению болевого синдрома на сроке наблюдения 24 и 36 мес. Среди пациентов, получавших Алфлутоп или препараты гиалуроновой кислоты, отмечалось дальнейшее снижение индекса WOMAC, которое было более выраженным при применении препарата Алфлутоп (табл. 2).
В связи с длительностью исследования к 36 мес наблюдения отмечалось снижение численности его участников. Так, в первой клинической группе их количество к этому моменту составило 17 человек, а во второй и третьей – по 16.
Интенсивность болевого синдрома, оцениваемого по ВАШ в покое и при ходьбе, к 6 мес исследования более значимо уменьшилась в группе эторикоксиба. В группе Алфлутопа на этом этапе не удалось достигнуть значимого изменения показателей ВАШ, а в группе гиалуроната натрия интенсивность боли снизилась, но не достигла уровня эторикоксиба. Однако к 36 мес наблюдения в группе Алфлутопа было зафиксировано достижение минимальных значений ВАШ, а вот при использовании эторикоксиба «по требованию» отмечался рецидив суставного синдрома (табл. 3).
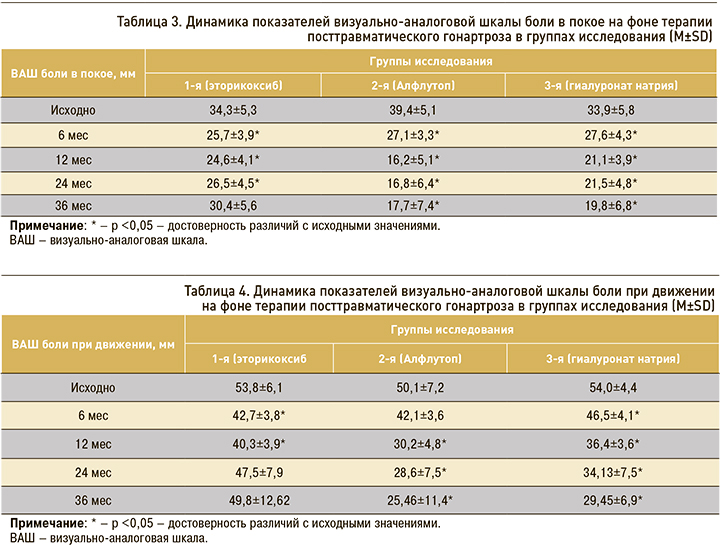
К 36 мес наблюдения в группе препарата Алфлутоп показатели ВАШ боли в покое и при ходьбе оказались значительно ниже по сравнению с показателями в начальных периодах исследования, а также в сравнении с показателями в других группах пациентов (р <0,05). Динамика снижения уровня боли в покое и при движении отмечалась и в других группах обследованных (табл. 4).
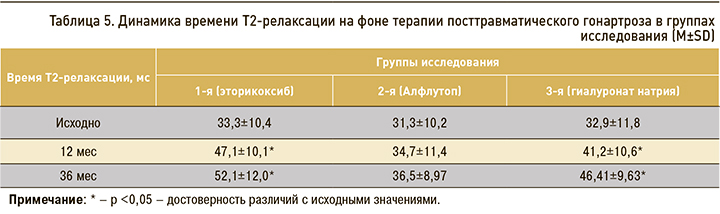
В ходе нашего исследования особо показательными были результаты Т2-картирования хрящевой ткани в группах Алфлутопа и эторикоксиба, поскольку между этими препаратами изменения оказались самыми значимыми.
В группе эторикоксиба показатель времени Т2-релаксации до лечения составлял 33,3±10,4 мс, Алфлутопа – 31,3±10,2 мс, гиалуроната натрия – 32,9±11,8 мс. Достоверных различий между группами до начала лечения по этому параметру не отмечалось (р >0,05). К 12 мес наблюдения увеличение времени Т2-релаксации до 34,7±11,4 мс у пациентов, получавших лечение Алфлутопом, оказалось недостоверным (р >0,05) по сравнению с исходными показателями (р <0,05), однако имели статистически значимые различия в сравнении с данными в группах эторикоксиба (47,1±10,1 мс) и гиалуроната натрия (41,2±10,6 мс). В группах эторикоксиба и гиалуроната натрия через 36 мес у пациентов отмечалась достоверно (р <0,05) более высокая скорость Т2-релаксации. Нарастание протонной плотности, по-видимому, связано с продолжающимся хондритом и дезорганизацией хрящевого матрикса.
При проведении МРТ-контроля на сроке наблюдения 36 мес в группе пациентов, получавших Алфлутоп, не наблюдалось достоверных различий времени Т2-релаксации по сравнению с исследованием на сроке 12 мес. Это может свидетельствовать о замедлении темпов хондродегенерации (табл. 5).
В ходе проведенного исследования у 7 (25%) человек в группе эторикоксиба наблюдались нежелательные реакции по типу непродолжительных гастралгий, которые купировались на фоне временной отмены препарата, а также индивидуальной коррекцией диеты и коротким курсом приема ингибиторов протонной помпы. При лечении ПТГА препаратом Алфлутоп нежелательные явления не отмечались, а в группе пациентов, получавших гиалуронат натрия, у 3 (14%) человек развился умеренный синовит коленного сустава. Следует отметить, что в целом переносимость препаратов была хорошей во всех группах обследованных и не требовала отмены терапии.
ЗАКЛЮЧЕНИЕ
Известно, что современные стратегии лечения ПТГА на начальных этапах включают комплекс различных нефармакологических мероприятий (снижение массы тела, лечебная физкультура, ортопедические изделия и пр.), при неэффективности которых требуется лекарственная терапия. Основная цель фармакотерапии заключается не только в уменьшении болевого синдрома, но и в восстановлении тканей сустава (хряща, субхондральной кости, синовиальной оболочки и др.).
Особая роль в стратегии терапии ОА отводится как можно более ранней диагностике, позволяющей своевременно начать лечение заболевания [2].
Проведенное нами исследование показало значимую терапевтическую эффективность препарата Алфлутоп. Она проявлялась не только уменьшением болевого синдрома, увеличением функциональной активности коленных суставов, но и структурно-модифицирующим действием в отношении хрящевой ткани, что нашло отражение в национальных рекомендациях по лечению ПТГА. Полученные результаты отражают мнение большинства отечественных исследователей о положительном влиянии SYSADOA на хрящевой матрикс [6]. Обезболивающий и противовоспалительный эффект применения Алфлутопа был максимально значим к концу 36 мес исследования, что характерно для препаратов группы SYSADOA.
Прием эторикоксиба приводил к быстрому снижению показателей ВАШ боли и увеличению объема движений в суставах. Важными достоинствами этого препарата являются быстрый противовоспалительный и анальгезирующий эффекты, хорошая переносимость, однако монотерапия эторикоксибом не приводила к достоверному замедлению хондродегенерации.
Мнение о препаратах гиалуроновой кислоты до настоящего момента остается противоречивым, поскольку данные различных метаанализов свидетельствуют о небольшом эффекте от такой терапии; впрочем, что немаловажно, этот эффект сохраняется длительное время [7]. В нашем исследовании было установлено, что внутрисуставное введение гиалуроновой кислоты сопровождалось уменьшением болевого синдрома и улучшением функционального состояния коленных суставов, однако ее структурно-модифицирующий эффект был ниже, чем в группе пациентов, получавших Алфлутоп.
Разработанные подходы к оценке состояния хряща коленных суставов с применением МРТ с цветовым Т2-картированием позволяют верифицировать самые ранние стадии ПТГА, проводить количественную диагностику состояния его матрикса на биохимическом уровне, а также оценивать степень гидрофильности ткани и анизотропию распределения коллагена [3]. В нашем исследовании такая методика оказалась высокоинформативной в рамках изучения хондропротективного действия лекарственных препаратов, а также контроля за проводимым лечением, особенно на начальных стадиях течения ПТГА. Можно предположить, что в дальнейшем МРТ с цветовым Т2-картированием хряща может быть включена в алгоритм диагностики данной патологии.



