Диагностика
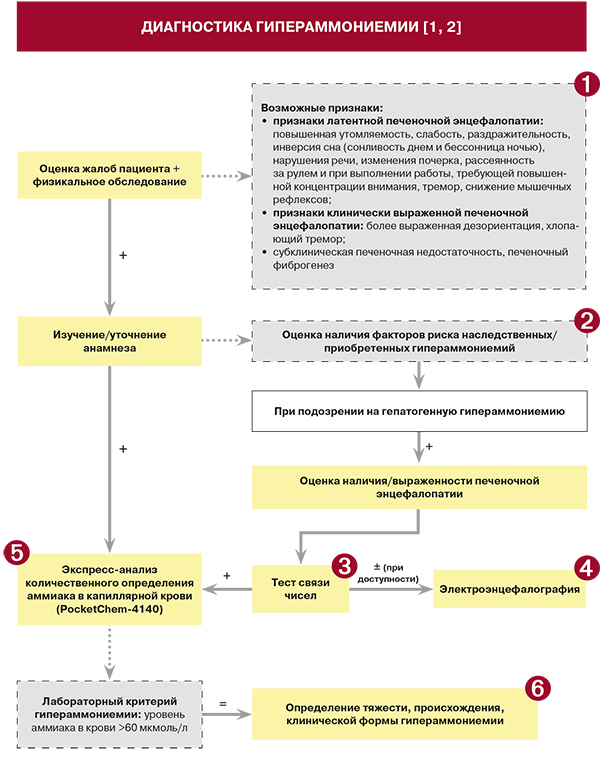
1.
• Наряду с печеночной энцефалопатией (в том числе минимальной, латентной), к наиболее изученным проявлениям гипераммониемии относятся субклиническая печеночная недостаточность за счет эндотелиальной дисфункции, возможная активация звездчатых клеток печени, ведущая к печеночному фиброгенезу [1, 2].
• При клиническом осмотре на стадии латентной печеночной энцефалопатии (ПЭ) могут выявляться определенные нарушения когнитивных функций и/или поведения: некоторая дезориентированность, эйфория или тревога, снижение концентрации внимания, сложность выполнения операций по арифметическому сложению или вычитанию, изменение ритма сна [1, 3]. Вместе с тем наблюдаемые на этой стадии ПЭ когнитивные и психомоторные расстройства нередко не воспринимаются больными и их окружением как проявление болезни. Однако результатом таких нарушений могут стать серьезные дорожно-транспортные происшествия с тяжелыми последствиями [1, 2, 4, 5]. В связи с этим выявление латентной ПЭ (в том числе с помощью теста связи чисел – см. ниже) имеет большое значение у работников многих профессий: водителей автотранспорта, операторов на автоматизированном оборудовании и др. [1, 2].
• Персистирующая и прогрессирующая гипераммониемия при хронических заболеваниях печени (неалкогольной жировой болезни печени) оказывает профиброгенный эффект, способствуя нарушению печеночной гемодинамики, развитию портальной гипертензии, а в последующем саркопении скелетной мускулатуры [1, 2]. В экспериментальных и клинических исследованиях показано, что при неалкогольной жировой болезни печени (НАЖБП) гипераммониемия развивается еще на доцирротической стадии за счет снижения активности ферментов, участвующих в орнитиновом цикле [1, 2]. У больных НАЖБП на фоне ожирения выявлено достоверное по сравнению со здоровыми лицами снижение количества и активности ферментов оринитинового цикла, причем на стадии стеатогепатита эти изменения выражены значительно сильнее, чем на стадии стеатоза [1, 2].
2.
• По этиопатогенезу гипераммониемии классифицируют на врожденные (вызванные рядом редких генетических заболеваний) и приобретенные. Последние в свою очередь разделяют на гепатогенные, гастроэнтерогенные, урогенные, сосудистые (портальная гипертензия), послеоперационные, прочие (лекарственные, в том числе вызванные цитостатиками, лучевой терапией, онкологические, онкогематологические). В силу особенности метаболизма аммиака в организме одной из ведущих предпосылок к повышению его уровня в крови выступает хроническая патология печени (цирроз печени, неалкогольная жировая болезнь печени на доцирротической стадии и др.) [1, 2, 6].
• Приобретенная гипераммониемия может иметь и внепеченочное происхождение [1, 2, 7–9]. Токсическое превышение аммиака регистрируется при гиповолемии, кровотечении из различных отделов желудочно-кишечного тракта (ЖКТ) у пациентов без цирроза печени, а также при сердечной недостаточности, легочном сердце, шунтирующих операциях, некоторых эндокринных нарушениях (декомпенсированном сахарном диабете, тяжелом тиреотоксикозе) и др. [1, 2]. Ее возникновение описано при приобретенном дефиците ферментов орнитинового цикла синтеза мочевины на фоне микровезикулярного ожирения печени (синдром Рейе), нарушении перфузии печени, метаболическом алкалозе и ацидозе, синдроме избыточного бактериального роста, длительных запорах. Гипераммониемия может наблюдаться при любых патологических состояниях, сопровождающихся повышенным катаболизмом белков (массивных кровопотерях, обширных ожогах, синдроме сдавления или размозжения тканей, обширных гнойно-некротических процессах, гангрене конечностей, гипертермии различного происхождения, сепсисе и т.д.). Гипераммониемия может наблюдаться при наличии аномалий нижних отделов мочевыводящей системы, которые вызывают затруднение оттока мочи, осложняющееся присоединением инфекции, обусловленной уреазапродуцирующими бактериями (Proteusspecies, Corynebacteriumspecies, Klebsiellaspecies, Morganella morganii и др.) [1, 2, 10].
• Повышению уровня аммиака в крови способствует прием ряда лекарственных средств, а именно салицилатов, тетрациклина, глюкокортикостероидов, аспарагиназы, 6-азауридина, аллопуринола, тиазидных диуретиков, этакриновой кислоты, изониазида, противосудорожных средств (карбамазепин, вальпроевая кислота) и др. [1, 2, 9, 11]. Также гипераммониемия вследствие употребления большого количества алкоголя и психоактивных наркотических веществ [1, 2].
• Гипераммониемии могут быть физиологическими (функциональными). К таковым относятся постпрандиальная (на фоне высокобелковой диеты) гипераммониемия, после физических нагрузок (спортивная), после психогенных перегрузок (постстрессорная), вызванная прочими причинами (например, беременностью). Физиологическая гипераммониемия НЕ нуждается в лечении [1, 2].
3.
• В связи с тем что существует корреляция между уровнем гипераммониемии и стадией ПЭ, представляется возможным косвенное выявление наличия и выраженности гипераммониемии с использованием теста связи чисел (рис.). Степень выраженности энцефалопатии рассчитывается по скорости выполнения этого теста (табл. 1). Для удобства врача и пациента тест связи чисел можно провести онлайн по адресу: www.Hepa-Merz.ru [1, 2].


• При выявлении латентной стадии ПЭ необходимо дифференцировать ее с рядом состояний, сопровождающихся когнитивными нарушениями (энцефалопатия Гайе– Вернике –Корсакова, синдром Маркиафавы–Биньямини, алкогольная деменция, синдром отмены алкоголя, пеллагра, гипотиреоз).
4.
Результаты электроэнцефалограммы относятся к инструментальным критериям стадии ПЭ по Vest–Haven. На стадии 1 ПЭ частота α-ритма составляет 7–8 колебаний в 1 с, на стадии 2 – 5–7 с, на стадии 3 – 3–5 с, на стадии 4 – менее 3 с [1, 2].
5.
• Информативным и наиболее легко осуществляемым считается экспресс-метод фотометрического количественного определения аммиака в капиллярной крови с помощью портативного анализатора PocketChem. Время определения концентрации аммиака составляет около 200 с. Для исследования забирается капиллярная кровь из пальца, однако технология забора требует соблюдения определенных условий, изложенных в инструкции. Используются только свежие образцы крови. В приборе образовавшийся из аммония аммиак проходит через полупроницаемую мембрану и изменяет цвет индикатора, длина волны которого подвергается спектроскопическому анализу и автоматически указывает количественное его содержание. Калибровка прибора и коррекция результатов осуществляются автоматически [1, 2].
• Определение уровня аммиака-аммония в печени применяется для следующих целей [1]:
- выявление уровня гипераммониемии и контроля эффективности проводимой терапии у больных с любым подтвержденным острым или хроническим заболеванием (поражением) печени;
- выявление факта гипераммониемии у больных с хроническими экзо– или эндогенными интоксикациями в рамках диагностического поиска;
- выявление факта гипераммониемии у больных с симптомами энцефалопатии различной степени, астении, хронической усталости, неврозами в рамках диагностического поиска;
- выявления врожденных дефектов азотного обмена в педиатрической практике при психологических дефектах формирования личности;
- оценка темпов восстановления метаболизма при стрессорных ситуациях (физических и психологических перегрузках, перенесенных оперативных вмешательствах, алиментарном дистрессе и т.п.).
- в ряде прочих ситуаций.
6.
Сводная классификация гипераммониемий в зависимости от уровня аммиака в крови, происхождения и течения представлена в таблице 2.

Лечение

1.
Последние данные показывают, что чрезмерное ограничение белка может увеличить уровень аммиака в сыворотке крови в результате активации мышечного катаболизма. Кроме того, излишнее ограничение белка ухудшает нутритивный статус, что может отрицательно сказываться на самочувствии пациентов с ПЭ [1, 2]. У пациентов с установленным диагнозом цирроза печени минимальный ежедневный диетический уровень потребления белка, необходимый для поддержания азотистого баланса, составляет 0,8–1,0 г/кг веса [1, 2]. Поэтому в настоящее время ряд документов рекомендует при ПЭ нормопротеиновую диету, а больным, которые не переносят нормальный растительный белок, рекомендуется замена его животным белком [1, 2].
2.
• L-орнитин L-аспартат (МНН – орнитин) – стабильная соль орнитина и аспарагиновой кислоты, которая представляет собой важный субстрат синтеза для глутамина и мочевины, основных компонентов дезаминирования [1, 2, 12]. Основные фармакологические свойства L-орнитин L-аспартата обусловлены участием обеих аминокислот, входящих в состав препарата, в орнитиновом цикле (табл. 1). L-орнитин L-аспартат повышает толерантность к белку и обладает анаболическим действием, увеличивает энергетический потенциал клеток, усиливает утилизацию молочной кислоты. Мембраностабилизирующий эффект обусловливает антиоксидантное действие L-орнитин-L-аспартата, этот эффект особо значим при хронических заболеваниях печени, в первую очередь алкогольной этиологии. Кроме этого, аспартат встраивается в цикл Кребса, т.е. увеличивает синтез макроэргов и снижает образование молочной кислоты, что, в свою очередь, уменьшает проницаемость гематоэнцефалического барьера для токсических веществ [1, 2].

• Проведенный метаанализ 10 рандомизированных клинических исследований у 884 больных показал, что L-орнитин L-аспартат в сравнении с плацебо достоверно более эффективен как при выраженной ПЭ (отношение риска (ОР): 1,19; 95% доверительный интервал (ДИ): 1,01–1,39, общая эффективность (Z) = 2,14; p=0,03), так и при латентной (ОР: 2,15; 95% ДИ: 1,48–3,14; p <0,0001). Улучшение клинического состояния на фоне приема препарата сопровождалось достоверным снижением уровня аммиака в крови (медиана снижения: -17,50 ммоль/л (от -27,73 до -7,26); p=0,008) [1, 13].
• Demura S. et al. в двойном слепом плацебо-контролируемом исследовании изучали влияние L-орнитин-L-аспартата на переносимость велотренировок, скорость истощаемости и метаболизм аммиака во время и после тренировки у здоровых волонтеров. Концентрация аммиака в плазме сразу после и через 15 мин после дополнительных нагрузок в группе L-орнитин-L-аспартата была значительно ниже, чем в группе плацебо. Таким образом, препарат увеличивал способность аммиачного буфера как в течение, так и после тренировки [1, 2, 14].
• Гепатопротективные свойства L-орнитина-L-аспартата показаны в отношении пациентов с хроническими заболеваниями печени различной этиологии [1, 2, 15–18]. Данные многоцентрового нерандомизированного проспективного когортного исследования (1167 пациентов с хроническими заболеваниями печени, в том числе 648 больных НАЖБП на стадии стеатогепатита) продемонстрировали эффективность и хорошую переносимость L-орнитина-L-аспартата [1, 2, 18].
• Как уже отмечалось, нарастание концентрации аммиака выявляется у больных с ХЗП уже на доцирротической стадии [15]. При этом у больных НАЖБП с 0–1 стадией фиброза на фоне применения L-орнитин-L-аспартата исходно имевшаяся гипераммониемия существенно снижалась и сопровождалась улучшением общего состояния и лабораторных показателей [1, 2].
• В другом российском исследовании с использованием реогепатографии было убедительно показано нарушение портального кровотока при гипераммониемии у больных с доцирротическими стадиями хроническими заболеваниями печени [1, 2, 19]. Лечение 289 пациентов с неалкогольным стеатогепатитом с использованием L-орнитина-L-аспартата на протяжении 3 мес на фоне хорошей переносимости и высокого комплаенса больных способствовало снижению уровней аммиака, коррелирующему с уменьшением сосудистых нарушений, статистически значимому улучшению клинико-биохимических показателей и повышению качества жизни [1, 2, 20]. L-орнитин-L-аспартат улучшал показатели внутрипеченочного кровотока у пациентов с различными типами нарушений портопеченочной гемодинамики. Улучшение печеночного кровотока может быть обусловлено в том числе деактивацией звездчатых клеток печени и снижения их контрактильности [1, 2].
• Прием L-орнитина-L-аспартата предотвращает дорожно-транспортные нарушения у водителей с хроническим гепатитом С и минимальным фиброзом печени [1, 2, 5].
• Коррекция гипераммониемии с помощью L-орнитина-L-аспартата потенцирует эффекты альфа-бета-адреноблокатора карведилола у больных с недостаточностью кровообращения у больных с алкогольной болезнью печени [1, 21].
• Таким образом, механизм действия L-орнитина-L-аспартата и данные клинических исследований указывает на целесообразность его включения в схему лечения больных как с печеночной недостаточностью (особенно осложненной ПЭ), так и доцирротической и нецирротической гипераммониемией на самых ранних стадиях патологии [1, 2]. Применение L-орнитина-L-аспартата у больных печеночной недостаточностью и ПЭ улучшает функцию не только гепатоцитов, но и нейронов [102].
• Показания к применению L-орнитин-L-аспартата включают острые и хронические заболевания печени, сопровождающиеся гипераммониемией, ПЭ (латентную и явную), стеатозы и стеатогепатиты (различного генеза). Режим приема препарата в зависимости от тяжести гипераммониемии отражен в таблице 2.

3.
• Основная цель назначения антибиотиков больным с гипераммониемией и ПЭ – подавление уреаза-продуцирующей кишечной микрофлоры [1, 2, 23]. Предпочтение отдается невсасывающемуся антибиотику широкого спектра действия рифаксимину-альфа. Он активен в отношении большинства как грамположительных, так и грамотрицательных, как аэробных, так и анаэробных бактерий. Препарат практически не всасывается в ЖКТ, при пероральном приеме натощак в крови обнаруживается не более 1% от принятой дозы. Минимальное всасывание действующего вещества в плазму крови снижает риск возникновения системных побочных эффектов, внекишечных лекарственных взаимодействий с другими препаратами, поэтому у пациентов с заболеваниями печени нет необходимости в коррекции дозы [1, 2].
• Положительное влияние рифаксимина-альфа на лечение гипераммониемии показано в нескольких клинических исследованиях [1, 2, 24, 25]. Эффективность применения этого лекарственного средства при лечении ПЭ была более высокой, чем при использовании невсасывающихся дисахаридов [1, 2]. Рекомендуемая взрослым ежедневная доза 1200 мг/сут, как правило, разделяется на три приема, длительность лечения составляет 7–10 сут, повторение таких курсов рекомендуется проводить ежемесячно на протяжении длительного времени, при необходимости постоянно [1, 2, 24, 25].
4.
• Применение пробиотиков позволяет конкурентно вытеснять уреаза-продуцирующие патогенные бактерии в кишечнике. Результаты исследований по оценке влияния пробиотиков на ПЭ [1, 2, 24, 25] показали, что они уменьшают проницаемость кишечника и секрецию бактериальной уреазы, увеличивают выделение аммиака, улучшают метаболический потенциал эпителия кишечника, играют роль в снижении концентрации аммиака в портальной крови, поскольку ингибируют бактериальную уреазную активность [1, 2].
• Поскольку большинство пробиотиков продуцирует кислоты, которые снижают рН в кишечнике, абсорбция аммиака уменьшается [1, 2, 26]. Кроме того, пробиотики способствуют уменьшению воспаления и окислительного стресса в клетках печени, что приводит к увеличению печеночного клиренса аммиака и уменьшению поглощения других токсинов [1, 2].
• В метаанализе 21 рандомизированного клинического исследования с участием 1420 пациентов с ПЭ показано, что пробиотики уменьшают клинические проявления ПЭ, повышают качество жизни больных и способствуют снижению концентрацию аммиака в плазме, но не влияют на показатель смертности [1, 2, 27]. Пероральный прием штаммов пробиотиков вида Lactobacillus снижает уровень аммиака в крови у пациентов с циррозом печени [1, 2, 28]. Штамм бактерий Lactobacillus acidophilus модифицирует кишечную флору, улучшает когнитивные функции у пациентов с циррозом печени, а штамм Enterococcus faecium SF68 повышает толерантность к белковой нагрузке, способствует достижению более низкого уровня аммиака, а также улучшает психическое состояние и психометрические показатели при длительном лечении пациентов с циррозом печени и ПЭ 1–2 степени [1, 2, 29, 30].
• Высококонцентрированные комбинации пробиотических штаммов (Bifidobacterium sp., Lactobacillu ssp., Streptococcus thermophilus) у пациентов с циррозом и ПЭ оказывают существенное влияние на степень гипераммониемии [1, 2].
• В настоящее время пробиотики остаются второй или третьей линией терапии гипераммониемии и ПЭ. В то же время пребиотики лактитол и лактулоза при лечении ПЭ в ряде ситуаций могут быть средством выбора [1, 2].
• Эксперты отмечают, что, помимо заболеваний печени, пока не получено доказанных корреляций между уровнем гипераммониемии и клинической картиной заболевания. Модели энцефалопатии и фиброза печени являются наиболее изученными и требуют вдумчивого и дифференцированного подхода к избранным способам лечения. Выявление причин повышения конечных продуктов метаболизма азота должно способствовать коррекции патологического процесса через воздействие на все звенья патогенеза [1, 2].



