В настоящее время ожирение приобрело характер глобальной пандемии и стало сложной проблемой здравоохранения. Так, по данным Всемирной организации здравоохранения (ВОЗ), в 2016 г. более 650 млн взрослых (13% мирового населения) страдали этим заболеванием [1].
Значительная распространенность ожирения привела к росту заболеваемости неалкогольной жировой болезнью печени (НАЖБП), которая диагностируется у 14–27% населения развитых стран. Неалкогольный стеатогепатит (НАСГ) развивается примерно в 5–20% случаев НАЖБП, в дальнейшем у 10–20% пациентов формируется тяжелая стадия фиброза [2]. В масштабном амбулаторном исследовании было показано, что жировая дистрофия печени, по данным сонографии, была широко распространена в Азии среди лиц старше 65 лет: она встречалась у более 40% этой популяции [3]. Российское амбулаторное исследование DIREG2 продемонстрировало наличие НАЖБП у 37,3% обследованных пациентов, среди которых у 24,4% определялся стеатогепатит, у 2% – цирроз печени [4].
Широко обсуждается вопрос о генетической детерминированности ожирения в целом и НАЖБП в частности. Многие масштабные эпидемиологические, семейные и близнецовые исследования установили большое значение генетических факторов при НАЖБП и стеатогепатите [5–7]. Доказана также роль этнической принадлежности в предрасположенности к НАЖБ и НАСГ [8]. Так, латиноамериканцы имеют более высокий риск заболеть НАЖБП, чем европейцы, а вот африканцы защищены от этой патологии независимо от присутствия диабета и избыточной массы тела [5]. Предполагается влияние на развитие НАЖБП полиморфизма разных генов: гена PNPLA3 (пататин-подобный фосфолипазный домен 3/адипонутрин); генов, кодирующих микросомальный триглицеридный трансферный протеин, эндотоксиновый рецептор CD14, ангиотензин, фактор некроза опухоли-α, трансформирующий фактор роста-β1, супероксиддисмутазу-2, фосфатидилэтаноламинотрансферазу и многих других [9, 10]. Наличие этих мутаций способно повышать риск развития НАСГ и/или усиливать печеночный фиброгенез.
Ген FTO (fat mass and obesity associated) кодирует альфа-кетоглутарат-зависимую диоксигеназу, обладающую широкой сферой компетенций (в их числе деметилирование РНК и одноцепочечных ДНК), имеющих существенное значение для функционирования организма [11]. Полиморфизмы гена FTO выступают мощными генетическими факторами, предрасполагающими к развитию ожирения [12, 13]. Генетическая изменчивость в локусе FTO вносит значительный вклад в этиологию ожирения, инсулинорезистентности и повышенного уровня лептина в плазме [14]. Аллель А гена FTO (rs9939609) ассоциирован с избыточной массой тела, сниженным липолизом, нарушением контроля аппетита и развитием сахарного диабета (СД) 2-го типа. В исследовании полиморфизма гена FTO rs9939609 у 425 человек из разных регионов Центральной России выявлено, что АА-генотип ассоциирован с абдоминальным ожирением, гипергликемией, артериальной гипертензией (АГ), увеличением окружности талии и массы тела в сравнении с носителями генотипов ТА и ТТ [15]. В другом исследовании было обнаружено, что присутствие генотипа AA гена FTO rs9939609 увеличивало вероятность развития ожирения в 2,4 раза [16].
В то же время роль полиморфизма гена FTO в развитии НАЖБП и особенно стеатогепатита изучена недостаточно. Последние данные свидетельствуют, что экспрессия FTO повышена в печени пациентов с НАЖБП и в экспериментальных моделях НАЖБП на животных [17, 18]. Сверхэкспрессия FTO вызывает увеличение накопления липидов в клетках печени человека L02 и HepG2 [19]. В исследовании, проведенном на китайской мужской популяции, ген FTO был связан с наличием и тяжестью НАЖБП, а доказанная зависимость 9 тестируемых полиморфизмов единичного нуклеотида (ПЕН) с НАЖБП, по мнению авторов, скорее всего, была опосредована ожирением [20]. Дальнейший анализ роли полиморфизмов гена FTO может внести значительный вклад в изучение механизмов развития НАЖБП.
Цель нашего исследования – определить распространенность полиморфизма гена FTO и его клиническое значение у больных НАЖБП, ассоциированной с ожирением.
МАТЕРИАЛ И МЕТОДЫ
Было обследовано 114 пациентов с НАЖБП – 56 женщин и 58 мужчин. Средний возраст участников составил 51,4±1,3 лет. Всем больным выполнялось общеклиническое исследование с обязательным измерением антропометрических параметров, а также стандартное лабораторно-инструментальное обследование. В исследование включались только пациенты с ожирением или избыточной массой тела. Чаще всего больные имели 1-ю степень ожирения – 33,3% (n=38 чел.); реже диагностировались 2-я и 3-я степени ожирения – 27,2 (n=31) и 16,7% (n=19) соответственно. Избыточная масса тела имелась у 26 человек (22,8%). Средний показатель индекса массы тела (ИМТ) составил 35,46±0,92 кг/м2.
У пациентов с НАЖБП отмечались изменения показателей липидограммы: повышение средних значений общего холестерина (5,83±0,23 ммоль/л), холестерина липопротеидов низкой плотности (ХС ЛПНП: 3,6±0,22 ммоль/л) и триглицеридов (2,85±0,35 ммоль/л). Более половины участников (57,9%) имело повышение активности аминотрансфераз не более 1,5 норм (нормальные или субнормальные показатели), у 35 человек (30,7%) была выявлена умеренная биохимическая активность (аланинаминотрансфераза от 1,5 до 3 норм) и только у 13 больных (11,4%) показатели трансаминаз демонстрировали более чем 3-кратное увеличение.
При ультразвуковом исследовании печени стеатоз 1-й степени был обнаружен у 40 (35,1%), 2-й степени – у 46 (40,3%), 3-й степени – у 28 (24,5%) человек. По данным эластометрии печени, фиброз F0–1 регистрировался у 45 (39,5%), F2 – у 40 (35,1%), F3 – у 26 пациентов (22,8%); в трех случаях (2,6%) плотность ткани печени превышала 12,5 кПа, что позволяло диагностировать уровень фиброза F4.
37 больным была проведена пункционная биопсия печени. По ее данным, у 19 участников (51,3%) был верифицирован НАСГ. Эти больные имели по шкале NAS-II более 5 баллов.
35 пациентов (31%) страдали сопутствующей АГ. У 30 больных (26,3%) было диагностировано нарушение толерантности к глюкозе, у 28 (24,5%) – СД 2-го типа. Средние значения НОМА-индекса оказались равны 4,8 (4,2–7,2), что служило свидетельством инсулинорезистентности.
Критериями исключения из исследования были употребление алкоголя в гепатотоксических дозах, наличие маркеров вирусных гепатитов, аутоиммунный гепатит, СД 1-го типа или инсулинопотребный СД 2-го типа. Также в исследование не включались пациенты с циррозом печени классов В или С по Чайлд–Пью.
Группа сравнения состояла из 72 здоровых лиц с ИМТ <25 кг/м2 и была сопоставима с исследуемыми больными по полу и возрасту (35 женщин, 37 мужчин, средний возраст 47,1±3,45 лет). Все участники группы сравнения не имели компонентов метаболического синдрома и тяжелых сопутствующих соматических заболеваний.
Олигонуклеотидный полиморфизм Т/А гена FTO (rs9939609) определяли с помощью аллель-специфической полимеразной цепной реакции (тест-системы ООО НПФ «Литех») с последующей электрофоретической детекцией. Молекулярно-генетические исследования проводились в лаборатории научно-исследовательского отдела «Центр персонизированной медицины» Ставропольского государственного медицинского университета.
Все полученные результаты были статистически обработаны посредством компьютерных программ IBM SPSS Statistics 21. При нормальном распределении данных количественные значения представлены в виде средней ± стандартная ошибка средней (Х sx). Вычисление критерия Стьюдента использовалось при сравнительном анализе у групп с нормальным распределением. Для сравнения данных в группах с ненормальным распределением данных применялся U-критерий Манна–Уитни. Различия считались достоверными при p ≤0,05. Данные по встречаемости генотипов FTO, представленные абсолютными значениями (n) и долями, анализировались в двух независимых группах с помощью критерия хи-квадрат.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У пациентов с НАЖБП чаще встречался генотип АА (rs9939609) FTO-гена, чем в группе сравнения среди здоровых лиц с нормальной массой тела (табл. 1). Генотип ТТ, напротив, достоверно чаще наблюдался в группе здоровых, при этом гетерозиготный генотип ТА отмечался с одинаковой частотой в обеих группах. Для анализа влияния полиморфизма гена FTO на ИМТ мы разделили пациентов на 2 подгруппы:
- 1-я – избыточная масса тела + ожирение 1 степени (n=64);
- 2-я – ожирение 2-й и 3-й степеней (n=50).

Было выявлено, что в 1-й подгруппе генотип АА встречался реже, чем при ожирении 2-й и 3-й степеней: 0,13 против 0,34 (р=0,01). Генотип ТТ в 1-й подгруппе наблюдался гораздо чаще (0,72), чем во 2-й (0,38; р=0,005). В то же время доли гетерозиготного варианта ТА практически не различались: 0,15 и 0,28 соответственно (р >0,1). Выраженное ожирение (>2-й степени) было ассоциировано с аллелем А, доля которого у этих лиц составила 0,48, тогда как у пациентов 1-й подгруппы она была равна 0,2 (р=0,0005).
О большей распространенности генотипа АА среди лиц с ожирением в России по сравнению со здоровыми людьми сообщали и другие авторы [15, 16, 21]. При этом существуют региональные особенности. Так, у населения Арктической зоны нашей страны частота встречаемости аллеля А полиморфизма rs9939609 гена FTO составила 30,8%, что было ниже на 15%, чем у популяции центральных регионов России, а также американцев европейского происхождения и европейцев [21]. Несколько ниже, чем в других исследованиях, в нашей группе сравнения была доля генотипа АА и аллеля А. Однако следует учесть, что в эту группу включались лица с ИМТ ниже 25. Имеются литературные данные о связи ПЕН гена FTO с развитием НАЖБП. Так, у ВИЧ-инфицированных пациентов наблюдалась взаимосвязь трех ПЕН (rs8050136, rs9939609 и rs9940128) с наличием жировой болезни печени, причем наиболее сильную ассоциацию демонстрировал полиморфизм rs9940128. Был сделан вывод, что вариации генотипа FTO могут служить предикторами НАЖБП независимо от метаболических факторов [22].
Анализ показателей обмена липидов, в зависимости от генотипа FTO, показал, что у больных с неблагоприятными генотипами (суммарно гетерозиготный генотип ТА и гомозиготный АА) имелось сравнительно более высокое содержание триглицеридов в крови, чем у лиц с генотипом ТТ (табл. 2). Также наблюдалась тенденция (недостоверная) к повышению уровня ХС ЛПНП. Не было установлено различий в других показателях липидограммы в сравниваемых подгруппах – общего холестерина и холестерина липопротеидов высокой плотности. Связь гена FTO с обменом липидов изучалась и в условиях эксперимента, и в клинике. Известно, что экспрессия FTO в печени коррелирует с экспрессией генов, участвующих в липидном обмене и контролирующих липогенез и окисление жирных кислот у крыс. Сверхэкспрессия FTO приводит к увеличению накопления липидов в клетках печени человека L02 и HepG2 [17, 19, 23].
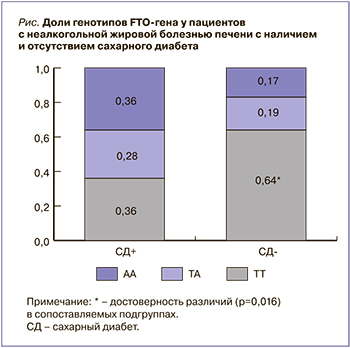
Была изучена взаимосвязь полиморфизмов гена FTO с развитием СД. У пациентов с сопутствующим СД 2-го типа (n=38) реже встречался благоприятный генотип ТТ, чем у лиц без этого заболевания (рис.). При этом аллель А чаще наблюдался в группе больных с НАЖБП, имеющих СД (у половины пациентов), тогда как у пациентов без диабета доля аллеля А составила 0,27 (р=0,002). Значимая ассоциация минорного аллеля А FTO rs9939609 и риска СД 2-го типа отмечали и другие исследователи у палестинского населения [24]. В то же время в Ираке было обнаружено, что, напротив, наличие аллеля Т в двух олигонуклеотидных полиморфизмах (rs9939609 и rs17817449) гена FTO ассоциировано с повышенным риском развития СД 2-го типа у лиц с ожирением [25].
У 37 пациентов с НАЖБП, которым была проведена биопсия печени, проанализированы доли генотипов FTO-гена в зависимости от диагностированного НАСГ или простого стеатоза. При стеатогепатите чаще встречался генотип АА (0,32) сравнительно со случаями стеатоза печени (0,17), однако эта тенденция была статистически недостоверна из-за небольшого объема выборок. Тем не менее аллель А встречался в 2 раза чаще при НАСГ, и это различие было достоверным (р=0,048). Известно, что НАСГ характеризуется избыточным накоплением жира в печени, повышенной липотоксичностью в гепатоцитах и последующим воспалением. Экспрессия ассоциированного с жировой массой и ожирением гена FTO была значительно повышена как в печени пациентов с НАСГ, так и при моделировании стеатогепатита в эксперименте у грызунов; это позволило сделать вывод, что повышенная активность данного гена может способствовать усилению повреждения печени при НАСГ. Предполагается, что дополнительным фактором повреждения здесь может служить липополисахарид, который индуцирует воспаление и вызывает нарушение липидного обмена печени [18, 23].
ЗАКЛЮЧЕНИЕ
У больных НАЖБП, ассоциированной с избыточной массой тела и ожирением, полиморфизм гена FTO (rs9939609) Т/А встречается чаще, чем в здоровой популяции. Генотип АА и аллель А при ожирении 2-й и 3-й степеней распространен больше, а генотип ТТ меньше, чем у лиц с ожирением 1-й степени и избыточной массой тела. Неблагоприятные генотипы FTO-гена ТА и АА ассоциированы с высоким содержанием триглицеридов в крови. При сопутствующем СД 2-го типа у пациентов с НАЖБП чаще наблюдается аллель А и реже генотип ТТ. Развитие НАСГ чаще возникает при наличии аллеля А FTO-гена. Проведенные исследования свидетельствуют о важной роли полиморфизма гена FTO (rs9939609) Т/А в патогенезе ожирения и НАЖБП.


