Диагностика
1
Острый коронарный синдром (ОКС) – термин, которым обозначают любую группу клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда (ИМ) со стойкими подъемами сегмента ST или острый ИМ без стойкого подъема сегмента ST или нестабильную стенокардию. Он используется, когда диагностической информации для окончательного суждения о наличии или отсутствии очагов некроза в миокарде еще недостаточно, и, следовательно, представляет собой предварительный диагноз в первые часы и сутки заболевания, в то время как термины «ИМ» и «нестабильная стенокардия» используются при формулировании заключительного диагноза. Соответственно термин «ОКС» может использоваться на догоспитальном или раннем госпитальном этапах и в дальнейшем трансформируется в диагноз «острый ИМ», «нестабильная стенокардия» либо по результатам дифференциальной диагностики в любой другой диагноз, в том числе не кардиологический [1].
2
• Для ишемии миокарда характерны чувство сжатия, давления или тяжести за грудиной, которые иногда описываются пациентом как дискомфорт. Возможны иррадиация в левую руку, левое плечо, горло, нижнюю челюсть, эпигастрий, а также нетипичные клинические проявления, такие как потливость, тошнота, боль в животе, одышка, потеря сознания, которые в некоторых случаях являются единственными или доминирующими [1].
• При ОКС симптомы, как правило, сходны по характеру с возникающими при приступе стабильной стенокардии, но отличаются по силе и продолжительности; в ряде случаев они не купируются полностью приемом нитроглицерина, а иногда даже повторными инъекциями наркотических анальгетиков. Интенсивность болевого синдрома может быть различной – от незначительной до невыносимой; симптомы могут носить волнообразный характер и продолжаться от 20 мин до нескольких часов [1].
• В клинической картине ОКС (ИМ) со стойкими подъемами сегмента ST (ИМпST) могут присутствовать, а иногда и преобладать симптомы его основных осложнений – острой сердечной недостаточности (отек легких, шок), выраженной брадикардии или тахикардии [1].
• Одним из возможных проявлений ИМ, иногда единственным доступным для врачебной оценки, может быть набор симптомов, которые характерны для остановки кровообращения, вызванной желудочковой тахикардией, фибрилляцией желудочков, асистолией или электромеханической диссоциацией. У больных со спонтанно разрешившейся остановкой кровообращения ведущим симптомом может выступать угнетений сознания разной степени [1].
3
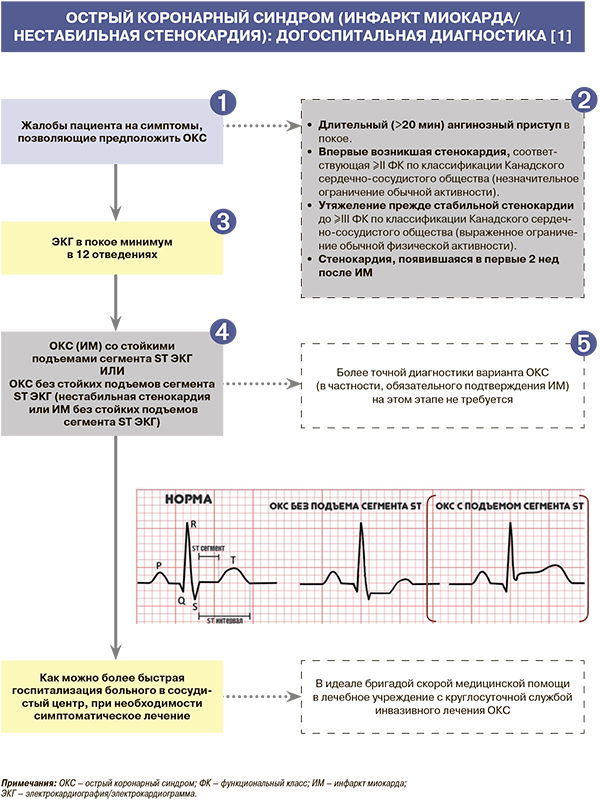
У всех пациентов с подозрением на ОКС рекомендуется в течение 10 мин на месте первого контакта с медицинским работником (как правило, догоспитально) зарегистрировать и интерпретировать электрокардиограмму (ЭКГ) в покое как в минимум в 12 стандартных отведениях и безотлагательно интерпретировать ее квалифицированным врачом. При невозможности квалифицированно интерпретировать ЭКГ на месте ее регистрации рекомендуется наладить систему ее дистанционной передачи и консультирования [1].
4
• ОКС со стойкими подъемами сегмента ST (ОКСпST) констатируют в тех случаях, когда в дополнение к клинике выявляются стойкие (>20 мин) подъемы сегмента ST на ЭКГ. Поскольку при ОКСпST обычно в итоге диагностируют ишемический некроз (инфаркт) миокарда, эту форму ОКС часто с самого начала называют ИМпST [1].
• Остальные случаи (включая отсутствие новых изменений ЭКГ) обозначают как ОКС без стойких подъемов сегмента ST (ОКСбпST). Для ОКСбпST (ИМ без подъема ST/нестабильной стенокардии) характерны ЭКГ-признаки ишемии миокарда, о которой свидетельствуют преходящие (<20 мин) подъемы сегмента ST как минимум в двух смежных отведениях ЭКГ, а также преходящие или стойкие депрессии ST (особенно горизонтальные или косонисходящие) как минимум на 0,05 мВ. Выраженные (≥0,2 мВ) симметричные отрицательные зубцы T в прекордиальных отведениях также предполагают наличие острой ишемии миокарда. К неспецифическим признакам относят смещение сегмента ST <0,05 мВ и инверсию зубца T <0,1 мВ [1].
• Отсутствие ишемических изменений на ЭКГ не должно исключать диагноз ОКСбпST. Важный диагностический прием – сравнение с ЭКГ, зарегистрированной до наступления настоящего приступа (если таковая доступна) [1].
• Если изменения на ЭКГ в 12 стандартных отведениях неинформативны, а по клиническим данным предполагается наличие ишемии миокарда, рекомендуется использовать дополнительные отведения, такие как V7–V9, V3R–V4R. При неинформативной ЭКГ у пациентов с сохраняющимся подозрением на ОКС, продолжающимися или возобновляющимися симптомами, для своевременного выявления ишемических изменений на ЭКГ рекомендуется регистрировать повторно (например, с интервалами в 15–30 мин в течение первого часа) или начать дистанционное мониторирование ЭКГ с оценкой смещений сегмента ST в 12 отведениях, если это технически возможно [1].
• Использование дополнительных отведений ЭКГ V7–V9 рекомендуется у больных с подозрением на ИМ нижнебазальной локализации, V3R и V4R – при подозрении на ИМ правого желудочка. Для отведений V7–V9 диагностичными служат подъемы ST 30,05 мВ (30,1 мВ у мужчин моложе 40 лет). В сложных случаях возможно регистрация ЭКГ и в других отведениях (на 2 ребра выше и т.д.). Депрессия сегмента ST >0,1 mV в ≥8 отведениях при подъеме сегмента ST в отведении aVR и/или V1 предполагает поражение ствола левой коронарной артерии (КА) или многососудистое поражение бассейна левой КА [1].
5
ОКС – предварительный диагноз, необходимый для быстрого выбора подходов к маршрутизации больного. Выявление ИМ обычно требует дополнительного времени, необходимого для оценки как минимум динамики ЭКГ и уровня биомаркеров некроза миокарда в крови (предпочтительно сердечного тропонина), которые проводятся после госпитализации. Прочие исследования (коронарная ангиография и др.), в том числе для дифференциальной диагностики, также выполняются в стационаре [1].
Лечение
1
• Пациенты с ОКСпST (далее – ИМпST) нуждаются в длительном приеме оральных антикоагулянтов (ОАК) только при наличии следующих сопутствующих заболеваний/ состояний [1]:
- фибрилляции предсердий (ФП) в сочетании с умеренным/тяжелым митральным стенозом;
- механических протезов клапанов сердца;
- неклапанной ФП с суммой баллов по шкале CHA2DS2-VASc ≥2 у мужчин или ≥3 у женщин;
- тромбозов глубоких вен/тромбоэмболии легочной артерии, требующих лечения антикоагулянтами;
- тромба в левом желудочке.
• При необходимости продолжительного приема ОАК пациентам с ИМпST, подвергнутым чрескожному коронарному вмешательству (ЧКВ), рекомендована тройная антитромбоцитарная терапия ОАК + ацетилсалициловая кислота (АСК) + клопидогрел [1, 2].
• Согласно рекомендациям Европейского общества кардиологов (ESC) и Европейской ассоциации кардиоторакальной хирургии (EACTS), у пациентов с ЧКВ длительность тройной антитромбоцитарной терапии составляет до 6 мес при преобладании риска ишемических событий (класс доказательств IIaB) и до 1 мес при превалировании риска кровотечений (IIaB). Далее производится перевод пациента на двойную комбинацию ОАК + АСК или ОАК + клопидогрел сроком до 12 мес от начала терапии (IIaA), а в последующем – на монотерапию ОАК (IIaB). Еще один вариант антитромбоцитарного лечения больных ИМпST с преобладанием риска кровотечений, нуждающихся в использовании ОАК, – прием ОАК + клопидогрела в первые 12 мес (IIaA) с дальнейшим переходом на монотерапию ОАК (IIaB) [2].
• В соответствии с клиническими рекомендациями Российского кардиологического общества при участии Ассоциации сердечно-сосудистых хирургов России по ведению острого ИМпST длительность тройной антитромбоцитарной терапии в целях снижения риска геморрагических осложнений рекомендуется ограничить несколькими днями (1–7 дней) с последующей отменой АСК. Двойная антитромботическая терапия (ОАК + клопидогрел) в этом случае используется до 12 мес, после чего клопидогрел отменяется, и продолжается монотерапия ОАК в целевой дозе для профилактики тромбоэмболических событий (у пациентов с ФП) дозе: класс/уровень доказательности этой рекомендации, согласно Европейскому обществу кардиологов (EOK) – IIaB; уровень убедительности рекомендаций (УУР) – B, уровень достоверности доказательств (УДД) – 2 [1].
• У пациентов с ИМпST и ФП, нуждающихся в сочетании ОАК и антитромбоцитарных препаратов, для снижения риска кровотечений рекомендуется использовать не варфарин, а «новые» ОАК (ривароксабан/апиксабан/дабигатрана этексилат), если к ним нет противопоказаний: ЕОК IB (УУР А; УДД 1) [1, 3].
2
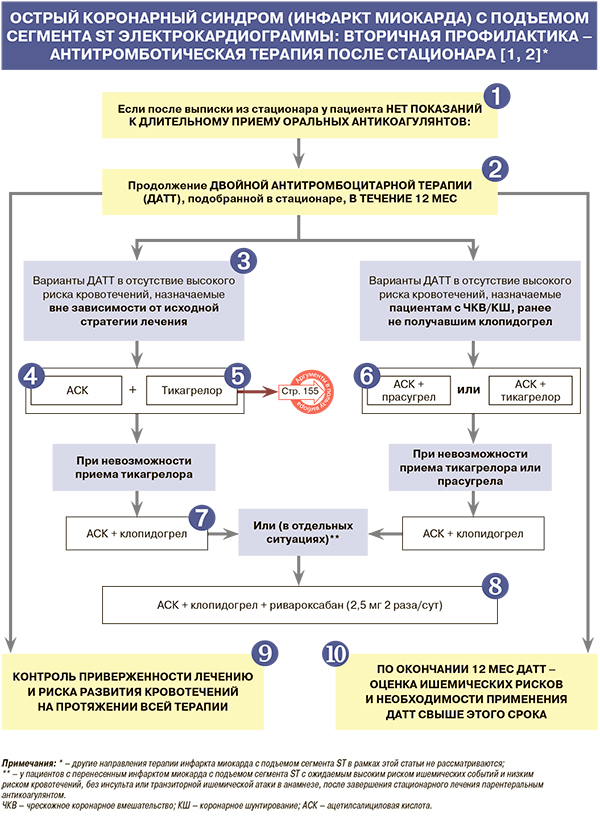
Всем пациентам с ИМпST без высокой вероятности кровотечений для снижения суммарного риска смерти, ИМ и ишемического инсульта в добавление к АСК рекомендуется прием ингибитора Р2Y12-рецептора тромбоцитов (двойная антитромбоцитарная терапия): ЕОК IA (УУР А; УДД 2) [1, 2, 4, 5]. Такую терапию рекомендуется продолжать на протяжении 12 мес независимо от стратегии реперфузии, методики ЧКВ и типа установленных стентов при условии, что у пациента нет исходно очевидного высокого риска кровотечений: ЕОК IA (УУР А; УДД 1) [1, 2, 4, 5].
3
Формулировка «вне зависимости от исходной стратегии лечения» подразумевает возможность назначения соответствующих вариантов двойной антитромбоцитарной терапии (ДАТТ) пациентам, подвергнутым ЧКВ/коронарному шунтированию (КШ)/ получавших ранее клопидогрел [2].
4
• Всем пациентам с ИМпST, не имеющим противопоказаний, вне зависимости от исходной стратегии лечения (реперфузии) для снижения риска смерти, сосудистой смерти, повторного ИМ и ишемического инсульта рекомендуется длительный (неопределенно долгий) прием АСК: ЕОК IA (УУР А; УДД 1) [1, 2, 6].
• У больных, в последнюю неделю регулярно не принимавших АСК, рекомендуется начальная (нагрузочная) доза 150–325 мг; постоянная поддерживающая этого антиагреганта составляет 75–100 мг 1 раз/сут [1, 2].
5
• Прием тикагрелора в добавление к АСК в течение 12 мес рекомендован пациентам с ИМпST для снижения суммарного риска (смерти и ИМ), риска тромбоза стента при отсутствии противопоказаний к препарату (внутричерепное кровоизлияние в анамнезе, продолжающееся кровотечение) вне зависимости от начальной стратегии лечения и предшествующего использования клопидогрела: ЕОК IA (УУР А; УДД 1); ESC/EACTS – IB [1, 2, 7].
• Нагрузочная доза тикагрелора составляет 180 мг, поддерживающая – 90 мг 2 раза/сут [1, 2, 7]. У больных, ранее получавших клопидогрел, последний в случае назначения тикагрелора отменятся (ESC/EACTS – IB) [2].
6
• Прием прасугрела в течение 12 мес в добавление к АСК рекомендован с целью снижения риска смерти и суммы ишемических событий (смерть, ИМ, инсульт) при коронарном стентировании у пациентов с ИМпST, не получавших других ингибиторов P2Y12-рецептора тромбоцитов и не имеющих противопоказаний к препарату (наличие в анамнезе внутричерепного кровоизлияния, ишемического инсульта/транзиторной ишемической атаки, продолжающееся кровотечение): ЕОК IIaB (УУР А; УДД 2) [1, 2, 8].
• Нагрузочная доза прасугрела составляет 60 мг, поддерживающая – 10 мг/сут [1, 2, 8]. У пациентов старше 75 лет с массой тела ниже 60 кг необходимо снизить суточную дозу этого препарата до 5 мг [1].
7
• Больным с ИМпST, которые не могут получать прасугрел или тикагрелор, для возможного снижения суммарного риска смерти, ИМ и инсульта, а также риска тромбоза стента рекомендуется добавление к АСК клопидогрела: ЕОК IIа B (УУР А; УДД 2) [1, 2, 9]. Согласно рекомендациям ESC/EACTS, этот ингибитор Р2Y12-рецептора также назначается пациентам с ИМпST, имеющим показания к ОАК (IA) [2].
• Нагрузочная доза клопидогрела – 300 (при тромболитической терапии) или 600 (при ЧКВ) мг/сут, поддерживающая – 75 мг/сут [1, 2].
• Наряду с монопрепраратами в России зарегистрирован ряд фиксированных комбинаций АСК и клопидогрела (100 мг + 75 мг и 75 мг + 75 мг) [10].
8
• У больных ИМпST с ожидаемым высоким риском ишемических событий и низким риском кровотечений, не переносивших в прошлом инсульт или ТИА, для снижения риска смерти, снижения суммарного риска смерти, ИМ, инсульта и риска тромбоза коронарных стентов к сочетанию АСК и клопидогрела после завершения лечения парентеральным антикоагулянтом рекомендуется добавить ривароксабан в дозе 2,5 мг 2 раза/сут сроком на 12 мес: ЕОК IIa B (УУР В; УДД 2) [1, 11].
• Добавление ривароксабана в дозе 2,5 мг 2 раза/сут не изучено для ДАТТ, в состав которой входят прасугрел или тикагрелор. Кроме того, к использованию указанной дозы нельзя прибегать у пациентов, нуждающихся в более высоких дозировках ОАК (в частности, при ФП с повышенным риском инсульта). При присоединении ривароксабана 2,5 мг 2 раза/сут к комбинации АСК + клопидогрел следует учитывать потенциальное увеличение вероятности кровотечений, прежде всего внутричерепных [1].
• Добавление ривароксабана в дозе 2,5 мг 2 раза/сут на неопределенно долгое время в рамках вторичной профилактики (снижение суммарного риска ишемических событий и риска смерти) ИМ рекомендуется также пациентам с сохраняющимся высоким коронарным риском, которые получают АСК без блокатора Р2Y12-рецептора тромбоцитов: ЕОК IIa B (УУР В; УДД 2) [1, 12, 13].
9
• При повышенном риске кровотечений рекомендуемая длительность ДАТТ у пациентов, перенесших ИМпST, для снижения этого риска может быть меньше 12 мес: ЕОК IIа A (УУР А; УДД 1) [1, 14, 15]. При этом досрочное прекращение ДАТТ увеличивает частоту коронарных осложнений [1].
• В случае серьезного кровотечения или необходимости экстренной несердечной хирургической операции лечение ингибиторами Р2Y12-рецептора тромбоцитов следует прекратить и возобновить при первой возможности после устранения причин кровотечения. При высоком риске рецидива кровотечения минимальный срок ДАТТ у пациентов с ИМпST составляет 1 мес после установки стента без лекарственного покрытия и 3 мес после установки современных типов стентов, выделяющих лекарственные средства [1].
• Минимальный перерыв и временные рамки возобновления ДАТТ у пациентов, нуждающихся в плановых несердечных хирургических вмешательствах с высоким/ умеренным риском кровотечений, приведен на рисунке. При хирургических вмешательствах с низким риском кровотечения досрочно прерывать ДАТТ не следует [1, 2].
• Если прерывание ДАТТ абсолютно необходимо, следует иметь в виду, что альтернативного более безопасного варианта профилактики тромбоза стента для коронарных артерий не существует. По мере возможности прием АСК следует продолжить, так как отмена обоих препаратов еще больше повышает риск тромбоза [1].
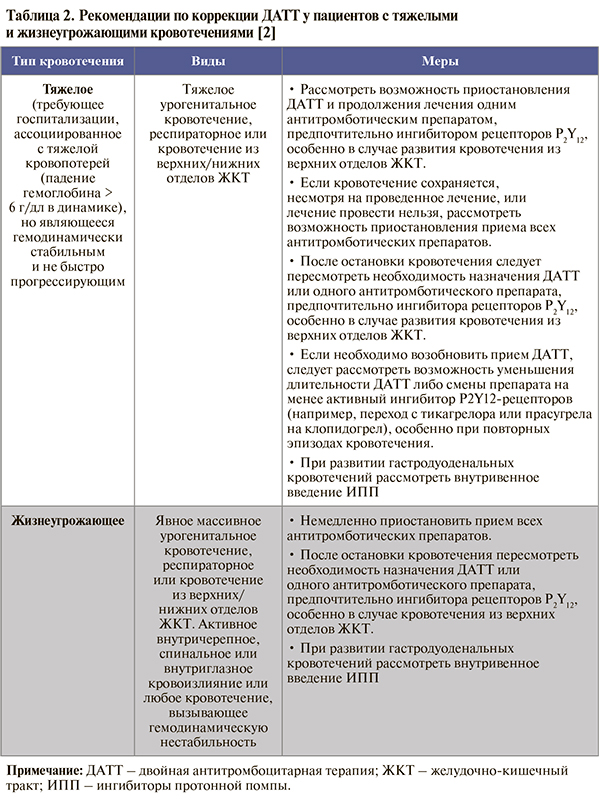
• Принципы коррекции ДАТТ при возникновении различных типов кровотечений в процессе лечения суммированы в таблицах 1 и 2. Наряду с этим в процессе контроля терапии следует осуществлять коррекцию режима применения ОАК (если их прием необходим), своевременную диагностику и коррекцию сопутствующей патологии, вероятно, ассоциированной с кровотечением (например, язвы желудка, геморроидальных кровотечений, опухоли), консультировать пациента на предмет важности соблюдения приверженности терапии, при тяжелых и жизнеугрожающих кровотечениях – оценить необходимость переливания эритроцитарной/тромбоцитарной массы, экстренного хирургического вмешательства или эндоскопической остановки кровотечения в случае, если это будет сочтено возможным [2].
• Для снижения риска кровотечений из верхних отделов ЖКТ во время ДАТТ рекомендуется использовать ингибиторы протонной помпы: ЕОК IIaB (УУР B; УДД 3) [1, 2, 17, 18]. Прием этой группы средств возможен как у всех пациентов, получающих ДАТТ, так и более избирательно, у пациентов с повышенным риском желудочно-кишечных кровотечений (язвенная болезнь или желудочно-кишечное кровотечение в анамнезе, систематическое использование нестероидных противовоспалительных препаратов или кортикостероидов и/или как минимум двух из следующих признаков – возраст ≥65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфекция H. pylory, хроническое употребление алкоголя). При приеме клопидогрела следует учитывать возможность ослабления его антитромбоцитарного эффекта на уровне лабораторной оценки активности тромбоцитов при сочетании с омепразолом или эзомепразолом (но не с пантопразолом или рабепразолом). В то же время нет доказательств, что эти лекарственные взаимодействия оказывают неблагоприятное влияние на клинические результаты лечения [1, 2].

10
• У пациентов с ИМпST с высоким коронарным риском и низким риском кровотечений, не имевших кровотечений в течение первого года лечения, рекомендуется рассмотреть возможность продления ДАТТ (АСК + ингибитор P2Y12-рецептора тромбоцитов) на более длительный срок (>12 мес) для снижения риска смерти, повторного ИМ, суммарного риска ишемических событий: ЕОК IIaB (УУР В; УДД 1) [1, 2, 19]. При этом соотношение пользы и риска продления ДАТТ должно регулярно пересматриваться [1, 2, 19].
• К пациентам с высоким риском коронарных осложнений относят лиц в возрасте ≥50 лет в сочетании как минимум с одним из следующих факторов риска: возраст ≥65 лет; требующий медикаментозного лечения сахарный диабет; ≥2 перенесенных ИМ; многососудистый коронарный атеросклероз; хроническая болезнь почек (ХБП) с расчетной скоростью клубочковой фильтрации (рСКФ) <60 мл/мин/1,73 м2 [1].
• Факторами высокого риска кровотечений являются внутричерепное кровотечение, ишемический инсульт или другая внутричерепная патология в анамнезе; недавнее желудочно-кишечное кровотечение или анемия из-за потери крови через желудочнокишечный тракт (ЖКТ); другая патология ЖКТ с повышенным риском кровотечений; печеночная недостаточность; геморрагический диатез или коагулопатия; старческий возраст или старческая хрупкость; ХБП, требующая диализа, или ХБП при рСКФ <15 мл/мин/1,73 м2 [1].
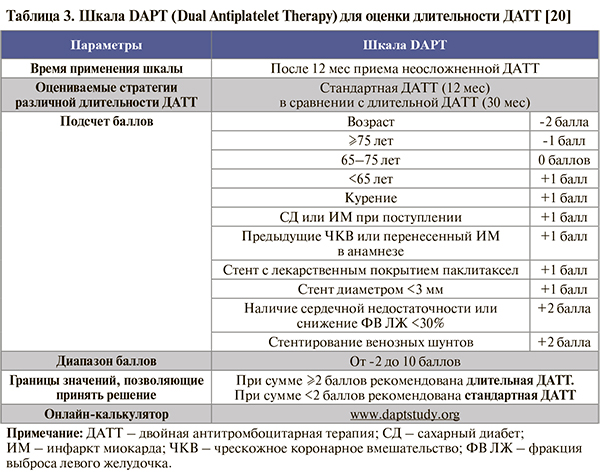
• Для определения длительности ДАТТ после 12 мес терапии можно использовать валидированную шкалу DAPT (табл. 3).
• У пациентов, перенесших ИМ, с сохраняющимся высоким коронарным риском, не имевших кровотечений в первый год ДАТТ, для снижения суммарного риска ишемических событий рекомендуется продление ДАТТ в виде сочетания АСК с уменьшенной дозой тикагрелора (60 мг 2 раза/сут) на дополнительные 36 мес [1, 21, 22]. Согласно рекомендациям ESC и EACTS, у данной группы пациентов прием тикагрелора 60 мг/сут 2 раза/сут в рамках ДАТТ сроком более 12 мес может быть предпочтительнее, чем применение клопидогрела или прасугела (IIbB) [2].



