Диагностика
1
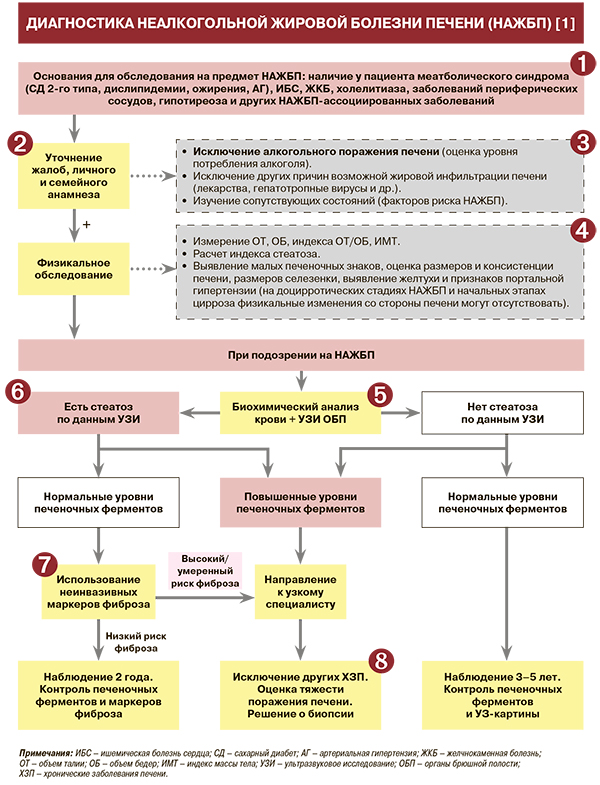
• Для неалкогольной жировой болезни печени (НАЖБП) на стадиях стеатоза, неалкогольного стеатогепатита (НАСГ) и фиброза в большинстве случаев характерно бессимптомное течение. Зачастую НАЖБП становится диагностической находкой, когда пациенты обращаются к врачу по поводу жалоб, обусловленных коморбидными НАЖБП-ассоциируемыми заболеваниями – метаболическим синдромом (артериальная гипертензия, ожирение, нарушение обмена глюкозы, дислипидемии), ишемической болезнью сердца (ИБС), заболеваниями периферических сосудов, желчнокаменной болезнью, полиартралгиями, фибромиалгиями и др. В 2020 г. было опубликовано международное экспертное консенсусное заявление, предлагающее новое адаптивное понятие – метаболически ассоциированная жировая болезнь печени. По мнению авторов консенсуса, предложенная трактовка заболевания позволяет не только подчеркнуть системность и многофакторность патогенеза унифицированного поражения печеночной паренхимы (например, взаимное сочетание дисметаболических и алиментарно-токсических факторов), но и персонализировать объемы и направления лечебно-диагностической помощи при различных клинических вариантах МАЖБП-ассоциированной коморбидности [1].
• Частым спутником НАЖБП выступает дислипидемия (проатерогенный сывороточный липидный профиль, включающий низкий уровень холестерина липопротеинов высокой плотности (ХС ЛПВП), высокий уровень триглицеридов (ТГ), холестерина липопротеинов низкой плотности (ХС ЛПНП) и аполипопротеина В100), развивающаяся независимо от стадии и степени выраженности заболевания и способствующая прогрессированию поражения печени и развитию сердечно-сосудистых заболеваний (ССЗ): уровень убедительности рекомендаций (УУР) – В, уровень достоверности доказательств (УДД – 1) [1].
2
• Сбор жалоб и анамнеза – необходимый метод для выявления клинических симптомов и наличия факторов риска развития НАЖБП, а также наличия ассоциированных метаболических заболеваний: УУР – А, УДД – 2 [1]. Несмотря на то что это заболевание, как уже говорилось, в большинстве случаев имеет «молчаливый» характер, в ряде случаев жалобы пациентов могут включать следующие клинические симптомы [1]:
- астенический синдром (слабость, повышенная утомляемость, нарушение сна);
- диспепсический синдром (метеоризм, тошнота, нарушения стула);
- болевой синдром (тупые боли и/или тяжесть в правом подреберье);
- гепато- и/или спленомегалию.
При опросе пациента уточняется наличие и выраженность этих симптомов, их взаимосвязь с приемом пищи, режимом труда и отдыха, пищевыми привычками, физическими нагрузками. При этом следует учитывать, что интенсивность предъявляемых жалоб и данные лабораторно-инструментального обследования зачастую не коррелируют со степенью поражения печеночной паренхимы.
• Также в процессе опроса/изучения анамнеза выясняется наличие сопутствующей патологии, в том числе коморбидной (СД 2-го типа, атерогенная дислипидемия, атеросклероз, АГ, ИБС и др.), отягощение наследственного анамнеза [1].
3
• Сбор жалоб и анамнеза необходим для исключения вторичных факторов развития НАЖБП: УУР – А, УДД – 2 [1]. В связи с этим при опросе пациента в обязательном порядке уточняются предшествующий обращению прием лекарственных препаратов (амиодарона, ацетилсалициловой кислоты, глюкокортикоидов, дилтиазема, нифедипина, тамоксифена, метотрексата и др.), а также наличие эпизодов парентерального питания, голодания, быстрого снижения массы тела, воспалительных и иммуноопосредованных заболеваний кишечника, любых хирургических вмешательств (особенно проведенных на органах пищеварения – гастропластики, еюноилеального шунтирования, обширной резекции тонкой кишки и т.п.) [1].
• Исключение алкогольной этиологии является одной из первых задач при выявлении признаков стеатоза печени. Приемлемой дозой употребления алкоголя у пациентов, которым диагностируется НАЖБП, следует считать не более 210 мл этанола в неделю для мужчин и не более 140 мл в неделю для женщин: УУР – В, УДД – 2 [1]. Для исключения алкогольной этиологии и дифференциации между алкогольной болезнью печени и НАЖБП могут быть использованы [1]:
- опрос пациента и его ближайших родственников пациента;
- апробированные опросники для количественной оценки потребления алкоголя;
- определение лабораторных маркеров злоупотребления алкоголем (сывороточной гамма-глутамилтрансферазы (ГГТ), аспарагиновой трансаминазы (АСТ), соотношения АСТ/аланиновой трансаминазы (АЛТ), среднего объема эритроцитов, углевододефицитного трансферрина) и их интерпретация в совокупности с данными анамнеза и других исследований. Отметим, что ГГТ может быть повышена и у лиц с НАЖБП, не злоупотребляющих алкоголем;
- непатентованные расчетные формулы, такие как ALD/NAFLD index (ANI);
- патентованные расчетные формулы, такие как диагностическая панель «ФиброМакс» («АшТест») [1].
4
• Физикальное обследование у пациента с подозрением на НАЖБП должно включать оценку антропометрических данных: УУР – А, УДД – 2 [1]. Необходимо выполнить измерения объема талии (ОТ) и бедер (ОБ), рассчитать индекс ОТ/ОБ, индекс массы тела (ИМТ). Значимыми факторами риска развития НАЖБП следует считать [1]:
- у лиц европеоидной расы – ИМТ ≥25 кг/м2, ОТ ≥102 см для мужчин и ≥88 см для женщин;
- у лиц азиатской расы – ИМТ ≥23 кг/м2, ОТ ≥90 см для мужчин и ≥80 см для женщин.
• Для выявления групп риска стеатоза печени рекомендуется рассчитать индекс стеатоза (St-index – неинвазивный скрининговый метод оценки риска стеатоза печени): УУР – В, УДД – 2 [1]. Для этого необходимы следующие данные о больном: возраст (количество полных лет); СД 2-го типа – есть (1)/нет (0); соотношение объема талии в см к росту в см (Т/Р). Расчетная формула индекса стеатоза (St-index) = -3,5856 + 0,0141 × возраст + 0,4711 × СД 2 типа + 4,4373 × Т/Р. Интерпретация результатов: Y >0,405 – высокий риск стеатоза (специфичность=91,4%); Y <-0,847 – низкий риск стеатоза (чувствительность=93,8%) [1].
• Физикальное обследование у пациента с подозрением на НАЖБП должно быть направлено на выявление малых печеночных знаков, оценку размеров и консистенции печени, размеров селезенки, выявление желтухи и признаков портальной гипертензии: УУР – А, УДД – 2 [1]. У больных с хроническим заболеванием печени (ХЗП) могут быть выявлены характерные «малые печеночные знаки» – телеангиэктазии, пальмарная эритема. Признаком ХЗП также является изменение размеров печени (увеличение на доцирротической стадии и уменьшение на стадии цирроза), заострение края, уплотнение паренхимы. У части больных увеличивается селезенка. Физикальное обследование может выявить наличие расширенных подкожных вен, асцита, отечности нижних конечностей вследствие формирования портальной гипертензии. При всем при этом на доцирротических стадиях и начальных этапах цирроза печени НАЖБП физикальные изменения со стороны печени могут не выявляться или ограничиваться незначительной гепатомегалией [1].
5
• При подозрении на НАЖБП целесообразно определение уровней АЛТ, АСТ, ГГТ, щелочной фосфатазы (ЩФ), общего билирубина – сывороточных показателей, отражающих наличие повреждения печени: УУР – А, УДД – 2 [1]. У больных с НАЖБП примерно в 90% случаев уже на стадии стеатоза выявляется повышение уровня ГГТ в среднем до уровня 3–4 верхних границ нормы (ВГН), АЛТ и АСТ до уровня 4–5 верхних пределов норм ВГН, возможно повышение активности щелочной фосфатазы (ЩФ) [1].
• При развитии воспаления в печени (НАСГ) выявляются признаки цитолиза с повышением АЛТ и АСТ различной степени выраженности, но чаще всего не превышающие 5–7 уровня ВГН при соотношении АСТ/АЛТ <1,3 [1].
• Уровень билирубина повышен, как правило, на стадии цирроза [1].
• Отсутствие изменений в лабораторных маркерах состояния печени не исключает наличие НАЖБП [1].
• При подозрении на НАЖБП рекомендуется определение уровня показателей, отражающих функциональное состояние печени, – количество тромбоцитов, общего белка, альбумина, билирубина, характер коагулограммы: УУР – А, УДД – 2 [1]. Лабораторным признаком формирования стадии цирроза и печеночно-клеточной недостаточности служит снижение белково-синтетической функции печени, что проявляется тромбоцитопенией, гипербилирубинемией, снижением сывороточных уровней общего белка, альбумина, протромбина (ПТИ), а также факторов свертывания крови, синтезирующихся в печени. При выраженных нарушениях в коагулограмме (снижение ПТИ, удлинение активированного частичного тромбопластинового времени и международного нормализованного отношения) диагностируется геморрагический синдром. Ранние стадии цирроза печени не сопровождаются подобными изменениями, поэтому отсутствие изменений в лабораторных параметрах не исключает цирроза [1].
• При подозрении на наличие НАЖБП рекомендуется определение показателей липидного спектра – ТГ, общего холестерина (ОХС), ХС ЛПВП и ХС ЛПНП, апо-В липопротеидов: УУР – А, УДД – 2 [1]. Около 40–50% больных с НАЖБП имеют повышение уровня ТГ, ОХС и ЛПНП с синхронным снижением ЛПВП. Атерогенная дислипидемия требует коррекции для снижения рисков ССЗ и смертности от них [1].
• При подозрении на НАЖБП рекомендуется определение показателей углеводного обмена: измерение уровня глюкозы натощак, инсулина крови натощак, глюкозотолерантный тест по показаниям: УУР – А, УДД – 2 [1]. Не менее 20% больных НАЖБП имеют нарушения углеводного обмена, свидетельствующие о нарушении толерантности к глюкозе, наличии предиабета или СД 2-го типа. Наличие СД 2-го типа у больных НАЖБП повышает риск ССЗ [1].
• При подозрении на НАЖБП рекомендуется оценка наличия и выраженности инсулинорезистентности: УУР – А, УДД – 2 [1]. Наиболее часто применяемый метод оценки инсулинорезистентности – расчет индекса HOMA-IR по формуле I0 × G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/мл), G0 – уровень глюкозы натощак (ммоль/л). У здоровых лиц значение HOMA-IR составляет менее 2,7, при нарушении толерантности к глюкозе, СД 2-го типа – более 4. Значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5 [1].
• При обнаружении у пациентов с НАЖБП в сыворотке крови высоких титров аутоантител (антинуклеарный фактор, антигладкомышечные антитела) в сочетании с другими признаками иммунного воспаления необходимо провести полное обследование для исключения аутоиммунного заболевания: УУР – В, УДД – 1 [1]. У 1/5 пациентов с НАЖБП обнаруживается антинуклеарный фактор (АНФ) и антигладкомышечные антитела, чаще в низких титрах (менее 1:320); при этом гистологические признаки аутоиммуного гепатита не наблюдаются. Однако выявление аутоантител требует тщательного обследования пациента для исключения аутоиммунного заболевания печени. Для исключения аутоиммунного гепатита рекомендованы упрощенные критерии Международной рабочей группы по аутоиммунному гепатиту, использование которых требует определения аутоантител, исключения вирусных гепатитов, определения IgG, гистологического исследования ткани печени [1].
6
• Скриниговым методом выявления стеатоза печени при подозрении на НАЖБП является ультразвуковое исследование (УЗИ). Наличие признаков стеатоза печени по данным УЗИ после исключения других причин его развития позволяет установить диагноз НАЖБП: УУР – А, УДД – 2 [1]. Наибольшее распространение среди визуальных методов диагностики НАЖБП УЗИ получило в виду своей доступности и возможности с высокой чувствительностью и специфичностью выявить стеатоз в печени и оценивать изменения в динамике [1].
• Основные ультразвуковые признаки стеатоза печени [1]:
- дистальное затухание эхосигнала;
- диффузная гиперэхогенность печени («яркая белая печень»);
- увеличение эхогенности печени по сравнению с почками;
- нечеткость и обеднение сосудистого рисунка.
• Наличие признаков стеатоза по данным УЗИ при неизменных лабораторных тестах и исключении других этиологий стеатоза служит достаточным критерием для постановки диагноза НАЖБП, поскольку результаты биохимического анализа крови не всегда отражают наличие или отсутствие стеатоза печени и/или НАСГ [1].
• Наличие и стадия фиброза печени при НАЖБП – основной фактор, определяющий прогноз пациента. Поэтому при установлении диагноза НАЖБП дальнейшее обследование должно быть направлено на выявление наличия фиброза: УУР – А, УДД – 2 [1]. Показано, что наличие и стадия фиброза является определяющими для прогноза больного – продолжительности жизни, развития печеночных осложнений и ССЗ. Риск неблагоприятных исходов возрастает соответственно стадии фиброза [1].
7
• Для выявления групп риска пациентов с прогрессирующим течением НАЖБП (наличием фиброза) могут быть использованы сывороточные (неинвазивные) биомаркеры фиброза – расчетные индексы. Это касается как непатентованных (FIB-4, NAFLD, fibrosis score, ВАRD и др.), так и патентованных (Фибротест и др.) формул. Наибольшую диагностическую точность из непатентованных методов имеет FIB-4: УУР – А, УДД – 2 [1]. Эти формулы основаны на простейших и доступных для определения в рутинной практике показателях (ИМТ, пол, наличие толерантности к глюкозе или СД, скрининговые сывороточные показатели) [1].
• В качестве примера можно привести использование индекса FIB-4, рассчитываемого по формуле: (возраст × АСТ)/(тромбоциты (109/л) × √АЛТ). При значении FIB-4 ≥2,67 с достоверностью 80% можно утверждать о наличии выраженного фиброза, при уровне ≤1,30 с достоверностью 90% – о его отсутствии. Интервал значений индекса FIB-4 от 1,3 до 2,67 попадает в «слепую зону», что не позволяет отнести его к универсальным методам оценки фиброза при НАЖБП. Таким образом, наибольшую диагностическую точность при НАЖБП имеет формула FIB-4 с порогом выявления 1,30, что особенно важно при динамическом наблюдении [1].
• Для исключения поздних стадий заболевания у больных НАЖБП и установления ориентировочной стадии фиброза печени и рекомендуется измерение эластичности печеночной ткани методами эластометрии, основанными на оценке жесткости нормальной и патологически измененной ткани органа: УУР – В, УДД – 2 [1]. Транзиентная эластография – неинвазивный стандарт для измерения эластичности ткани печени, используемый для выявления и косвенной оценки степени фиброза. Наиболее высокая диагностическая точность метода наблюдается при выраженных стадиях фиброза. Недостатками метода являются отсутствие возможности оценки выраженности некровоспалительного процесса, неинформативность у пациентов с избыточной массой тела (требует применение XL датчика), искажение значения результатов у пациентов с активным воспалением, невозможность оценки состояния печени на стадиях стеатоза, стеатогепатита и ранних стадиях фиброза.
Транзиентная эластография лучше выявляет цирротические изменения печени и менее информативна при фиброзе; поэтому ее, скорее, применяют с целью исключения цирроза печени (прогностическая ценность отрицательного результата более 90%) [1].
8
• При НАЖБП в стадии цирроза печени рекомендуется регулярное обследование, направленное на выявление основных проявлений портальной гипертензии (портальной гастропатии, варикозного расширения вен пищевода и желудка) 1 раз в 1–2 года: УУР – В, УДД – 1 [1]. С целью уточнения наличия и степени выраженности портальной гипертензии верхних отделов желудочно-кишечного тракта рекомендуется регулярное проведение эзофагогастродуоденоскопии [1].
• Биопсия печени не рекомендуется лицам с НАЖБП со стеатозом, выявленным при инструментальном обследовании, при отсутствии признаков или симптомов печеночного заболевания, нормальных биохимических показателях и отсутствии признаков прогрессирующего течения (фиброза) по данным неинвазивных методов: УУР – В, УДД – 1 [1].
• Биопсия печени не рекомендуется пациентам с установленным НАЖБП в рутинном обследовании для динамического наблюдения: УУР – В, УДД – 1 [1].
• Проведение пункционной биопсии печени с последующим изучением гепатобиоптата рекомендуется в случаях, когда другие методы диагностики не дают возможности убедительно верифицировать заболевание либо его прогрессирующее течение: УУР – А, УДД – 1 [1]. Биопсия печени служит «золотым стандартом» диагностики НАЖБП и единственным достоверным методом выявления стеатогепатита, позволяющим оценить визуально и количественно степень выраженности стеатоза, воспаления и фиброза, а также в ряде случаев выявить специфические признаки патологии печени, связанной с другими причинами (лекарственные поражения печени, гемохроматоз, гепатоцеребральная дистрофия и т.п.) [1].
• Биопсия рекомендуется также с целью дифференциальной диагностики в случае невозможности другими методами исключить наличие конкурирующих этиологических факторов и сопутствующих хронических заболеваний печени: УУР – В, УДД – 1 [1]. Биопсия с целью дифференциальной диагностики показана при подозрении на НАЖБП в сочетании с устойчивым выраженным увеличением содержания железа и сывороточного ферритина на фоне гомозиготной или гетерозиготной мутации С282У в гене НFE [1].
Лечение
1
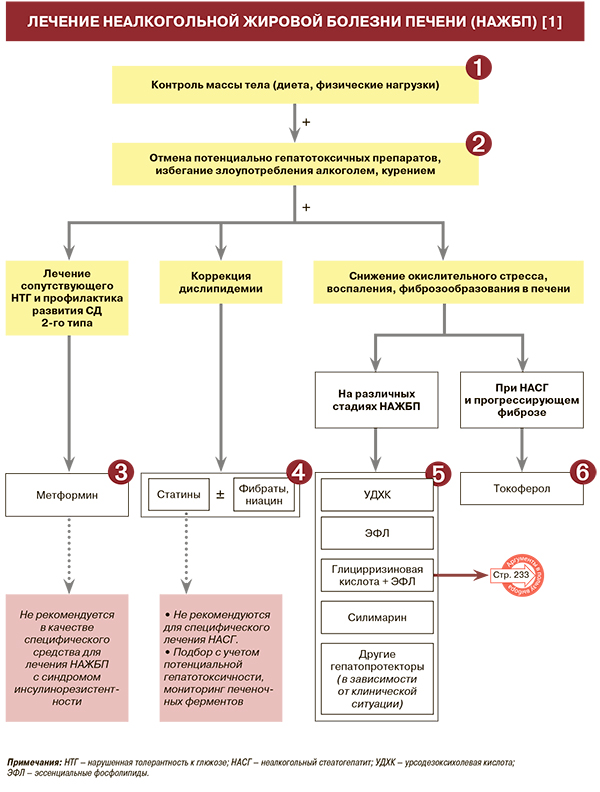
• У пациентов с НАЖБП следует оценивать состав рациона и физическую активность: УУР – А, УДД – 1 [1]. Нерациональное питание и низкая физическая активность относятся к факторам риска развития НАЖБП. Выявление дефектов в образе жизни позволяет провести их персонализированную коррекцию [1].
• Постепенное снижение веса и увеличение физической нагрузки – ведущие факторы в лечении НАЖБП; потеря веса при использовании гипокалорийной диеты или ее сочетание с повышенной физической активностью способствует уменьшению проявлений стеатоза: УУР – А, УДД – 1 [1]. Установлено, что для уменьшения выраженности стеатоза при НАЖБП требуется снижение веса тела не менее чем на 3–5%, а для устранения некротических и воспалительных изменений в печени при стеатогепатите – не менее чем на 10% (УУР – Б, УДД – 1) [1].
• Диетические рекомендации включают ограничение поступающей с пищей энергии и исключение компонентов, способствующих развитию НАЖБП (простых углеводов, напитков с высоким содержанием фруктозы, готовых блюд, например фастфуда). Показано, что диета с ограничением углеводов (так называемая средиземноморская диета или диета FODMAP), по сравнению с низкожировой диетой, лучше способствует разрешению стеатоза [1].
• Подбор диеты и выбор типа и объема физической нагрузки при НАЖБП должен быть адаптирован к индивидуальным предпочтениям пациента: УУР – В, УДД – 1 [1].
Унифицированного немедикаментозного подхода к лечению НАЖБП не существует. Целесообразно приспособление диеты, снижения веса и увеличение физической нагрузки к индивидуальным потребностям пациента, поскольку важным является сохранение достигнутого изменения в образе жизни на длительный период [1].
• У взрослых пациентов физическая нагрузка уменьшает выраженность стеатоза даже при отсутствии дополнительных медикаментозных воздействий, однако ее влияние на нормализацию других гистологических изменений в печени остается неясной: УУР – В, УДД – 1 [1].
2
• Основные принципы лечения НАЖБП, наряду с прочим, включают обязательную отмену потенциально гепатотоксичных препаратов, кроме случаев, когда польза от их назначения превышает риск [1].
• Пациентам с НАЖБП противопоказано злоупотребление алкоголем, на стадии цирроза печени следует рекомендовать воздерживаться от употребления алкоголя и табакокурения: УУР – В, УДД – 1 [1]. В настоящее время нет единой точки зрения на роль умеренных количеств потребления алкоголя и характера алкогольных напитков при НАЖБП (например, средиземноморская диета включает обязательное потребление красного вина до 50 мл в день). Однозначно негативным фактором признается злоупотребление алкоголем. Показано, что употребление алкоголя и табакокурение повышают риск развития гепатоцеллюлярной карциному, поэтому требуется исключить их потребление пациентами с НАЖБП на стадии цирроза [1].
3
• Для лечения сопутствующего нарушения толерантности к глюкозе и профилактики развития СД 2-го типа пациентам с НАЖБП рекомендуется метформин в дозе 20 мг/кг/сут (дозу наращивают постепенно, начиная с 500–850 мг/сут) курсами не менее года: УУР – В, УДД – 1 [1]. В клинических исследованиях по изучению эффективности метформина показано снижение резистентности к инсулину при его приеме, уменьшение активности трансаминаз и выраженное снижение веса (более 10 кг) у 19% больных НАЖБП. Однако улучшение гистологической картины печени было незначительным: уменьшения выраженности стеатоза удается достигнуть только 30% пациентам [1].
• Метформин не рекомендуется в качестве специфического средства для лечения НАЖБП с синдромом инсулинорезистентности, поскольку не оказывает существенного влияния на гистологическую структуру печени: УУР – В, УДД – 1 [1]. Данные метаанализа показали, что применение метформина в течение 6–12 мес на фоне изменения образа жизни не снижает выраженности цитолиза, но улучшает гистологическую структуру печени аналогично контрольной группе, не принимавшей препарат, но изменявшей образ жизни [1, 2].
4
• Гиполипидемическую терапию следует проводить с учетом стадии НАЖБП, при необходимости в комбинации с гепатопротекторами. Наиболее распространенными и изученными гиполипидемическими препаратами являются статины (аторвастатин, розувастатин, симвастатин и др.) [1].
• Статины у больных НАЖБП могут быть рекомендованы для коррекции дислипидемии, но с учетом их повышенного гепатотоксического риска. Однако для специфического лечения НАСГ применять статины не рекомендуется: УУР – В, УДД – 1 [1]. На фоне лечения препаратами этой группы рекомендуется активный лабораторный мониторинг каждые 3–4 нед в течение первых месяцев терапии [1]:
- определение сывороточных печеночных тестов (билирубин, АЛТ, АСТ, ГГТ, ЩФ);
- определение показателей углеводного и липидного обменов (глюкоза, ТГ, ОХС, ХС ЛПНП, ХС ЛПВП, инсулин).
• Прием статинов в комбинации с урсодезоксихолевой кислотой (УДХК) в дозе 10–15 мг/кг/сут сопровождается более выраженным снижением уровня ХС ЛПНП и рекомендуется для применения в реальной клинической практике: УУР – В, УДД – 2 [1]. Комбинация статинов с УДХК предупреждает развитие цитолиза и способствует снижению повышенного уровня трансаминаз [1, 3].
• Кроме статинов, при нарушении липидного обмена у больных НАЖБП рекомендованы производные фиброевой кислоты (фенофибрат), никотиновая кислота (ниацин). Однако в настоящее время отсутствуют рандомизированные контролируемые исследования (РКИ) по их использованию у больных НАЖБП [1, 2].
5
• Для снижения выраженности повреждения печени (окислительного стресса, воспаления, фиброзообразования) применяются гепатопротекторные средства различных фармакологических групп, способные воздействовать на звенья патогенеза НАЖБП [1].
• УДХК может быть применена при всех формах НАЖБП, особенно с признаками вне- и внутрипеченочного холестаза: УУР – В, УДД – 2 [1]. УДХК может быть рекомендована для лечения пациентов с признаками НАСГ: УУР – С, УДД – 3 [1]. Это лекарственное средство уменьшает выраженность стеатоза печени по данным неинвазивных методов исследования [1, 4–7], в высоких дозах снижает выраженность баллонной дистрофии [1, 8]. УДХК уменьшает содержание холестерина в желчи преимущественно путем дисперсии этого вещества и формирования жидкокристаллической фазы [1, 9]. Также она снижает литогенный индекс желчи, увеличивая содержание в ней желчных кислот, способствует частичному или полному растворению холестериновых желчных камней при пероральном применении, оказывает холеретическое действие [1, 10].
• УДХК рекомендована пациентам с НАЖБП, сердечно-сосудистой патологией и синдромом холестаза: УУР – А, УДД – 1 [1]. Результаты отечественного многоцентрового исследования УСПЕХ показали, что УДХК улучшает показатели липидного обмена и обладает потенциальными антиатерогенными свойствами.
У женщин также достоверно снижался показатель толщины комплекса интимамедиа каротидных артерий и 10-летний риск сердечно-сосудистых осложнений по калькулятору ASCVD 2013 [1, 7].
• УДХК назначается в дозе 10–15 мг/кг/сут в 2 приема не менее года, иногда до 2 лет и более [1].
• Эссенциальные фосфолипиды (ЭФЛ) рекомендуются для лечения пациентов с признаками стеатоза печени вне зависимости от стадии заболевания (НАЖБП/ НАСГ): УУР – А, УДД – 1 [1]. ЭФЛ также способны конкурентно замещать эндогенные фосфолипиды с меньшим количеством полиненасыщенных жирных кислот, что увеличивает пластичность мембран и улучшает их функционирование, стабилизировать мембраны, обладают антиоксидантным, цитопротективным и противовоспалительным действием [1, 11]. Пероральная форма ЭФЛ приводила к значимому регрессу стеатоза у больных НАЖБП/НАСГ по данным биопсии печени, УЗИ и КТ в 7 РКИ: в них отмечалась стабильно высокая амплитуда и гомогенность эффекта [1, 12–18]. Также в этих исследованиях показано значимое снижение трансаминаз (АЛТ, АСТ, ГГТ) и липидного профиля. Имеются данные в отношении замедления процесса фиброзирования при длительном применении препарата у больных НАЖБП [1, 17]. Систематический обзор и метаанализ, подтвердил регресс стеатоза на фоне терапии ЭФЛ в РКИ, а также положительное влияние на трансаминазы и липидный профиль у больных с НАЖБП/НАСГ [1, 19]. В наблюдательном исследовании MANPOWER 2018 (2843 пациента со стеатозом печени и кардиометаболической коморбидностью) продемонстрировано улучшение УЗИ-картины у 69,6% пациентов после 3-месячного приема ЭФЛ и у 81,4% пациентов через 6 мес терапии [1, 20].
• ЭФЛ могут быть рекомендованы у пациентов с НАЖБП и сопутствующей сердечно-сосудистой и метаболической патологией (АГ, СД 2-го типа, дислипидемия, ожирение): УУР – В, УДД – 2 [1]. В зависимости от соотношения количеств линолевой и линоленовой кислот у препаратов ЭФЛ могут отмечаться дополнительные гиполипидемические свойства. Пост-хок-анализ исследования MANPOWER продемонстрировал дополнительные гиполипидемические возможности терапии при назначении ЭФЛ на 12 и 24 нед пациентам с НАЖБП [1, 20].
• Прием ЭФЛ осуществляется в дозе 1800 мг/сут, курсами по 3–6 мес, 2–3 раза в год [1].
• Для лечения пациентов с различными формами и стадиями НАЖБП может быть рекомендован прием фиксированной комбинации глицирризиновая кислота + ЭФЛ: УУР – С, УДД – 4 [1]. Обоснованием эффективности этой фиксированной комбинации является способность глицирризиновой кислоты защищать фосфолипиды от окисления и, напротив, способность ЭФЛ повышать липофильность глицирризиновой кислоты, способствуя увеличению ее биодоступности.
• Клиническая эффективность комбинации глицирризиновая кислота + ЭФЛ показана в ряде отечественных исследований [1, 21, 22]. Так, в одном из них 45 пациентов с НАСГ, АГ, СД и дислипидемией в первые 10 дней получали препарат внутривенно струйно по 400 мг/сут в пересчете на глицирризиновую кислоту, затем перорально по 70 мг 3 раза/сут в течение 60 дней. Нормализация активности АЛТ, АСТ, ГГТ и статистически более значимое уменьшение размеров печени по данным УЗИ отмечались у достоверно большего числа пациентов, нежели в контрольной группе. На фоне введения комбинированного гепатопротектора наблюдались лишь единичные, обратимые и слабо выраженные нежелательные явления [1, 21].
• В двойное слепое рандомизированное плацебо-контролируемое исследование фиксированной комбинации глицирризиновая кислота + ЭФЛ «ГЕПАРД» было включено 180 больных с НАЖБП. В основной группе (n=120) исследуемый препарат в дозе 400 мг/сут (в пересчете на глицирризиновую кислоту) вводился внутривенно струйно в течение 10 дней, далее в течение 10 нед пациенты получали препарат в дозе по 70 мг 3 раза/сут перорально. Контрольная группа получала плацебо по той же схеме в аналогичных лекарственных формах. После завершения лечебного курса уровень адипонектина у пациентов основной группы повышался статистически более значимо по сравнению с плацебо, одновременно отмечалась стабилизация индекса фиброза печени (по шкале NAFLD Fibrosis Score) на фоне ее отрицательной динамики в группе контроля. Профиль безопасности двух режимов терапии оказался сопоставимым [1, 22].
• Фиксированная комбинация глицирризиновая кислота + ЭФЛ назначается (в пересчете на глицирризиновую кислоту) в дозе 400 мг/сут внутривенно струйно №10, с последующим переходом на пероральный прием в дозе 70 мг 3 раза/сут в течение 3 мес. При необходимости разовая доза (per os) может быть увеличена до 130 мг, а курс терапии продлен [23].
• Силимарин может быть рекомендован для лечения пациентов с признаками НАЖБП (стеатоза печени и стеатогепатита), особенно при сопутствующих токсических и лекарственных поражениях печени: УУР – С, УДД – 3 [1]. Данные о влиянии этого лекарственного средства на пациентов с НАЖБП ограниченны. Однако некоторые исследования продемонстрировали, что лечение силимарином было связано с улучшением окислительного профиля из-за его способности подавлять выработку провоспалительных цитокинов [1, 24]. Показано снижение выраженности стеатоза печени при использовании комбинации диеты, препарата расторопши пятнистой (источник силимарина) и витамина Е [1, 25]. В сравнении с плацебо, лечение силимарином в дозе 700 мг 3 раза/сут в течение 48 нед, по данными биопсии, значительно улучшало признаки фиброза у 99 пациентов с НАСГ и неалкогольным стеатозом ≥4 [1, 26].
• В многоцентровом двойном слепом плацебо-контролируемом исследовании пациенты (n=72) с НАСГ, без цирроза печени и с неалкогольным стеатозом ≥4 получали 420 или 700 мг силимарина либо плацебо 3 раза/сут в течение 48 нед. Гистологическое улучшение между группами существенно не различалось. Однако улучшение стеатоза и лобулярного воспаления в группе силимарина было больше, чем в группе плацебо, но статистически значимого гистологического улучшения не наблюдалось [1, 27].
• Прием силимарина осуществляется в дозе 420 мг/сут. Курсы лечения силимарином не стандартизованы и рассчитаны на длительный временной период [1].
• Наряду с указанными в схеме гепатопротекторами, при НАЖБП в зависимости от клинической ситуации возможен прием и других препаратов этой категории.
• S-аденозил-L-метионин показан для лечения пациентов с НАЖБП: УУР – С, УДД – 3 [1]. Мультицентровое наблюдательное исследование 250 пациентов с НАЖБП и проявлениями внутрипеченочного холестаза продемонстрировало, что 6-недельный прием этого средства сопровождался значимым снижением симптомов внутрипеченочного холестаза (желтухи, зуда кожи, лабораторных маркеров холестаза), а также снижением количества дней нетрудоспособности и посещений врачей. Вместе с тем убедительных данных о клинически значимом долгосрочном положительном влиянии S-аденозил-L-метионина на биохимическую и гистологическую картину при НАСГ не получено [1].
• Плейотропные эффекты S-аденозил-L-метионина (адеметионина) могут быть использованы у пациентов с НАЖБП при астеническом синдроме (гепатогенной слабости) и при депрессии в качестве антидепрессанта: УУР – А, УДД – 1 [1]. У пациентов с ХЗП адеметионин оказывает дополнительное противоастеническое действие. Метаанализ, включающий 25 контролируемых исследований, свидетельствует, что эффективность адеметионина как антидепрессанта существенно превышает эффект плацебо и сопоставим с трициклическими антидепрессантами [1].
• Плейотропные эффекты адеметионина могут быть использованы у пациентов с НАЖБП при наличии повышенной утомляемости (так называемого циркадного синдрома) или депрессии, а также при сочетании НАЖБП и алкогольного поражения печени: УУР С, УДД – 3 [1].
• Для лечения пациентов с НАЖБП и гипераммониемией рекомендован L-орнитин-L-аспартат (МНН – орнитин): УУР – С, УДД – 3 [1]. Показана возможность дозозависимого влияния препарата на выраженность стеатоза печени у пациентов с НАЖБП; у пациентов с НАСГ на фоне его приема значительно улучшались КТ-показатели соотношения «печень‒селезенка». Продемонстрирована способность орнитина воздействовать на печеночную микроциркуляцию: улучшение зарегистрировано в том числе и при наличии фиброза 0–1 стадий [1].
• Орнитин может быть использован для лечения пациентов с НАЖБП и гипераммониемией до нормализации показателей уровней аммиака–аммония, а также регрессии проявлений печеночной энцефалопатии в соответствии с тестом связи чисел (ТСЧ): УУР – В, УДД – 3 [1].
• Для лечения пациентов с НАЖБП при сердечно-сосудистой коморбидности может быть рекомендован таурин: УУР – В, УДД – 2 [1]. Также содержащие его препараты могут применяться при признаках НАСГ (УУР – С, УДД – 3), в лечении пациентов с НАЖБП и СД 1-го и 2-го типа, метаболическим синдромом, ИБС (УУР – А, УДД – 1) [1].
• Для лечения пациентов с НАЖБП/ НАСГ и гиперферритинемией показан гидролизат человеческой плаценты: УУР – С, УДД – 3 [1]. Для лечения пациентов с НАЖБП и сердечно-сосудистой коморбидностью может быть рекомендована морфолиниевая соль тиазотовой кислоты: УУР С, УДД – 3 [1]. При наличии патологии желчевыводящих путей больным с НАЖБП рекомендован флавоноид цинарин в составе экстракта из листьев артишока: УУР – С, УДД – 3 [1].
• Для лечения морфологически подтвержденного НАСГ показан пероральный сахароснижающий препарат пиоглитазон, однако его безопасность и эффективность при длительной терапии не доказана: УУР В, УДД – 1 [1]. При НАЖБП-ассоциированном СД 2-го типа уменьшение инсулинорезистентности под действием пиоглитазона приводит к снижению концентрации глюкозы в крови, уменьшению в плазме уровней инсулина, гликированного гемоглобина, ТГ и увеличению уровня ЛПВП. Однако уровень ЛПНП и ОХС у таких пациентов не изменяется [1].
6
• Токоферол (витамин Е) в суточной дозе 800 МЕ у пациентов с НАЖБП, не имеющих СД, улучшает гистологическую картину печени и может быть рекомендован как средство терапии первой линии в качестве антиоксиданта при лечении больных с доказанным НАСГ и прогрессирующим фиброзом (F2 и более): УУР – В, УДД – 1 [1]. В исследовании PIVENS применение витамина Е (800 МЕ/сут) позволило снизить выраженность стеатоза, воспаления и баллонной дистрофии и стимулировать регресс НАСГ у 36% пациентов (21% в группе плацебо) [1, 28]. В долгосрочном исследовании (средний период наблюдения 5,6 лет) прием токоферола в той же дозе не менее 2 лет у пациентов с продвинутыми стадиями НАЖБП снижал риск смерти или потребность в трансплантации, а также угрозу печеночной декомпенсации без влияния на риск развития ГЦК и сердечно-сосудистых событий. 10-летняя кумулятивная вероятность ГЦК, сосудистых событий и непеченочного рака не различалась [1, 29].
• Назначение витамина Е нецелесообразно при сочетании НАЖБП и СД, при НАЖБП без НАСГ и фиброза, при подозрении на НАСГ, но без гистологического подтверждения, а также при исходе НАЖБП в цирроз печени: УУР – А, УДД – 3 [1].
Высокие дозы токоферола (более 800 мг/сут) при длительном приеме могут оказывать проканцерогенный эффект в отношении рака предстательной железы и увеличивают риск смерти от всех причин [1, 28], поэтому вопрос об их использовании должен решаться в качестве персонализированного решения.



