Диагностика
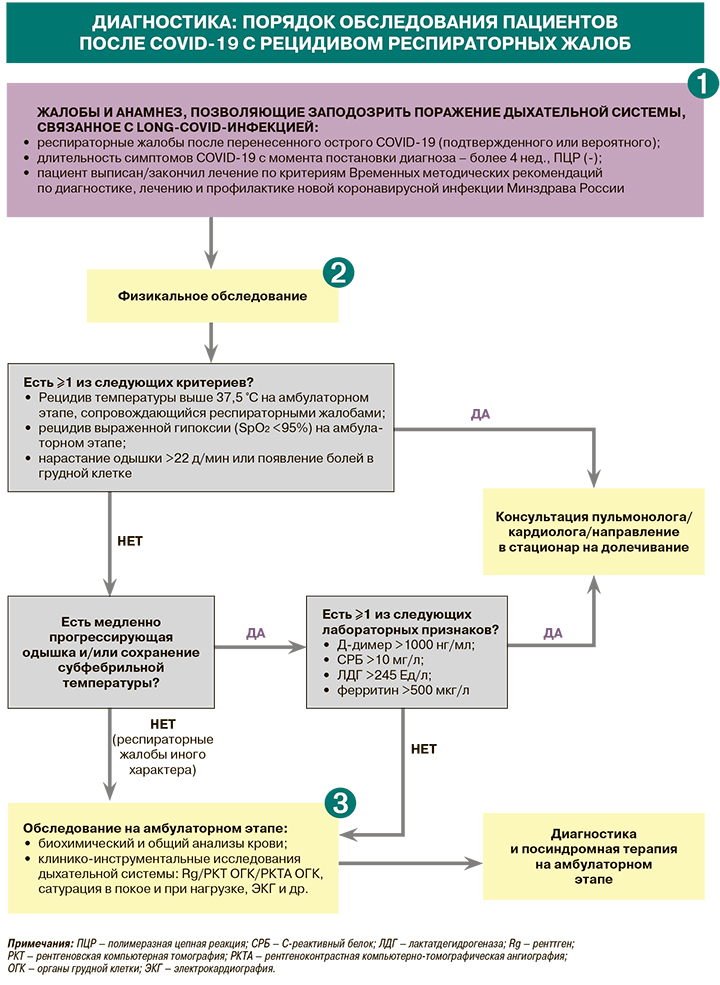
1.
• Предположить long-COVID («долгий COVID») позволяют симптомы новой коронавирусной инфекции, продолжающиеся от 4 до 12 нед и не объясненные альтернативным диагнозом после протоколированного обследования [1].
• Наиболее часто регистрируемые респираторные симптомы long-COVID включают [1]:
– кашель. Частота его развития на 4-й неделе постострой фазы COVID-19 составляет 43%, на 8-й неделе – 46%, на 12-й неделе – 17%;
– одышку (4-я неделя – 33%, 6-я неделя – 63%, 12-я неделя – 14%);
– боль в грудной клетке: дыхательный дискомфорт в виде ограничения вдоха, ощущения тяжести в груди (4-я неделя – 20%, 6-я неделя – 22%, 12-я неделя – 11%).
Также у пациентов может наблюдаться отделение мокроты (8% случаев на 6-й неделе long-COVID-19, 2% – на 12-й неделе) [1].
• Наряду с респираторными симптомами к распространенным клиническим признакам long-COVID относятся [1]:
– общие симптомы – усталость, астения (4-я неделя – 45%, 6-я неделя – 77%, 12-я неделя – 55%);
– отоларингологические проявления – аносмия (4-я неделя – 56%, 6-я неделя – 25%, 12-я неделя – 16%), нарушение вкуса (4-я неделя – 50%, 6-я неделя – 10%, 12-я неделя – 9%) или их сочетание (4-я неделя – 9%, 6-я неделя – 23%, 12-я неделя – 7%);
– ревматические проявления – миалгия (4-я неделя – 15%, 6-я неделя – 13%, 12-я неделя – 16%).
• При изучении анамнеза пациента с признаками long-COVID, помимо подтвержденного или вероятного случая ранее перенесенного острого COVID-19, времени появления и продолжительности симптомов с момента начала острого COVID-19, характера и тяжести предыдущих и текущих симптомов, следует также учитывать наличие хронических бронхолегочных заболеваний [1].
2.
• Физикальное обследование пациента с подозрением на поражение дыхательной системы, обусловленное long-COVID, должно включать оценку общего состояния больного, измерение температуры тела, аускультацию и перкуссию легких, определение частоты дыхательных движений (ЧДД) и SpO2 [1].
• При наличии у пациента признаков одышки рекомендуется провести тест с 3- или 6-минутной ходьбой (3МWT или 6MWT) либо 1-минутный тест «сесть–встать» (1STST) сообразно возможностям пациента. До и после теста для оценки одышки и утомляемости возможно использование модифицированной шкалы Борга (табл. 1). Также до и после теста выполняются пульсоксиметрия, измерение частоты сердечных сокращений. Клинически значимым считается уровень десатурации ≥4% [1].
• Проведение пульсоксиметрии с измерением SpO2 рекомендуется всем пациентам с продолжающимся симптоматическим COVID-19 для выявления признаков дыхательной недостаточности. Необходимо проводить измерение SpO2 в динамике и записывать параметры сатурации не только в покое, но и при нагрузке (ходьба по комнате). Сатурация артериальной крови кислородом <95% – основание для направления пациента к кардиологу/пульмонологу и при необходимости дальнейшей госпитализации [1].
3.
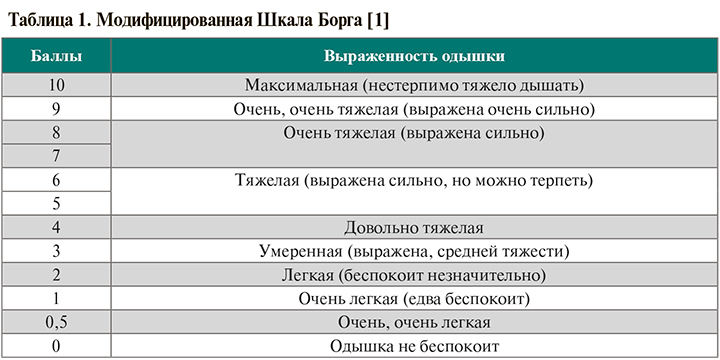
• Объем лабораторных исследований у пациентов с подозрением на long-COVID зависит от клинической картины. Круг анализов, необходимых при наличии одышки, кашля, боли в груди, а также распространенных нереспираторных симптомах пост-ковида, приведен в таблице 2. Повышение уровней Д-димера, СРБ, ЛДГ, ферритина до уровней, указанных в схеме «Диагностика: порядок обследования пациентов после COVID-19 с рецидивом респираторных жалоб», служит основанием для направления пациента к пульмонологу/кардиологу (в последнем случае – при повышении Д-димера и/или СРБ) с целью углубленного обследования и при необходимости госпитализации [1].
• Объем клинико-инструментальных исследований у пациентов с подозрением на long-COVID при наличии одышки, кашля, боли в груди, а также распространенных нереспираторных симптомах пост-ковида представлен в таблице 3.
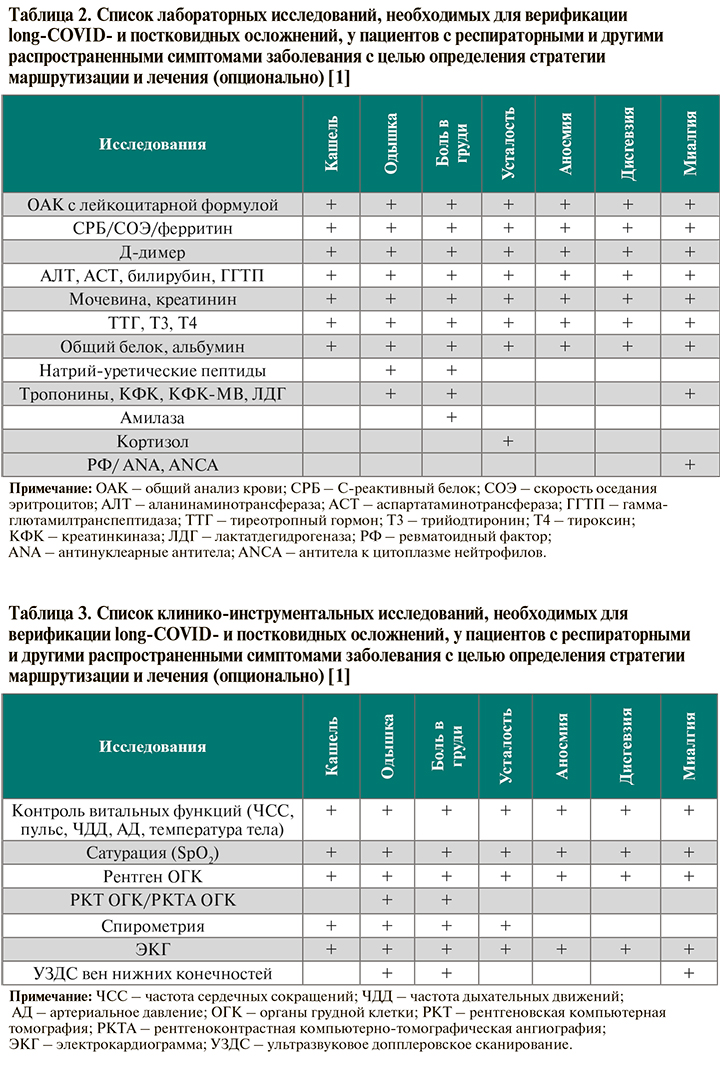
• При наличии одышки/боли в груди изменения на высокоразрешающей компьютерной томографии служат опорной точкой для определения стратегии лечения long-COVID (см. схему «Лечебная стратегия при long-COVID-инфекции в зависимости от изменений на высокоразрешающей компьютерной томографии») [1].
• Всем пациентам с персистирующими респираторными симптомами после COVID-19 рекомендуется проведение исследование функции внешнего дыхания, бодиплетизмографии и определения диффузионной способности легких (DLCO). Наиболее частым функциональным нарушением респираторной системы после COVID-19 является нарушение DLco, что влияет на качество жизни пациентов, служит причиной одышки, слабости и утомляемости [1].
• Критерии направления пациента с поражением дыхательной системы при long-COVID для углубленного обследования к врачу-пульмонологу обобщены в таблице 4.

Лечение
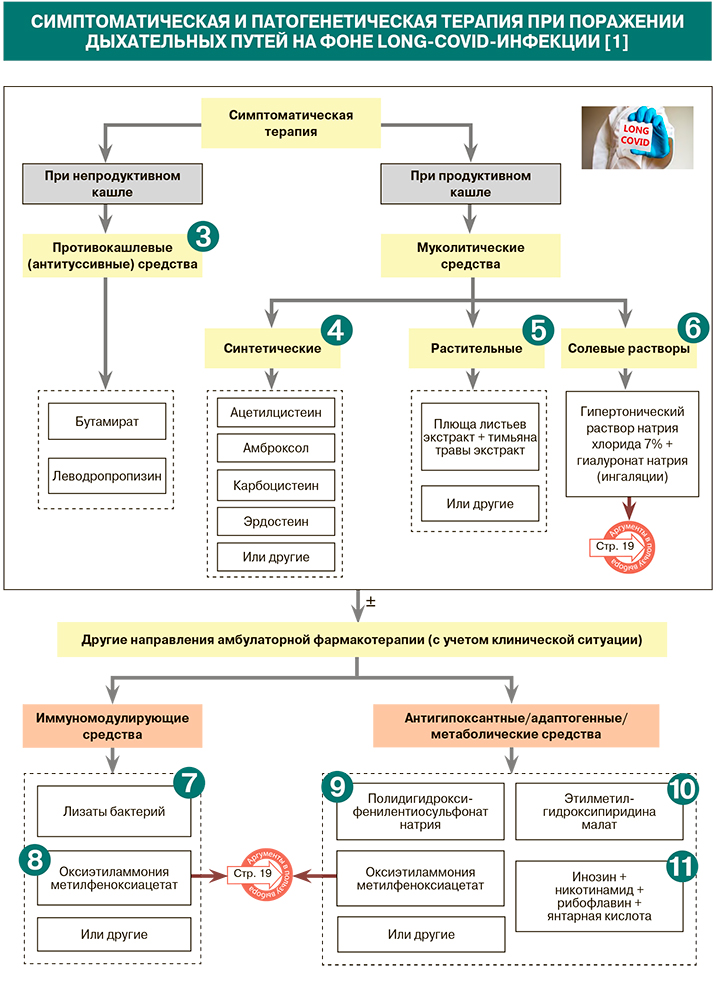
1.
• Возможные методы немедикаментозной терапии при long-COVID включают [1–3]:
– инспираторный тренинг: дыхательные упражнения при коронавирусном поражении легких вследствие повреждения альвеол для улучшения вентиляционной способности легких, улучшения механики дыхания, работы дыхательной мускулатуры;
– вибрационно-перкуссионную терапию – сочетание механического воздействия высокочастотной вибрацией и компрессией на грудную клетку;
– интрапульмональную перкуссионную вентиляцию;
– использование осцилляторных РЕР-тренажеров.
• Индивидуальные рекомендации по питанию при long-COVID в целом носят персонифицированный характер. Рекомендованы использование витаминно-минеральных комплексов (с содержанием витаминов С и D), омега-3-полиненасыщенных жирных кислот, нутритивная поддержка. Возможна разработка индивидуальной диеты с учетом наличия сопутствующей патологии [1].
• При снижении SpO2 менее 93% рекомендовано начало оксигенотерапии при помощи маски или назальных канюль с потоком кислорода 5–10 л в минуту до достижения показателя SpO2 >95%. Сочетание оксигенотерапии (стандартной или высокопоточной) с положением пациента лежа на животе в прон-позиции не менее 12–16 ч в сутки приводит к улучшению оксигенации [1].
• Абсолютным показанием к длительной кислородотерапии в домашних условиях при long-COVID является уровень SрO2 ≤88% (задача: SpO2 >90%; титрование потока: при нагрузке + 1 л/мин, во время сна – + 1 л/мин) [1].
• Относительные показания к длительной кислородотерапии в домашних условиях при long-COVID [1]:
– SрO2 89 % (при наличии особых условий: гематокрит >55%, эритроцитоз, легочная гипертензия, сердечная недостаточность);
– SрO2 ≥90 % (десатурация при нагрузке; десатурация во время сна (титровать дозу во время сна: 8 ч – SpO2 >90%) болезнь легких с тяжелым диспноэ).
• Использование глюкокортикостероидов (ГКС) в качестве подхода к лечению long-COVID возможно, если, например, можно диагностировать организующую пневмонию или бронхиолит и исключить острую инфекцию. Поскольку в настоящее время не опубликовано ни одного рандомизированного контролируемого исследования (РКИ), это остается индивидуальным решением, если функция легких нарушена и у пациента остаются симптомы новой коронавирусной инфекции [1].
• При организующейся пневмонии, фибринозной организующейся пневмонии возможно назначение преднизолона в течение 7 нед с постепенным снижением дозы: 25 мг/кг/сут – 3 нед; 20 мг/сут – 1 нед; 15 мг/сут – 1 нед; 10 мг/сут – 1 нед; 5 мг/сут – 1 нед. При ретикулярных изменениях, утолщении междольковых перегородок, фокальном или мультифокальном синдроме, матовых уплотнениях, субплевральных паренхиматозных тяжах длительность терапии преднизолоном составляет 6 нед (25 мг/кг/сут в первые 2 нед, далее снижение дозировки по той же схеме) [1].
2.
• Окончательно не ясно, должны ли пациенты после COVID-19, имеющие признаки легочного фиброза, получать конкретные антифибротические препараты. Хотя результатов РКИ, позволяющих однозначно ответить на этот вопрос, по-прежнему нет, в настоящее время проходят соответствующие исследования с нинтеданибом и пирфенидоном. При признаках фиброза, «сотовой перестройке» легких возможно использование нинтеданиба 300 мг/сут или пирфенидона по схеме в течение 6 и более месяцев при сохраняющемся прогрессировании функциональных показателей (форсированной жизненной емкости легких, DLcо) [1].
• Из других средств с антифиброзным действием пациентам с признаками функционального дефицита легких, в особенности при персистирующих респираторных симптомах и/или выраженных остаточных изменениях в легочной ткани, возможно назначение бовгиалуронидазы азоксимера внутримышечно курсом 15 инъекций 1 раз в 5 дней [1]. Согласно инструкции по медицинскому применению препарата возможен общий курс до 25 введений: после первых 15 инъекций 1 раз в 5 дней, следующие 10 инъекций проводятся в режиме 1 раз в 10 дней [1].
Бовгиалуронидаза азоксимер вызывает гидролиз гиалуроновой кислоты, снижая ее избыточное количество, затрудняющее газообмен. Эффективность применения препарата у пациентов, перенесших COVID-19, показана в многоцентровом открытом проспективном исследовании DISSOLVE [1].
3.
Кашель у пациентов с продолжающимся симптоматическим COVID-19, как правило, непродуктивный. Для его купирования целесообразно назначение противокашлевых препаратов – бутамирата, леводропропизина [1]. Бутамират как ненаркотический антитуссивный препарат центрального действия избирательно действует на кашлевой центр, не подавляя дыхательный центр. Он не вызывает привыкания, может использоваться длительно без потери эффективности, разрешен к приему у пациентов с гипергликемией, не имеет межлекарственных взаимодействий [1].
4.
• Если у больного есть жалобы на продуктивный кашель (что, как правило, наблюдается у больных, перенесших тяжелое течение COVID-19 с присоединением нозокомиальной бактериальной инфекции), рекомендовано использование мукоактивных препаратов – амброксола, карбоцистеина, ацетилцистеина, эрдостеина.
• Ацетилцистеин характеризуется комплексным действием – муколитическим, антиоксидантным и противовоспалительным. При необходимости его назначения с антибиотиками следует соблюдать интервал между приемом препаратов не менее 2 ч [1].
• При установленных по результатам КТ фиброзоподобных, субплевральных ретикулярных изменениях легочной ткани без «сотовой перестройки», утолщении прилегающей плевры возможно назначение ацетилцистеина в высоких дозах (1800 мг/сут) длительными курсами (в течение 6–9–12 мес) [1].
5.
При продуктивном кашле у пациентов с long-COVID возможно также применение мукоактивных лекарственных средств комплексного действия на основе экстрактов лекарственных растений. Одно из наиболее изученных лекарственных средств такого рода – препарат, сочетающий экстракты тимьяна и листьев плюща. Он обладает отхаркивающим, муколитическим, противовоспалительным, антибактериальным и противовирусным действием [1].
6.
Для ускорения отхождения вязкого секрета из дыхательных путей при продуктивном кашле на фоне long-COVID-19 можно также рассмотреть применение гипертонических 7% солевых растворов с гиалуроновой кислотой для ингаляций (изделия медицинского назначения). Свое мощное мукоактивное действие они реализуют через несколько механизмов как со стороны гипертонического раствора, так и гиалуроновой кислоты. Во-первых, создавая градиент концентраций по осмотическому принципу, гипертонический раствор натрия хлорида вызывает приток водного компонента из подслизитого слоя и увеличение объема жидкого слоя (геля), что способствует не только разжижению мокроты, но и уменьшению отека на всем протяжении дыхательных путей – происходит эвакуация последствий воспаления [4–6]. Во-вторых, стимулируя биение ресничек вследствие высвобождения простагландина Е2, гипертонический раствор соли создает условия для восстановления мукоцилиарного клиренса [7]. Кроме этого, уже через 20 мин после ингаляции раствором уменьшается воспаление в бронхах за счет подавления продукции интерлейкина 8 в бронхиальном секрете и реализуется бактерицидный эффект – разрушается структура биопленок P. aeruginosa [8, 9]. В-третьих, высокомолекулярная гиалуроновая кислота в составе ингаляционного раствора обволакивает раздраженные кашлевые рецепторы; благодаря этому, согласно исследованиям, снижается интенсивность изнуряющего кашля на 68% у пациентов с ХОБЛ на фоне перенесенного COVID-19 (применение в течение 5 суток, 2 раза в день) [10–12]. Также накоплены данные о репарации поврежденного барьерного эпителиального слоя при применении гипертонического солевого раствора с гиалуроновой кислотой [13].
7.
Для стимуляции мукозального иммунитета возможно применение препарата на основе лизатов бактерий (H. influenzae, Str. pneumoniae, Str. viridans, Str. pyogenes, K. pneumoniae, K. ozaenae, S. aureus, M. catarrhalis) [1]. Помимо активации противоинфекционной защиты, он стимулирует Тreg-зависимые противовоспалительные механизмы. Применение препарата в комплексном лечении респираторной инфекции направлено на снижение риска вторичной бактериальной инфекции и потребности в антибиотиках. Также препарат используется с целью неспецифической профилактики респираторных инфекций и обострений хронических заболеваний дыхательных путей, индуцированных вирусами и бактериями. При long-COVID-19 лизаты бактерий можно рекомендовать как средство профилактики рецидивирующих респираторных и вторичных бактериальных инфекций [1].
8.
• Оксиэтиламмония метилфеноксиацетат относится к группе адаптогенных препаратов с иммуномодулирующим действием (стимулирует выработку альфа- и гамма-интерферонов, повышает фагоцитарную активность макрофагов). Фармакодинамические свойства препарата способствуют повышению выносливости при физических и умственных нагрузках, уменьшают действие различных токсинов, повышают устойчивость организма к гипоксии (частой спутнице long-COVID) и другим неблагоприятным факторам окружающей среды [14, 15].
• В проспективном открытом сравнительном исследовании с участием 130 пациентов с ОРВИ в группе, применявшей оксиэтиламмония метилфеноксиацетат (в первый день по 200 мг 3 раза/сут, в последующие 7 дней по 200 мг 1 раз/сут), наблюдалось уменьшение продолжительности заболевания, снижение выраженности и длительности основных симптомов заболевания по сравнению с контрольной группой, не получавшей иммуномодуляторов. В частности, это проявлялось сокращением на 29% доли пациентов с температурой выше 37 °C в основной группе исследования на 3–5-й день наблюдения (в контроле аналогичный показатель составил 10%). Кроме того, на фоне приема исследуемого препарата в те же сроки отмечалось сокращение на 45% доли больных с признаками астении (одного из основных симптомов long-COVID), уменьшение на 53% доли больных с исходно тяжелой астенией. Согласно выводам исследования, оксиэтиламмония метилфеноксиацетат может быть назначен после выписки больных с COVID-19, когда велика восприимчивость к инфекции из-за сохранения остаточных явлений, снижающих функциональную активность неспецифических факторов защиты [15].
9.
В условиях гипоксии определенную положительную роль могут сыграть препараты метаболического антиоксидантного действия. Полидигидроксифенилентиосульфонат натрия облегчает проникновение кислорода в клетки, способствует восстановлению нарушенных процессов образования АТФ в митохондриях, нивелирует негативные последствия гипоксии, ингибирует свободно-радикальные процессы. Включение препарата в комплексную терапию пациентов с пневмониями сокращает сроки выздоровления, ускоряет нормализацию показателей периферической крови, укорачивает продолжительность выявления влажных хрипов и одышки, способствует положительной динамике показателей сатурации, индекса транзиторной одышки, выраженности одышки после выполнения нагрузки (по шкале Борга), толерантности к физической нагрузке по 6-минутному шаговому тесту [1, 16].
10.
Этилметилгидроксипиридина малат – антиоксидантное средство, которое активирует супероксиддисмутазу и каталазу, ингибирует свободно-радикальные процессы, редуцирует оксидантный стресс, оказывает мембранопротекторное, антигипоксическое, антиишемическое действие, улучшает метаболизм (повышает уровень АТФ) в головном мозге, сердце и других органах, повышает устойчивость организма к стрессу. Увеличивая концентрацию фоллистатина, препарат способствует ограничению воспалительного процесса в легких. Также он создает условия для уменьшения ишемических/гипоксических неврологических и сердечно-сосудистых нарушений, в том числе у пациентов с коронавирусной инфекцией [1, 16].
11.
Комбинированный препарат состава инозин + никотинамид + рибофлавин + янтарная кислота обладает антиоксидантным и антигипоксантным действием.
Он оказывает положительное влияние на энергообразование в клетке, уменьшает продукцию свободных радикалов и восстанавливает активность ферментов антиоксидантной защиты, активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, ресинтез макроэргов, способствует утилизации глюкозы и жирных кислот, что позволяет сделать вывод о целесообразности его использования при реабилитации пациентов с постковидным синдромом. Препарат может влиять на ключевое патофизиологическое звено полиорганной недостаточности при новой коронавирусной инфекции за счет того, что усиливает тканевое дыхание и восстанавливает митохондриальное звено энергообмена клетки [1, 17].



