Диагностика
1.
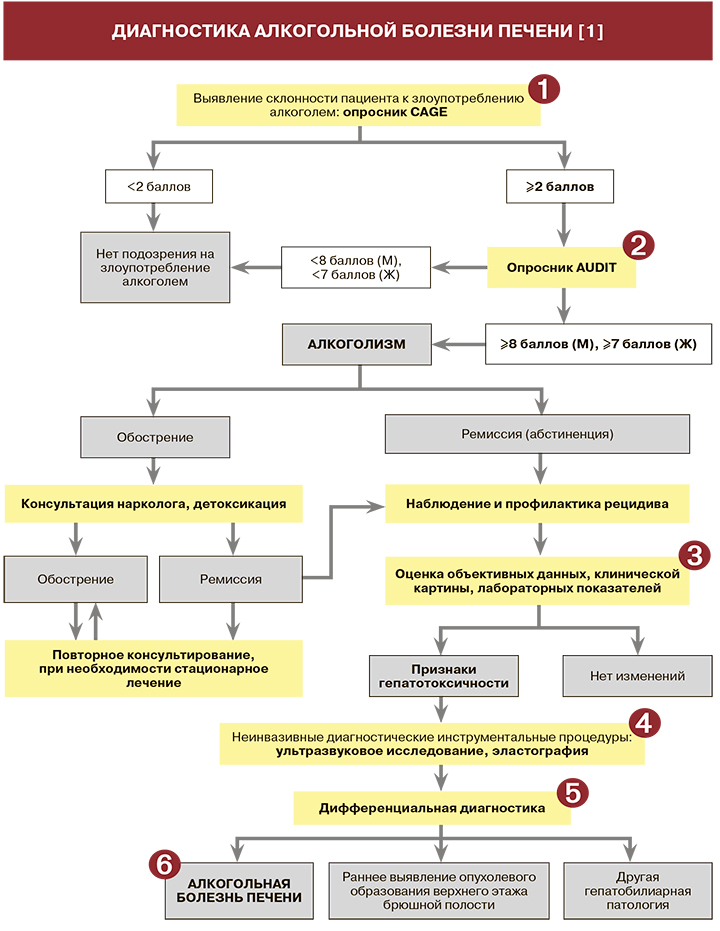
• Сложность своевременного диагностирования алкогольной болезни печени (АБП) обусловлена отсутствием специфических симптомов заболевания. Клинические признаки АБП варьируют от полного отсутствия каких-либо проявлений (в большинстве случаев при алкогольном стеатозе) до классической картины тяжелых форм поражения печени с симптомами печеночной недостаточности и портальной гипертензии (при алкогольном циррозе) [1]. Ряд распространенных неспецифических жалоб пациентов, которые могут сопутствовать АБП, указан в таблице 1.

• Другая сложность диагностики АБЛ обусловлена склонностью больных к неадекватной оценке своего состояния и частым их стремлением к сокрытию злоупотребления спиртными напитками В целях выявления факта злоупотребления спиртными напиткам в качестве опросника первой линии рекомендовано использование анкеты CAGE: уровень убедительности рекомендаций (УУР) – В, уровень достоверности доказательств (УДД) – 1. Структура анкеты приведена в таблице 2. Чувствительность теста составляет 66%, специфичность ‒ 91,4% [1].

2.
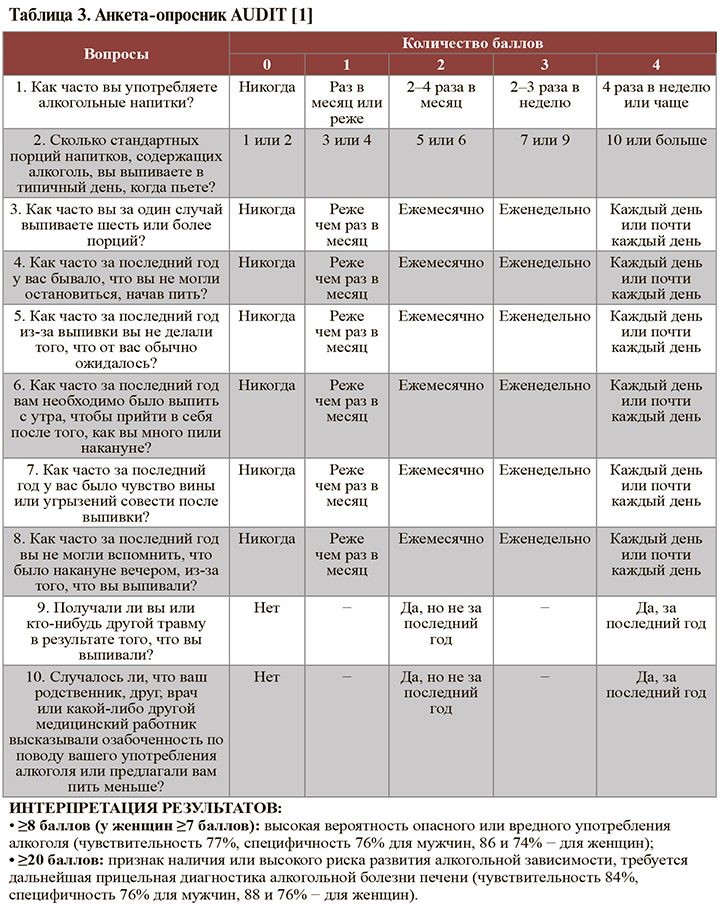
При выявлении положительного результата опросника CAGE (≥2 баллов) рекомендуется проведение международного стандартизованного теста AUDIT: УУР – С, УДД – 5. Структура теса представлена в таблице 3. Продолжительность проведения и оценка AUDIT обычно не превышает 5 мин [1].
3.
• Пациенту с подозрением на АБП рекомендовано проведение физикального обследования, однако дифференцировать АБП от других форм паренхиматозного повреждения печени только по данным физикального осмотра затруднительно: УУР – С, УДД – 5 [1]. Признаков, патогномоничных исключительно для АБП, при физикальном обследовании не отмечается. При объективном исследовании следует обращать внимание на так называемые алкогольные стигмы: одутловатость лица, расширение сосудов носа и склер, увеличение околоушных слюнных желез, ринофиму, атрофию мышц плечевого пояса, яркие сосудистые звездочки, гинекомастию, контрактуру Дюпюитрена, тремор пальцев рук, атрофию яичек, гепатомегалию, «мраморность» кожных покровов, повышенную потливость, раздражительность [1].
• Помимо алкогольных стигм, существуют и другие, менее специфичные физикальные признаки хронического злоупотребления алкоголем. Все они объединены и представлены в модифицированной сетке LeGo (табл. 4).

• При развитии тяжелого гепатита и цирроза печени характерно появление неврологического синдрома различной степени выраженности, который может включать сонливость или нарушение/спутанность сознания, инверсию ритма сна, нарушение речи, астериксис, повышение мышечного тонуса глубоких сухожильных рефлексов, повышение аппетита. Клинические проявления патологии на стадии цирроза печени могут проявляться также отеками нижних конечностей, увеличением живота в объеме (отечно-асцитический синдром), повышенной кровоточивостью и появлением подкожных гематом без видимых причин (геморрагический синдром) [1].
• Развитие ACLF (острой печеночной недостаточности на фоне хронической) сопровождается быстрым нарастанием печеночно-клеточной недостаточности и характеризуется следующими признаками: прогрессирующей энцефалопатией, геморрагическим синдромом, симптомы SIRS (синдрома системного воспалительного ответа, вплоть до сепсиса), гепаторенальным синдромом. При ACLF отмечается высокий риск смерти пациента в короткие сроки (от 28 дней до 3 мес) [1].
• Всем пациентам с подозрением на АБП рекомендуется проведение общего (клинического) анализа крови в целях определения среднего объема эритроцита, уровня гемоглобина для выявления анемии и уточнения ее характеристик, а также наличия маркеров воспалительного процесса в печени пациента: УУР – С, УДД – 5 [1]. При выраженном воспалительном процессе в печени на фоне чрезмерного употребления алкоголя нередки лейкемоидные реакции, нейтрофильный лейкоцитоз до 15–20 × 109/л, повышение скорости оседания эритроцитов (СОЭ) до 40–50 мм/ч. Также при АБП нередко наблюдается развитие макроцитарной анемии вследствие дефицита витамина В12 и фолиевой кислоты [1].
• Всем пациентам с подозрением на АБП рекомендуется определение активности аланинаминотрансферазы (АЛТ) и активности аспартатаминотрансферазы (АСТ) в сыворотке крови: УУР – С, УДД – 5 [1]. При АБП активность трансаминаз возрастает умеренно (обычно не более 6 норм), при этом коэффициент де Ритиса (соотношение АСТ/АЛТ) обычно превышает 2 [1].
• Всем пациентам с подозрением на АБП рекомендуется оценить уровень билирубина и его фракций в сыворотке крови − провести исследование уровней общего билирубина в крови, билирубина связанного (конъюгированного), билирубина свободного (неконъюгированного) в сыворотке крови: УУР – С, УДД – 5 [1]. При АБП уровень билирубина увеличивается преимущественно за счет прямой фракции, нередко достигая высоких показателей. Уровень общего билирубина также используется в составе комплексных диагностических тестов [1].
• Всем пациентам с АБП рекомендуется провести определение активности гамма-глютамилтрансферазы (ГГТП) в сыворотке крови в целях выявления признаков внутриклеточного холестаза, связанного с развитием алкогольного гепатита: УУР – С, УДД – 4 [1]. При развитии алкогольного гепатита активность ГГТП многократно повышается, иногда вместе с щелочной фосфатазой (синдром холестаза, синтез щелочной фосфатазы не стимулируется этанолом). Диагностически значимым является повышение концентрации ГГТП с ее последующим снижением на фоне воздержания от приема алкоголя [1].
• В качестве маркера алкогольной интоксикации рекомендуется использовать безуглеводистый (десиализированный, карбогидрат-дефицитный) трансферрин (CDT), повышение концентрации которого в крови происходит при ежедневном приеме 50–80 г и более этанола в сутки на протяжении 1–2 нед (давностью не более 2–3 нед); качественное и количественное определение (CDT) в сыворотке крови методом капиллярного электрофореза рекомендовано проводить независимо от популяции пациента при подозрении на хроническую алкогольную интоксикацию УУР – В, УДД – 2 [1].
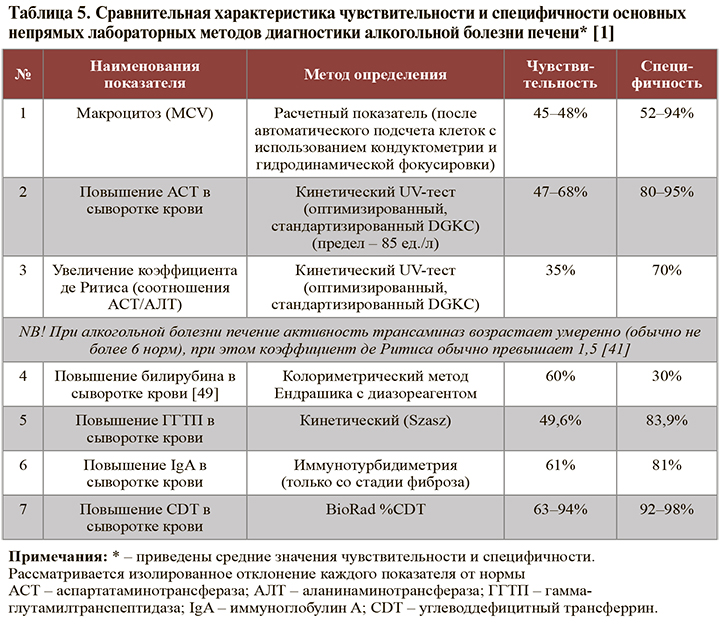
• Основные непрямые лабораторные маркеры АБП суммированы в таблице 5.
При всей важности определения этих маркеров нужно помнить, что ни один из них не может служить достоверным индикатором алкогольной этиологии заболевания печени [1].
4.
• Всем пациентам с подозрением на АБП рекомендуется комплексное ультразвуковое исследование (УЗИ) органов брюшной полости (табл. 6) для качественного определения наличия стеатоза и/или цирроза печени: УУР – С, УДД – 5 [1]. При этом следует помнить, что данный метод не позволяет установить этиологию и стадию поражения печени. Чувствительность УЗИ при диагностике АБП составляет 85%, специфичность – 30% [1].

• Эластометрия печени рекомендуются пациентам с подозрением на прогрессирующий фиброз печени для оценки степени фиброза печени по шкале Metavir (табл. 7): УУР – В, УДД – 1 [1]. Чувствительность метода при диагностике АБП составляет 86%, специфичность – 93%. Эластометрия печени может давать погрешности вследствие точечного определения упругости печеночной ткани без оценки состояния паренхимы в целом. Кроме того, получение достоверных результатов невозможно при асците или ожирении [1].

• В качестве дополнительных методов при технической невозможности использования эластографических методов диагностики и/или с целью послойного изучения тканей печени и окружающих тканей, а также для уточняющей оценки степени фиброза печени рекомендуется проведение компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием или магнитно-резонансной томографии органов брюшной полости (на выбор): УУР – С, УДД – 5 [1].
• Всем пациентам с установленной АБП рекомендовано исследование эзофагогастродуоденальной зоны методом эзофагогастродуоденоскопии (ЭГДС): УУР – С, УДД – 5 [1]. Алкоголь вызывает прямые и косвенные повреждения слизистой оболочки желудочно-кишечного тракта (в том числе пищевода, желудка и двенадцатиперстной кишки), для регистрации которых используется ЭГДС. В случае портальной гипертензии проведение ЭГДС служит необходимым способом установления степени варикозного расширения вен пищевода и кардиального отдела желудка, а также оценки опасности развития кровотечений из указанных сосудов [1].
5.
Чаще всего проводят дифференциальную диагностику АБП с неалкогольной жировой болезнью печени (характерные признаки – атерогенная дислипидемия, избыточный вес или ожирение, жировая инфильтрация печени при CDT <1,7%), а также с механической обструкцией желчевыводящих путей (гепатоцеллюлярная карцинома, билиарная обструкция, синдром Бадда–Киари), гепатитами (вирусным, аутоиммунным, лекарственно-индуцированным, ишемическим), первичным гемохроматозом и рядом других заболеваний гепатобилиарной системы. Обнаружение «второго» заболевания печени не исключает наличие АБП [1]. Выбор необходимых исследований осуществляется лечащим врачом в соответствии с жалобами, анамнезом заболевания, анамнезом жизни и данными объективного осмотра пациента [1].
6.
Учитывая все имеющиеся методы диагностики, для установления диагноза АБП целесообразно использование сводной таблицы критериев, составленной на основе специфичности каждого используемого метода диагностики и рассчитанной с высокой степенью достоверности (табл. 8).

Лечение
1.
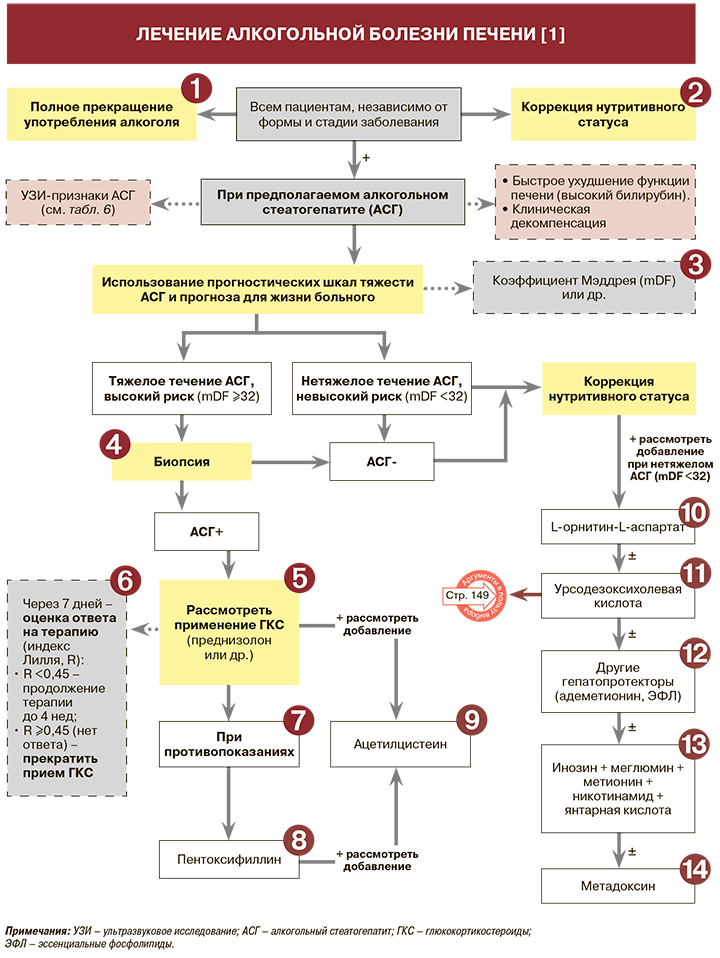
Ведение пациентов, страдающих алкогольной зависимостью, целесообразно осуществлять совместными усилиями специалистов соматического и наркологического звена. При АБП рекомендован отказ от употребления алкоголя в целях профилактики развития и прогрессирования заболевания: УУР – В, УДД – 3 [1]. Воздержание от алкоголя – краеугольный камень терапии АБП. В случае продолжения употребления спиртных напитков следует предложить лечение пациента с помощью междисциплинарной команды, включающей врача-психотерапевта. Психотерапия, включающая 12-ступенчатую фасилитирующую терапию, когнитивно-поведенческую терапию и терапию повышения мотивации, помогает поддерживать воздержание [1].
2.
Пациентам с установленной нутритивной недостаточностью рекомендуется дополнение комплексной терапии сбалансированным энтеральным питанием с целью адекватной коррекции поступления питательных веществ в количестве, соответствующем степени выявленного дефицита: УУР – В, УДД – 1 [1]. Кроме исключения тугоплавких жиров и легкоусваиваемых углеводов, необходимо обеспечить достаточное содержание белка в дозе не менее 1–1,5 г на кг идеальной массы тела. Рекомендуются липотропные продукты, способствующие оттоку желчи (овсяная и гречневая крупы, изделия из творога, нежирные сорта рыбы). При анорексии применяется энтеральное зондовое или парентеральное питание. При легких и среднетяжелых формах АБП определенный эффект могут дать анаболические стероиды [1].
3.
• Коэффициент Маддрея (mDF), определяющий тактику терапии АБП при подозрении на АСГ, вычисляется по формуле: DF=4,6 × (ПВ больного – ПВ контроля) + СБ, где ПВ — протромбиновое время (с); СБ — уровень сывороточного билирубина (мг/дл). У больных со значением этого коэффициента ≥32 (тяжелое течение АСГ) вероятность летального исхода в ближайший месяц составляет от 35−50% (при отсутствии адекватной терапии) [1].
• Из других прогностических шкал тяжести АСГ и прогноза для жизни больного могут использоваться MELD и GAHS. MELD ‒ модель терминальной стадии болезни печени для определения риска летального исхода в 90-дневный срок, ранее разработанная для больных, нуждающихся в трансплантации печени. MELD (в баллах) вычисляется по формуле: 11,2 × ln (МНО) + 9,57 × ln (креатинин, мг/дл) + 3,78 × ln (билирубин, мг/дл) + 6,43, где ln — натуральный логарифм. Нижняя граница нормы для каждого показателя 1, максимальное значение для уровня креатинина ‒ 4.
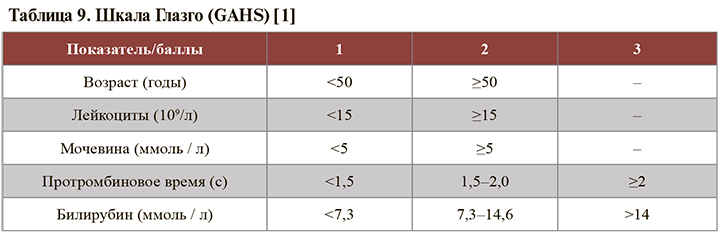
В случае если пациент находится на гемодиализе, уровень креатинина считают равным 4. Течение АСГ считают тяжелым, а прогноз на ближайшие 90 дней неблагоприятным при результате MELD ≥18 баллов [1]. Принципы оценки тяжести предполагаемого АСГ по шкале Глазго (GAHS) приведены в таблице 9.
4.
АСГ тяжелого течения, когда существует необходимость в специфической терапии (глюкокортикостероиды), − одно из показаний к выполнению биопсии печени [1, 2]. Этот метод не только подтверждает наличие поражения печени, но и устанавливает его степень и стадию гистологической активности [1, 3].
5.
• При тяжелом течении АБП в стадии алкогольного гепатита в острый период коротким курсом рекомендовано назначение глюкокортикостероидов (ГКС): УУР – А,
УДД – 1 [1, 4]. Применение ГКС при АСГ обусловлено их блокирующим действием на цитотоксические и воспалительные механизмы развития заболевания. ГКС уменьшают уровень циркулирующих воспалительных цитокинов (фактора некроза опухоли альфа, ФНО-α) и приводят к гистологическому улучшению за короткий период [1].
• Рекомендованы следующие режимы дозирования ГКС при тяжелой форме АБП для снижения 28-дневной смертности (УУР – В, УДД – 2) [1]:
– преднизолон (40 мг/сут), курс – 30 дней;
– метилпреднизолон (32 мг/сут), курс – 28 дней;
– будесонид (9 мг/сут), курс – 28 дней.
6.
• В процессе лечения ГКС рекомендуется использовать индекс Лилль для оценки ответа на лечение; вероятность 6-месячного выживания пациентов с R ≥0,45 составляет в среднем 25%, с R <0,45 – 85%: УУР – В, УДД – 3 [1]. Расчет индекса Лилля проводят по формуле: R=3,19–0,101 × возраст + 0,147 × А0 + 0,0165 × (СБ1 – СБ7) – 0,206 × ПН – 0,0065 × СБ0 – 0,0096 × МНО, где А0 – альбумин в день 0 (г/л); СБ0, СБ1, СБ7 – сывороточный билирубин в 0, 1 и 7-й дни соответственно; ПН – коэффициент, связанный с наличием или отсутствием почечной недостаточности: при уровне сывороточного креатинина ниже 115 мкмоль/л (1,3 мг/дл) или клиренсе креатинина менее 40 мл/мин ПН=0 (нет почечной недостаточности); при превышении указанных выше величин диагностируют почечную недостаточность (коэффициент ПН=1) [1].
• Интерпретация результатов лечения ГКС по индексу Лилля: R ≤0,16 – полный ответ; R=0,16–0,56 – частичный ответ на терапию; R ≥0,56 – отсутствие ответа. Если на 7-й день лечения у больного индекс Лилля ≥0,45, рекомендуется прекратить прием ГКС [1].
7.
Назначение ГКС не рекомендуется пациентам с желудочно-кишечным кровотечением, сахарным диабетом в стадии декомпенсации, активными инфекционными процессами различной локализации, тяжелой почечной недостаточностью в связи с опасностью развития тяжелых побочных эффектов препаратов: УУР – С, УДД – 4 [1, 5].
8.
Пациентам с АБП в остром периоде при тяжелом алкогольном гепатите с наличием противопоказаний к ГКС рекомендуется применение пентоксифиллина: УУР – С, УДД – 1 [1, 6]. Это лекарственное средство назначается в дозировке 400 мг в 3 приема перорально длительно в течение 28 дней. Следует помнить, что пентоксифиллин способен лишь оказывать некоторое влияние на субъективное самочувствие пациента, но не влияет на выживаемость пациентов с АБП [1, 7, 8].
9.
Ацетилцистеин в дозе 300 мг на 1 кг массы тела пациента в сутки курсом на 14 дней рекомендован как препарат выбора в комбинированной терапии тяжелого течения АБП: УУР – В, УДД – 2 [1, 9]. В составе комбинированного лечения (в частности, с ГКС или с пентоксифиллином) ацетилцистеин способен улучшать краткосрочную выживаемость пациентов с алкогольным гепатитом тяжелого течения [1, 9, 10].
10.
• Орнитин (L-орнитин-L-аспартат) рекомендуется для лечения пациентов с АБП в составе комбинированной терапии у пациентов с явлениями выраженного эндотоксикоза и при любой степени печеночной энцефалопатии вследствие выраженного гипоаммониемического эффекта: УУР – С, УДД – 2 [1, 11–13]. Участвуя в орнитиновом цикле, L-орнитин-L-аспартат утилизирует аммонийные группы в синтезе мочевины, снижая концентрацию аммиака в плазме крови. Препарат способствует нормализации кислотно-щелочного состояния организма и выработке инсулина и соматотропного гормона [1, 11–13].
• Пероральная доза L-орнитина-L-аспартата составляет 9–18 г/сут, внутривенная − 20−30 г/сут в течение 3–8 дней при максимальной скорости инфузии 5 г/ч [1, 11]. Рекомендуемая суточная доза варьирует в зависимости от тяжести АБП. Возможный режим дозирования 5 г 3 раза/сут в течение 60 дней не оказывает влияния на когнитивный дефицит, но статистически предотвращает будущие эпизоды явной печеночной энцефалопатии через 6 мес при циррозе печени [1, 11].
11.
• В составе комбинированной терапии у пациентов с холестатическим и цитолитическим синдромами при АБП рекомендуется использование препаратов урсодезоксихолевой кислоты (УДХК): УУР – С, УДД – 5 [1, 14, 15]. УДХК обладает антиоксидантной активностью, подавляет активность цитохром P-450-зависимой системы метаболизма ксенобиотиков, активируемой при длительном потреблении этанола, стабилизирует физические и химические свойства мембран гепатоцитов, ингибирует выработку основного противовоспалительного цитокина – ФНО-α [16]. Оптимальная доза УДХК при АБП составляет 13–15 мг/кг/сут в 2–3 приема. Курс лечения обычно составляет от 3 до 6 мес, но при необходимости может быть пролонгирован на более длительный срок [1].
• В рандомизированном, наблюдательном проспективном исследовании длительностью 6 мес с участием 120 пациентов с АБП УДХК (300 мг) сравнивалась с адеметионином (400 мг) и плацебо. К концу терапии в основной группе (УДХК) отмечалось снижение уровней общего билирубина (на 62% – с 2,9 до 1,1 мг/дл), АСТ (на 53,7% – с 98,2 до 45,4 Ед/л), АЛТ (31,9% – с 72,1 до 49,1 Ед/л), уменьшение протромбинового времени (на 34,2% – с 21,3 до 14,0 с) и международного нормализованного отношения (на 33,3% – с 1,5 до 1,0). При этом положительная динамика указанных лабораторных маркеров в группе УДХК была выше, чем в других группах исследования. На основании этого авторы сделали вывод о том, что раннее медицинское вмешательство с использованием УДХК является предпочтительным вариантом для положительного исхода АБП [17].
• В другом проспективном наблюдательном исследовании с участием 120 пациентов с разными типами алкогольного поражения печени (в том числе алкогольным гепатитом и циррозом) применение УДХК способствовало снижению билирубина на 25%, АЛТ на 35% и АСТ на 33% в течение 1 нед лечения [18].
• Учитывая хорошие результаты и достаточно высокое качество приведенных клинических исследований (включая рандомизированное [17]), а также общепринятые критерии доказательности информации [1], УДД урсодезоксихолевой кислоты при АБП может рассматриваться как равный минимум 2, а УУР как соответствующий уровню B.
12.
• Пациентам с диагностированными цитолитическим и холестатическим синдромами в составе комбинированной терапии АБП рекомендуется применение адеметионина: УУР – В, УДД – 3 [1, 19, 20]. Препарат оказывает антиоксидантный и детоксицирующий эффекты, ускоряет регенерацию ткани печени и замедляет развитие фиброза. Исследования показали, что адеметионин при АБП купирует абстинентный синдром, улучшает общее самочувствие, уменьшает кожный зуд, снижает уровень общего билирубина, АЛТ, АСТ. Важным аспектом использования этого лекарственного средства является его антидепрессивное действие, так как психоэмоциональные проблемы возникают практически у каждого злоупотребляющего алкоголем пациента [1, 19, 20].
• Рекомендуется внутривенное введение адеметионина в течение 2 нед (500–800 мг ежедневно) с продолжением его перорального введения в дозе 1500 мг ежедневно в продолжение следующих 6 нед. Препарат не следует назначать при азотемии [1].
• При АБП в составе комбинированной терапии у пациентов с болевым и диспепсическим, а также цитолитическим синдромами с целью снижения клинико-биохимической активности воспалительного процесса рекомендуется применение фосфолипидов: УУР – С, УДД – 5 [1, 15]. Механизмы действия фосфолипидов разнообразны и включают, помимо восстановления структуры клеточных мембран, улучшение молекулярного транспорта, деления и дифференцировки клеток, стимуляцию активности различных ферментных систем, антиоксидантные и антифибротические эффекты [1].
13.
Пациентам с диагностированными цитолитическим и холестатическим синдромами в составе комбинированной терапии АБП (но не в комбинации с адеметионином) рекомендуется назначение препаратов для лечения заболеваний печени, содержащих янтарную кислоту: УУР – С, УДД – 5 [1, 21]. Янтарная кислота – универсальный энергетический субстрат, входящий в цикл Кребса: она участвует в энергообеспечении и восстанавливает НАД-зависимое клеточное дыхание, обеспечивая утилизацию кислорода тканями и повышая устойчивость мембран гепатоцитов к перекисному окислению [1, 22]. Преимущества сукцината (аниона янтарной кислоты) наиболее выражены в условиях гипоксии, когда НАД-зависимое клеточное дыхание угнетено. В практической деятельности широко применяются инфузии комбинированного лекарственного препарата состава инозин + меглюмин + метионин + никотинамид + янтарная кислота [1].
14.
В составе комбинированной терапии всем пациентам с АБП рекомендуется применение метадоксина: УУР – С, УДД – 5 [1, 23]. Это средство для лечения алкоголизма активирует ферменты печени, участвующие в метаболизме этанола (алкогольдегидрогеназу и ацетальдегиддегидрогеназу), ускоряет выведение этанола и ацетальдегида из организма и соответственно, снижает их токсическое воздействие. Метадоксин стимулирует холинергическую и ГАМК-ергическую нейротрансмиттерные системы, улучшает функции мышления и короткой памяти, препятствует возникновению двигательного возбуждения, оказывает неспецифическое антидепрессивное и анксиолитическое действие, снижает влечение к алкоголю, уменьшает психические и соматические проявления похмельного синдрома, сокращает время купирования абстинентного синдрома. Гепатопротекторное действие метадоксина обусловлено мембраностабилизирующим эффектом и основано на способности восстанавливать соотношение насыщенных и ненасыщенных свободных жирных кислот и повышать устойчивость гепатоцитов в условиях окислительного стресса [1].



