Диагностика
1
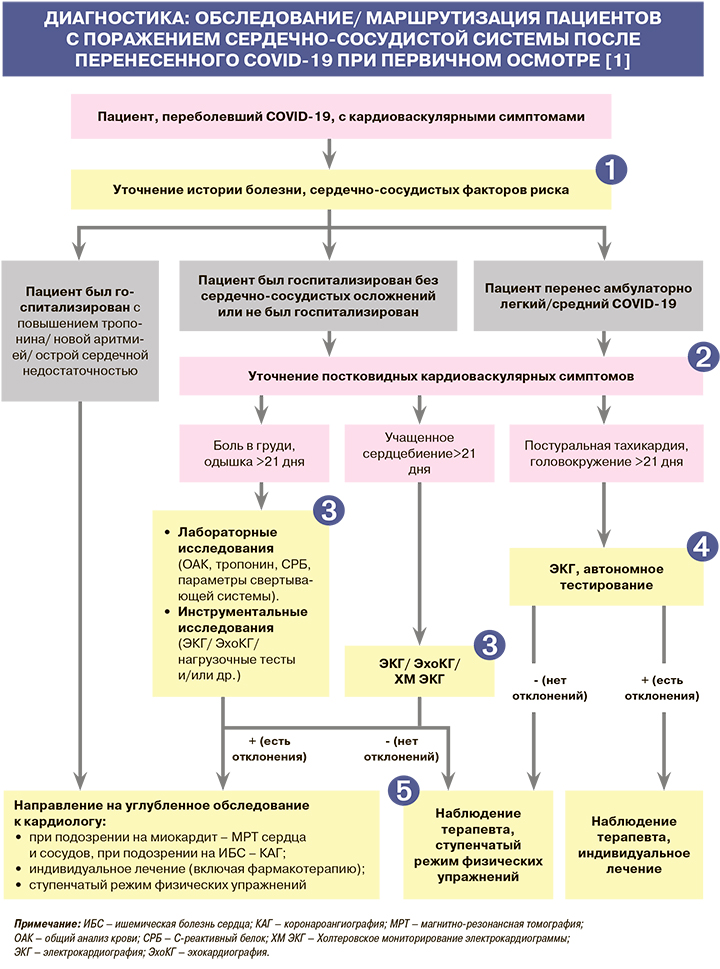
• Пациенты с несколькими факторами кардиоваскулярного риска после перенесенной коронавирусной инфекции должны быть обследованы с целью как можно более раннего выявления сердечно-сосудистых заболеваний (ССЗ) и назначения соответствующей терапии. К факторам риска развития ССЗ при Long-COVID относятся тяжелое течение перенесенной инфекции (длительное пребывание в ОРИТ/искусственная вентиляция легких), более 5 симптомов COVID-19 в первую неделю острого заболевания, супераддированная инфекция, сопутствующие патологии, включая уже имеющиеся ССЗ (артериальная гипертензия и др.), сахарный диабет, ожирение, хроническая болезнь почек, курение, пожилой возраст и др. [1, 2].
• Пациенты после перенесенного COVID-19 имеют существенно более высокую вероятность серьезных сердечно-сосудистых событий в течение срока до 1 года после выписки по сравнению с контрольной группой, сопоставимой по возрасту, полу и факторам риска [1, 3, 4]. При проведении когортного анализа (86 472 пациента) было показано увеличение более чем в 6 раз риска развития острого нарушения мозгового кровообращения (НМК) и инфаркта миокарда (ИМ) через 2 нед после COVID-19 относительно контрольной группы: ИМ – в 6,61 (3,56–12,20), ишемического инсульта – в 6,74 (3,71–12,20) раза [5]. На основании этого сделано заключение, что COVID-19 служит независимым фактором риска развития ИМ и инсульта, а острые сердечно-сосудистые осложнения могут представлять собой существенное клиническое проявление COVID-19, чьи долгосрочные последствия способны стать проблемой в будущем [5].
2
Кардиальные симптомы, такие как сердцебиение, боль и дискомфорт в грудной клетке (стеснение в груди), плохая переносимость физической нагрузки, головокружение, высокая частота сердечных сокращений (ЧСС) в состоянии покоя, могут стать клинической дилеммой при Long-COVID. Эти симптомы проявляются как у ранее госпитализированных пациентов, так и после легких форм заболевания. Нет четкой связи сердечно-сосудистых симптомов при Long-COVID с ранее существовавшей кардиоваскулярной патологией. Врачи должны четко дифференцировать две клинические ситуации – кардиореспираторные симптомы как неспецифическое проявление синдрома длительного COVID-19 и манифестацию патологии сердечно-сосудистой системы [1, 6].
3
• Результаты лабораторных исследований через ≥4 нед после дебюта COVID-19, требующие направления пациента для углубленного обследования к кардиологу [1]:
– повышение нормы уровня тропонина I – выше верхней границы при количественном определении и (+) результат при качественном определении;
– снижение уровня гемоглобина, отклонения от референтных значений уровня лейкоцитов и лейкоцитарной формулы, повышение уровня скорости оседания эритроцитов (СОЭ), число тромбоцитов <100×109/л;
– отклонения от референтных значений параметров свертывающей системы крови (в том числе удлинение протромбинового времени на ≥3 с, фибриноген >4 г/л);
– повышение уровня С-реактивного белка (СРБ);
– повышение выше референтных границ уровня N-концевого пропептида натриуретического гормона В-типа (NT-pro-BNP, при возможности определения).
– Д-димер >1000 нг/мл.

• В рамках комплексного лабораторного исследования пациента с кардиоваскулярными симптомами Long-COVID для выявления/исключения сопутствующих заболеваний, относящихся к факторам сердечно-сосудистого риска, также проводятся оценка глюкозы плазмы натощак, липидного профиля, мочевой кислоты, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), билирубина, общего белка, креатинина, скорости клубочковой фильтрации (СКФ), калия, натрия, общий анализ мочи [1].
• Результаты инструментальных исследований через ≥4 нед после перенесенного COVID-19, требующие направления пациента для углубленного обследования к кардиологу, отражены в таблице. Помимо указанных методов, при обследовании пациента целесообразно измерение сатурации крови кислородом, выполнение теста с 6-минутной ходьбой [1].
4
• Для диагностики ортостатических расстройств должны выполняться ортостатические пробы.
В рамках сбора анамнеза следует провести оценку потребления пациентом соли и воды, приема лекарственных средств, способных провоцировать такие расстройства (альфа-адреноблокаторы, блокаторы кальциевых каналов, ингибиторы обратного захвата серотонина, трициклические антидепрессанты, фенотиазин) [1].
5
В том случае, если у пациента будут исключены наличие ССЗ и необходимость в специфической терапии, лечение должно сосредоточиться на симптоматическом подходе, а также физической и психической реабилитации [1, 7].
Лечение
1
• Перенесенный COVID-19 повышает риск развития ССЗ. Следствием прямого воздействия вируса SARS-CoV-2 и «цитокинового шторма» может стать развитие нарушений в системе свертывания крови. При этом отмечается активация тромбоцитарного и коагуляционного механизмов гемостаза. В частности, формирующиеся тромбы состоят не только из фибрина, но и из большого количества тромбоцитов [12, 13]. По современным представлениям микрои макрососудистый тромбоз, а также дестабилизация атеросклеротической бляшки представляют собой возможные механизмы, вызывающие сердечно-сосудистые осложнения COVID-19 и, в частности, существенное повышение риска развития инфаркта миокарда и ишемического инсульта (см. комментарии в разделе «Диагностика», пункт 1) [5].
• В когортном исследовании почти 1 млн европейских пациентов с COVID-19, включившем в основном амбулаторных больных, была показана примерно равная частота развития артериальных и венозных тромбоэмболических событий в течение 90 дней после даты постановки диагноза [14]. При сравнении баз данных в США, содержащих около 150 тыс пациентов с коронавирусной инфекцией и группу контроля порядка 6 млн человек, было продемонстрировано, что повышенный риск артериальных сердечно-сосудистых осложнений наблюдается как у стационарных, так и у амбулаторных пациентов и прослеживается на протяжении 1 года [15].
• Возникновение сердечно-сосудистых осложнений, прежде всего инфарктов и инсультов, связано с повышенной смертностью, что подчеркивает важность использования антиагрегантов у пациентов с СOVID-19, в частности, раннего назначения ацетилсалициловой кислоты (АСК) в низких дозах для профилактики атеротромботических осложнений [1, 16].
2
После перенесенной коронавирусной инфекции пациенты с несколькими факторами кардиоваскулярного риска должны быть обследованы с целью как можно более раннего выявления ССЗ (стабильной ИБС) и назначения соответствующей терапии, включая антиагрегантную (чаще всего ацетилсалициловой кислоты) [1]. Особое внимание врачам следует обращать на пациентов с такими факторами риска, как артериальная гипертензия, дислипидемия, курение, стресс и психосоциальные факторы, избыточная масса тела и ожирение, гипергликемия (сахарный диабет), потребление алкоголя, низкая физическая активность, неполноценное питание [10].
3
• В настоящее время COVID-19 рассматривается как дополнительный фактор сердечно-сосудистого риска, так как при этом заболевании повышается вероятность тромбообразования, проявляющегося в виде инфарктов и инсультов [5, 17, 18]. У пациентов без ССЗ высокого и очень высокого сердечно-сосудистого риска, перенесших коронавирусную инфекцию и не получающих АСК, следует пересмотреть основания к назначению препарата, принимая во внимание факт перенесенного инфекционного заболевания как дополнительный фактор сердечно-сосудистого риска. В связи с этим, по мнению ряда авторов, применение ацетилсалициловой кислоты (АСК) для профилактики тромбозов в период постковид рационально, что подтверждается положительными результатами клинических исследований и метаанализов, посвященных изучению профилактического приема этого лекарственного средства для снижения риска тромбозов [19, 20]. Godino C. et al. (2020) установили, что АСК и другие антиагреганты способны оказывать прямое действие на звенья патогенеза гипервоспаления при COVID-19 и одновременно уменьшать тромбообразование [21].
• Российские эксперты рекомендуют использовать минимально возможную дозу АСК (75 мг) в лекарственной форме, всасывающейся в желудке (без кишечнорастворимого покрытия) [16].
• Результаты ретроспективного исследования 2021 г. продемонстрировали, что у больных, госпитализированных по поводу тяжелого течения COVID-19, которые постоянно получали АСК (n=336), риск смерти был статистически значимо ниже, чем у пациентов, не принимавших АСК (n=655): скорректированное отношение рисков (ОР) составило 0,753 (95% доверительный интервал (ДИ): 0,573–0,991; p=0,043) [22].
• По данным другого ретроспективного исследования 2021 г., прием профилактических доз АСК до госпитализации по поводу COVID-19 оказывал сопоставимое с антикоагулянтной терапией положительное влияние на показатели госпитальной смертности. ОР смерти на фоне приема АСК составляло 0,522 (95% ДИ: 0,336–0,812), а при использовании антикоагулянтов в профилактических дозах – 0,518 (95% ДИ: 0,308–0,872) [23]. Другие исследователи при изучении ретроспективных данных когорты пациентов с COVID-19 (n=35 370) также выявили снижение риска смертности в течение 14 дней (ОР=0,38; 95% ДИ: 0,32–0,46) и 30 дней (ОР=0,38; 95% ДИ: 0,33–0,45) при использовании профилактических доз АСК до заболевания [24].
4
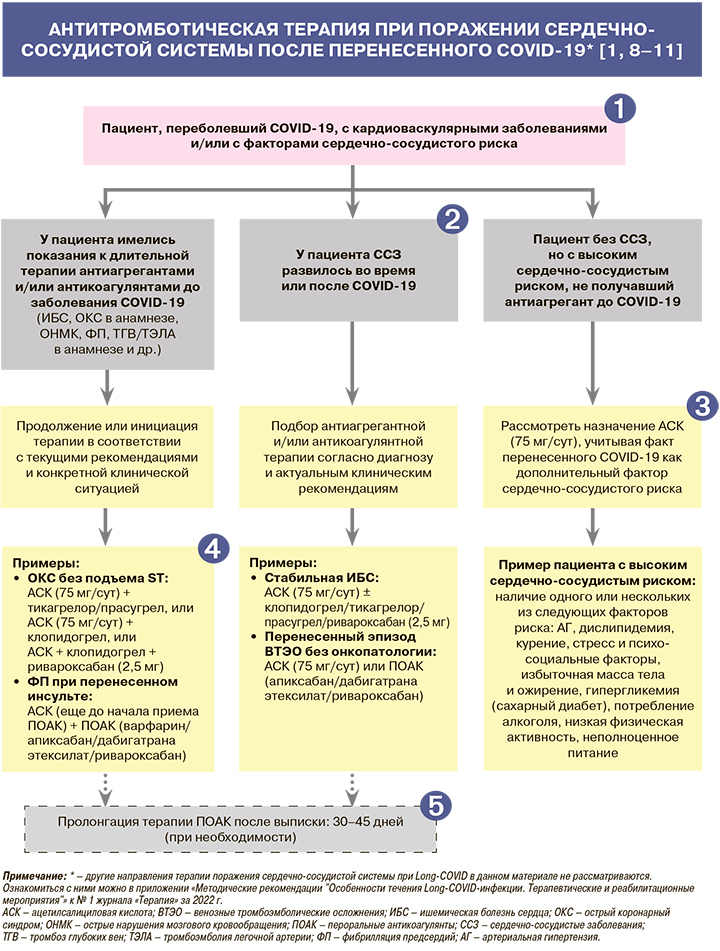
• Возможная схема совместного применения антитромботических препаратов у пациентов, инфицированных SARS-CoV-2, и в постковидный период может включать антиагрегант, получаемый по поводу основного кардиологического заболевания (чаще всего АСК) и антикоагулянт для профилактики тромботических осложнений. При назначении двойной или тройной антитромботической терапии необходимо оценивать соотношение пользы предотвращения тромботических событий и риска кровотечений [1].
• Для снижения риска геморрагических осложнений российские эксперты рекомендуют применять минимально возможную дозу АСК 75 мг, а также форму АСК, всасывающуюся в желудке (без кишечнорастворимого покрытия) [16]. У пациентов с высоким геморрагическим риском целесообразен дополнительный прием ингибиторов протонной помпы [1].
• Согласно ряду исследований, желудочнорастворимая форма АСК, представленная в России препаратом состава АСК (75 мг) + магния гидроксид, обеспечивает лучшую биодоступность и, как следствие, более предсказуемую эффективность по сравнению с кишечнорастворимыми формами этого антиагреганта [25–29]. Антацид, являющийся буфером, создает для частиц АСК микроокружение, ускоряющее ее растворение в желудке, что приводит к ускорению абсорбции и уменьшению время контакта препарата со слизистой оболочкой желудка [30]. Наряду с этим прием желудочнорастворимой формы АСК почти в 6 раз реже приводит к развитию язв тонкого кишечника по сравнению с препаратами, всасывающимися в кишечнике [31]. АСК в дозе менее 100 мг в 2,5 раза реже вызывает кровотечения по сравнению с дозой 100 мг и выше [32]. В свою очередь, наличие гидроксида магния в составе препарата АСК снижает частоту диспепсии в 2,6 раза по сравнению с АСК в кишечнорастворимой оболочке [33].
5
• У пациентов с Long-COVID после выписки допустима пролонгация антикоагулянтной терапии до 45 дней в соответствии с рассчитанным тромботическим риском. Продленная профилактика ТГВ/ТЭЛА (вплоть до 30–45 дней после выписки) может назначаться пациентам только при наличии одного из следующих признаков: возраст старше 60 лет, госпитализация в ОРИТ, активное злокачественное новообразование, сохраняющееся выраженное ограничение подвижности, концентрация D-димера в крови, в 2 и более раза превышающая верхнюю границу нормы. Профилактику ТГВ нижних конечностей/ТЭЛА стоит рассматривать у больных со среднетяжелой формой COVID-19, которые лечатся дома и имеют высокий риск венозных тромбоэмболических осложнений и низкий риск кровотечений. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 не ясна и, по-видимому, может продолжаться вплоть до 30 сут в зависимости от динамики клинического состояния пациента и сроков восстановления двигательной активности [1].
• Нет оснований для пролонгации применения антикоагулянтов более 30 дней для амбулаторных пациентов и более 45 дней после выписки из стационара с целью тромбопрофилактики без четких показаний. С точки зрения некоторых исследователей, анализ клинического статуса пациентов (гиперкоагуляционное состояние, повышение С-реактивного белка, D-димера, фибриногена) позволяет не использовать унифицированную стратегию длительности применения антикоагулянтов у пациентов с синдромом длительного COVID-19 [1].



