Диагностика

1
• Факторы риска развития и прогрессирования атеросклероза, при наличии которых показан скрининг на дислипидемию, представлены в таблице 1. На первом этапе обследования собирается анамнез, во время которого выясняется наличие у пациента ишемической болезни сердца (ИБС), артериальной гипертензии (АГ), сахарного диабета (СД), атеросклероза периферических артерий, семейной гиперхолестеринемии (СГХС), метаболического синдрома, ожирения, хронической болезни почек (ХБП). При сборе семейного анамнеза особое внимание должно уделяться раннему проявлению сердечно-сосудистых заболеваний (ССЗ) у родственников пациента первой линии родства [1].

2
• Всем пациентам для выявления клинических признаков нарушений липидного обмена и признаков состояний/заболеваний, обусловленных нарушениями липидного обмена, рекомендовано проводить физикальное обследование в следующем объеме: осмотр (липоидная дуга роговицы у лиц моложе 45 лет, ксантелазмы, ксантомы); пальпация основных магистральных артерий верхних и нижних конечностей, сонных артерий; определение характера пульса; аускультация сердца и магистральных сосудов; измерение окружности талии: уровни достоверности доказательств согласно рекомендациям Европейского общества кардиологов/Европейского общества атеросклероза (ЕОК/ЕОА) – нет (уровень убедительности рекомендаций согласно действующим российским клиническим рекомендациям (УУР) – C, уровень достоверности доказательств согласно действующим российским клиническим рекомендациям (УДД) – 5) [1].
• Ксантомы представляют собой очаговые образования различного цвета (от нормального до желто-коричневого, оранжевого или розового), которые чаще всего располагаются в области сухожилий, суставов, на ладонях, стопах, ягодицах, бедрах. Ксантелазмы – это плоские, желтые, образования на коже век, величина которых колеблется от нескольких миллиметров до 3–5 см и более. Липоидная дуга роговицы (рис. 1) имеет диагностическое значение при обследовании лиц моложе 40–45 лет.

• Следует подчеркнуть, что многие пациенты с повышенным уровнем липидов сыворотки крови могут не иметь никаких жалоб. Наличие симптомов зависит от локализации атеросклеротического процесса – сосудистого бассейна, который преимущественно вовлечен в процесс (табл. 2) [1].

3
• Всем лицам старше 40 лет рекомендуется скрининг, включающий биохимический анализ крови по оценке нарушений липидного обмена (липидный профиль) с целью стратификации сердечно-сосудистого риска по шкале SCORE 2: ЕОК/ЕОА – I C (УУР – С, УДД – 5) [1]. Традиционно образцы крови для анализа липидов берутся натощак, однако последние исследования говорят о том, что колебания концентрации липидов плазмы крови незначительны в зависимости от приема пищи [1]. Однако у лиц с гипертриглицеридемией (ГТГ) забор крови рекомендуется проводить натощак.
• Показатели липидного профиля крови, определение которых рекомендовано пациентам с подозрением на дислипидемию, отражены в таблице 3.

• Пациентам с клиническими проявлениями СГХС (ССЗ у мужчин моложе 55 лет и женщин моложе 60 лет, ксантоматоз, гиперхолестеринемия (ХС ЛНП >5 ммоль/л у взрослых, >4 ммоль/л у детей)) для установления клинического диагноза СГХС рекомендуется использовать диагностические критерии Голландских липидных клиник (Dutch Lipid Clinic Network – DLCN): ЕОК/ЕОА – I C (УУР – C, УДД – 5) [1].
• Пациентам с дислипидеией рекомендуется также лабораторное исследование с определением уровня глюкозы, креатинина, мочевины, общего билирубина в крови, определение активности аланинаминотрансферазы (АЛТ), аспартатаминотрасферазы (АСТ), креатинкиназы (КФК) в крови и общий (клинический) анализ крови: ЕОК/ЕОА – I C (УУР – С, УДД – 5) [1].
4
• В основе формулы Фридвальда лежат два допущения: 1) большая часть триглицеридов (ТГ) плазмы находится в липопротеидах очень низкой плотности (ЛОНП); 2) массовое отношение ТГ/ХС в ЛОНП равно 5:1. Формула Фридвальда позволяет получить значения ХС ЛНП, сопоставимые с полученными референсным методом, при уровне ТГ <200 мг/дл, при концентрации 200–400 мг/дл возможна ошибка расчетов. Применение этой формулы при концентрации ТГ> 400 мг/дл, наличии хиломикронов (ХМ), дислипидемии III типа приводит к завышению содержания ХС ЛОНП и занижению ХС ЛНП и не позволяет получить корректные результаты. В настоящее время разработаны прямые методы выделения ЛНП, пригодные для использования в клинико-диагностической лаборатории [1].
• Поскольку прямое измерение ХС ЛНП имеет свои ограничения, особенно при метаболическом синдроме, СД, ГТГ, в этих случаях целесообразно ориентироваться на показатели холестерина, не связанного с липопротеидами высокой плотности (ХС неЛВП). У пациентов с метаболическим синдромом, СД, ожирением он имеет более высокий уровень прогностической значимости по сравнению с ХС ЛНП [1, 3].
5
• Всем пациентам с дислипидемией рекомендовано дуплексное сканирование брахиоцефальных артерий: ЕОК/ЕОА – IIaВ (УУР – А, УДД – 1) [1].
• Визуализация коронарных артерий с помощью компьютерной томографии (КТ) сердца и сонных артерий методом дуплексного сканирования экстракраниальных отделов брахиоцефальных артерий служит информативным методом в выявлении атеросклеротического поражения артерий. Обнаружение кальцификации коронарной артерии с помощью неконтрастной КТ дает хорошую оценку атеросклеротической нагрузки и тесно связано с риском сердечно-сосудистых осложнений.
КТ-ангиография имеет высокую чувствительность (95–99%) и специфичность (64–83%) для диагностики ИБС. Для скрининга атеросклероза коронарных артерий может использоваться кальциевый индекс (КИ), определяемый при КТ по Agatston. Это исследование позволяет обеспечить дополнительную стратификацию риска, имеет меньшую стоимость, не требует внутривенного введения контрастных веществ. Использование КИ улучшает как дискриминацию, так и реклассификацию категории риска (табл. 4) [1].

• У пациентов с выявленными атеросклеротическими бляшками в сонной или бедренной артерии по данным дуплексного сканирования рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективного управления определяющими риск факторами: ЕОК/ЕОА – IIaВ (УУР – А, УДД – 1) [1]. Оценка атеросклеротических бляшек в сонной или бедренной артерии с помощью ультразвука является прогностическим фактором сердечно-сосудистых событий, сравнимым с КИ, в то время как измерение толщины интимы-медиа сонной артерии уступает КИ и наличию бляшек в сонной артерии и не используется в качестве стратификатора риска [1].
• У пациентов с коронарным атеросклерозом и значением КИ выше 100 единиц по данным КТ сердца рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективной коррекции факторов риска: ЕОК/ЕОА – IIaВ (УУР – В, УДД – 2) [1]. У бессимптомных лиц с умеренным риском наличие КИ >100 единиц по Agatston и наличие атеросклеротических бляшек в сонной или бедренной артерии по данным дуплексного сканирования может перевести их в категорию более высокого риска. При этом КИ невысок и имеет низкую специфичность у пациентов моложе 45 лет с тяжелой СГХС, включая гомозиготную СГХС [1].
6
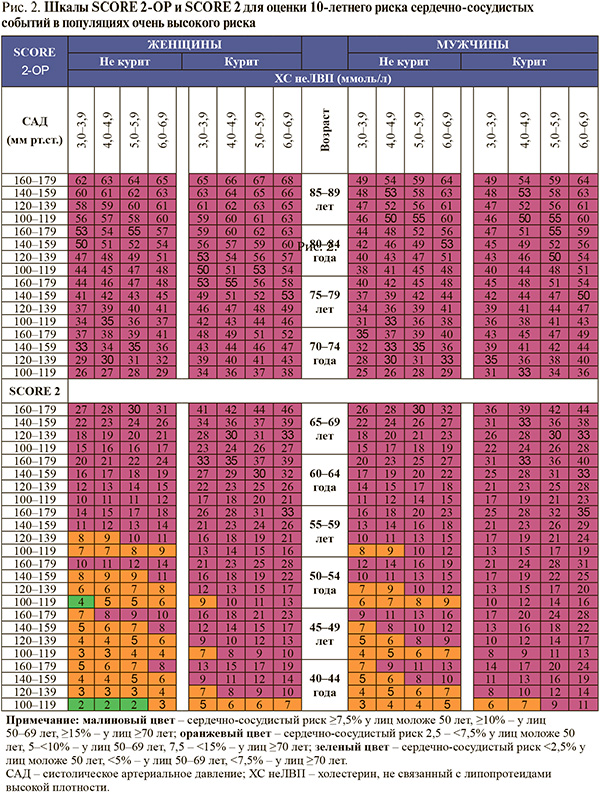
• У всех бессимптомных взрослых старше 40 лет, без ССЗ, СД, ХБП, СГХС, с ХС ЛНП <4,9 ммоль/л рекомендуется проведение скрининга для оценки общего риска с использованием шкалы SCORE 2: ЕОК/ЕОА – IC (УУР – C, УДД – 5) [1]. Для оценки сердечнососудистого риска по шкале SCORE 2 (рис. 2) следует выбрать квадрат в зависимости от пола, возраста и статуса курения пациента. В найденном квадрате следует отыскать ячейку, наиболее соответствующую уровню систолического АД и ХС неЛВП данного пациента [1].
• Оценка риска по шкале SCORE 2 не рекомендована у лиц с подтвержденным ССЗ, СД, ХБП, с единственным, но выраженным фактором риска (например, тяжелая АГ), с СГХС. Такие пациенты автоматически относятся к группе очень высокого и высокого риска сердечно-сосудистых осложнений и требуют интенсивной коррекции факторов риска. Наличие стеноза более 50% в крупных (магистральных) артериях любого сосудистого бассейна по данным любых инструментальных методов исследования, даже в отсутствие клинических симптомов, также переносит пациента в категорию очень высокого риска [1].
• Пациентов с установленными ранее ССЗ, СГХС, СД, ХБП 3–5 стадий, очень высоким риском по шкале SCORE 2 или уровнем ХС ЛНП >4,9 ммоль/л рекомендовано относить к категории высокого или очень высокого риска с целью эффективного управления определяющими факторами риска: ЕОК/ЕОА – IC (УУР – C, УДД – 5) [1]. Следует обратить особое внимание на выделение внутри категории очень высокого риска категории экстремального риска. К этой группе следует относить пациентов с наличием ≥2 сердечно-сосудистых осложнений в течение 2 лет, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП <1,4 ммоль/л [1].
• Пациентов с СГХС и атеросклеротическими ССЗ рекомендовано относить к категории очень высокого риска с целью эффективного управления определяющими факторами риска: ЕОК/ЕОА – IC (УУР – В, УДД – 2) [1]. Под атеросклеротическим ССЗ подразумевают все проявления ИБС, ишемический инсульт или транзиторное нарушение мозгового кровообращения, атеросклероз артерий нижних конечностей [1].
• Пациентов с СГХС, но без АССЗ рекомендовано относить к категории высокого риска с целью эффективного управления определяющими факторами риска: ЕОК/ЕОА – IC (УУР – В, УДД – 2) [1].
7
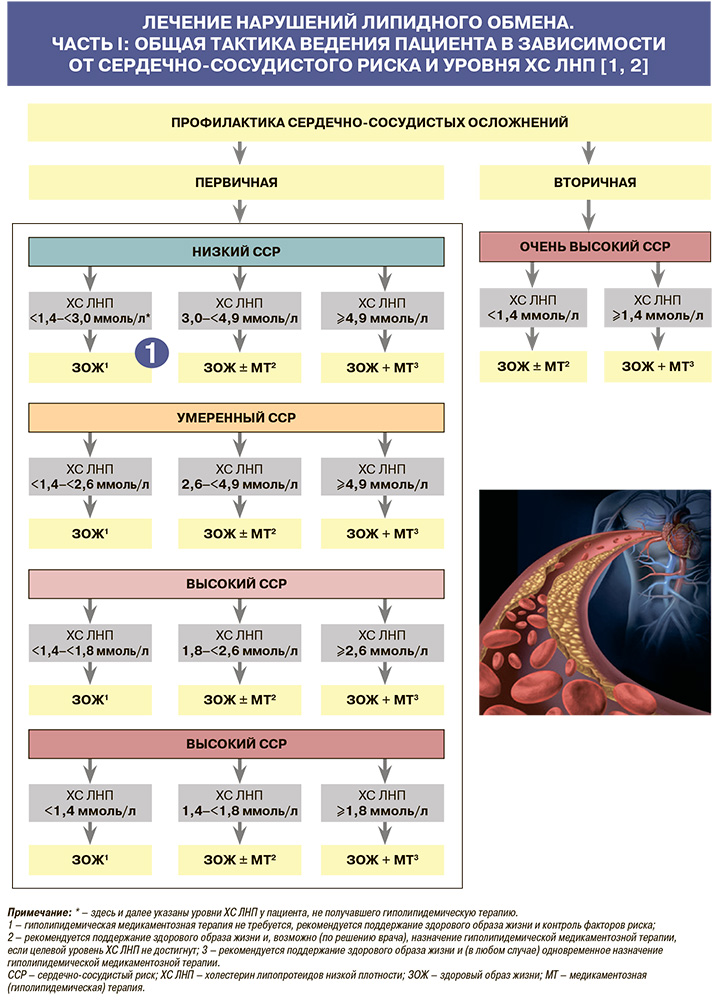
• У пациентов низкого сердечно-сосудистого риска рекомендован целевой уровень ХС ЛНП <3,0 ммоль/л: ЕОК/ЕОА – IIbA (УУР – С, УДД – 5) [1].
• У пациентов умеренного риска рекомендован целевой уровень ХС ЛНП <2,6 ммоль/л для первичной профилактики ССЗ: ЕОК/ЕОА – IIаA (УУР – С, УДД – 5) [1].
• У пациентов высокого риска рекомендован целевой уровень ХС ЛНП <1,8 ммоль/л и его снижение по меньшей мере на 50% от исходного: ЕОК/ЕОА – IA (УУР – С, УДД – 5) [1].
• У пациентов очень высокого риска рекомендовано достижение целевого уровня ХС ЛНП <1,4 ммоль/л и снижение по меньшей мере на 50% от исходного через 8±4 нед терапии как для первичной, так и вторичной профилактики сердечно-сосудистых осложнений: ЕОК/ЕОА – IС (УУР – С, УДД – 5) [1].
• У пациентов с подтвержденным атеросклеротическим ССЗ, перенесших повторное сосудистое событие в течение 2 лет (в любом сосудистом бассейне), несмотря на прием максимально переносимой дозы статина, рекомендован целевой уровень ХС ЛНП <1,0 ммоль/л: ЕОК/ЕОА – IС (УУР – С, УДД – 5) [1].
• Оптимальные значения липидных параметров в зависимости от категории сердечно-сосудистого риска суммированы в таблице 5.

Лечение
1
• В рамках здорового образа жизни с целью профилактики ССЗ доказала свое преимущество диета с высоким уровнем употребления фруктов, овощей, цельнозерновых злаков и клетчатки, орехов, рыбы, птицы и молочных продуктов, с низким содержанием жира и ограниченным потреблением сладостей, сладких напитков и красного мяса. Рекомендуется использовать жиры растительных масел. Такая диета является эффективным средством первичной и вторичной профилактики атеросклероза [1]. В частности, многоцентровое рандомизированное исследование PREDIMED, с участием лиц из группы высокого сердечно-сосудистого риска, но без ССЗ, доказало снижение частоты основных кардиоваскулярных осложнений (инфаркта миокарда, инсульта или смерти от сердечно-сосудистой причины) на 28–31% при ежедневном употреблении оливкового масла или орехов [1, 4].
• Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы, по крайней мере дважды в неделю, и омега-3 полиненасыщенных жирных кислот в низких дозах в качестве пищевой добавки могут снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеидов плазмы [1, 5]. Оценка биологически активных добавок и функциональных продуктов питания должна в обязательном порядке включать не только доказательства полезных свойств по влиянию на липидный профиль и атеросклероз, но также и их хорошую переносимость. Важным является производственный стандарт для указанных продуктов, гарантирующий стандартизацию и качество. К пищевым добавкам, влияющим на липидный профиль, относится красный дрожжевой рис (монаколин), действие которого, как и статинов, связано с ингибированием ГМГ-КоА-редуктазы.
В крупном китайском исследовании у больных с ИБС монаколин снижал частоту сердечно-сосудистых на 45% [1, 6]. Гипохолестеринемический эффект (снижение ХС ЛНП на 15–25%) наблюдается при ежедневном приеме монаколина K в дозе 10 мг [1, 7]. Монаколин К можно применять с учетом его доказанной клинической эффективности и безопасности у лиц низкого и умеренного сердечно-сосудистого риска с умеренно повышенным ХС ЛНП в отсутствие показаний для приема статинов [1].
• Немедикаментозные методы, направленные на снижение уровня ТГ, наряду с диетой включают в снижение избыточной массы тела (достижение/поддержание индекса массы тела 20–25 кг/м2, окружности талии <94 см у мужчины и <80 см у женщин), уменьшение потребления алкоголя (пациентам с ГТГ следует полностью воздержаться от приема спиртного), увеличение регулярной физической активности (физические упражнения минимум 30 мин каждый день), ограничение в потреблении легко всасываемых углеводов [1, 2]. Влияние немедикаментозных мер на уровень липидов отражено в таблице 6.

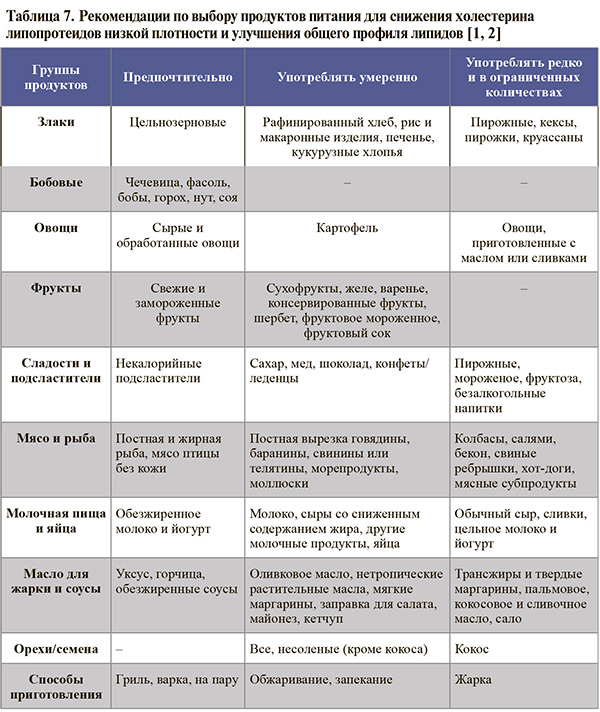
• Рекомендации для пациентов по диете в целях улучшения общего профиля липопротеидов представлены в таблице 7.
2
• Перед началом гиполипидемической терапии следует провести как минимум два измерения уровня липидов с интервалом в 1–12 нед, за исключением пациентов с острым коронарным синдромом и относящихся к категории очень высокого риска [1].
• При планировании гиполипидемической медикаментозной терапии рекомендуется придерживаться следующей схемы [1]:
– оценить общий риск развития ССЗ;
– обсудить с пациентом особенности профилактики ССЗ;
– определить целевые уровни ХС ЛНП в соответствии с категорией риска;
– подсчитать в процентах степень снижения уровня ХС ЛНП, необходимого для достижения целевого значения;
– выбрать из группы статинов препарат, который может обеспечить такой уровень снижения ХС ЛНП;
– эффективность и переносимость терапии статинами вариабельны, поэтому может потребоваться титрация дозы препарата;
– если монотерапия статином не позволяет достичь цели, следует рассмотреть возможность комбинированной терапии, в том числе статина с эзетимибом, предпочтительно в одной таблетке или капсуле (розувастатин + эзетимиб или аторвастатин + эзетимиб). У лиц очень высокого риска возможно начать гиполипидемическую терапию сразу с комбинации статина с эзетимибом;
– врачу необходимо убедить пациента в необходимости непрерывной (пожизненной) гиполипидемической терапии.
3
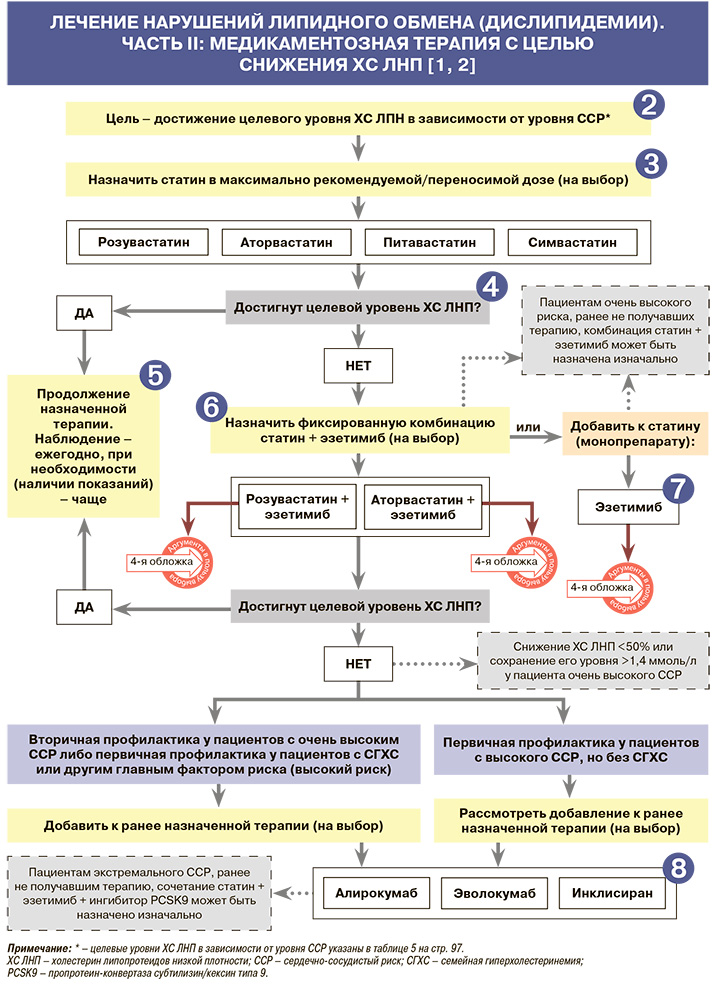
• Всем пациентам с дислипидемией рекомендована терапия статином в дозах, необходимых для достижения целевого уровня ХС ЛНП: ЕОК/ЕОА – IA (УУР – В, УДД – 1) [1].
• Статины – одни из наиболее изученных классов препаратов в профилактике ССЗ. Результаты многочисленных клинических исследований свидетельствуют о том, что эти лекарственные средства значительно снижают заболеваемость и смертность от ССЗ при первичной и вторичной профилактике во всех возрастных группах как у мужчин, так и у женщин. В клинических исследованиях статины замедляли прогрессирование и даже вызывали регрессию атеросклеротической бляшки. Крупнейший метаанализ 19 исследований показал, что снижение уровня ХС ЛНП на 1,0 ммоль/л при приеме различных статинов снижает смертность от всех причин на 14%, частоту сердечно-сосудистых событий – на 27%, нефатальных и фатальных коронарных осложнений – на 27%, инсульта – на 22% [1, 8]. Относительное снижение риска при первичной профилактике сопоставимо с таковым во вторичной профилактике. Доступные данные позволяют предположить, что клинический эффект в значительной степени зависит не от препарата, а от степени снижения ХС ЛНП [1].
• В порядке убывания гиполипидемического эффекта зарегистрированные в России статины располагаются следующим образом: розувастатин (суточные дозы 5, 10, 15, 20 и 40 мг), аторвастатин (10, 20, 30, 40 и 80 мг), питавастатин (1, 2 и 4 мг), симвастатин (10, 20 и 40 мг). Максимальное снижение ХС ЛНП (на 50–55%) возможно при применении высоких доз розувастатина и аторвастатина [1].
• В опубликованном в 2014 г. метаанализе 8 важнейших рандомизированных клинических исследований с применением статинов (n=38 153, 6286 сердечно-сосудистых осложнений у 5387 человек) была продемонстрирована меньшая частота кардиоваскулярных осложнений при уровне ХС ЛНП <1,3 ммоль/л. При сравнении с пациентами, имевшими уровень ХС ЛНП >4,5 ммоль/л, было отмечено прогрессивное снижение относительного риска (ОР) развития сердечно-сосудистых осложнений в зависимости от уровня ХС ЛНП: 2,0–2,6 ммоль/л – ОР 0,56 (95% доверительный интервал (ДИ): 0,46–0,67); 1,3–2,0 ммоль/л – ОР (ДИ: 0,42–0,62); <1,3 ммоль/л – ОР 0,44 (ДИ: 0,35–0,55) [1, 9]. В настоящее время для достижения целевого уровня ХС ЛНП и снижения риска сердечно-сосудистых осложнений оправдано использование четырех статинов: розувастатина, аторвастатина, питавастатина, симвастатина [1].
• Дозы статинов для интенсивного и умеренного снижения ХС ЛНП приведены в таблице 8. При непереносимости высокоинтенсивной терапии статинов следует рассмотреть снижение дозы препарата с последующей переоценкой переносимости [1].

4
Оценка эффективности назначенной гиполипидемической терапии (определение липидов сыворотки крови) проводится через 8 (±4) нед после ее начала [1]. Наряду с определением липидного профиля, при контроле эффективности целесообразно оценивать приверженность пациентов к соблюдению рекомендаций по изменению образа жизни и приему назначенных препаратов [10].
5
• При достижении пациентом целевого уровня липидов определение липидов сыворотки крови выполняется ежегодно, если нет проблем с приверженностью к назначенной терапии или других причин для более частого контроля [1].
• Ключевые аспекты контроля безопасности и при необходимости коррекции проводимой гиполипидемической терапии отражены в таблице 9.

6
• Пациентам, не достигшим целевого уровня ХС ЛНП на фоне максимально переносимых доз статинов, следует рассмотреть возможность комбинированной терапии, в том числе статин + эзетимиб, предпочтительно в одной таблетке или капсуле (розувастатин + эзетимиб или аторвастатин + эзетимиб): ЕОК/ЕОА – IВ (УУР – А, УДД – 2) [1].
• В исследованиях комбинация эзетимиба со статинами обеспечивала дополнительное снижение уровня ХС ЛНП на 15–20% [1]. Самым крупным и продолжительным рандомизированным клиническим исследованием по применению эзетимиба стало исследование IMPROVE-IT, включившее 18 144 больных, госпитализированных по поводу острого коронарного синдрома [1, 11]. На момент включения больные не получали эзетимиба или максимальной дозы любого статина, но должны были иметь относительно невысокий уровень ХС ЛНП (1,3–3,2 ммоль/л). Период наблюдения за больными достигал 7 лет. Через 1 год наблюдения средний уровень ХС ЛНП в группе эзетимиба составил 1,4 ммоль/л (54 мг/дл), что на было на 0,4 ммоль/л (14 мг/дл) меньше, чем в группе симвастатина. В группе комбинированного лечения статин + эзетимиб было продемонстрировано значимое снижение суммарного количества смертельных исходов вследствие сердечно-сосудистых причин, инфаркта миокарда, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации и инсульта на 6,4% (ОР 0,936; 95% ДИ: 0,89–0,99, р=0,016), снижение абсолютного риска — на 2,0% [1, 11].
• В случае значительного повышения уровня ХС ЛНП у больных очень высокого риска (>4,0 ммоль/л) рекомендуется рассмотреть возможность инициального назначения статина и эзетимиба, предпочтительно в одной таблетке или капсуле (розувастатин + эзетимиб или аторвастатин + эзетимиб): ЕОК/ЕОА – нет (УУР – А, УДД – 1) [1, 12].
7
• Прием эзетимиба в рамках монотерапии рекомендован пациентам с непереносимостью любой дозы статина: ЕОК/ЕОА – IIаC (УУР – А, УДД – 2) [1].
• В клинических исследованиях монотерапия эзетимибом сопровождалась снижением уровня ХС ЛНП на 15–22% [1]. Таким образом, эзетимиб может быть использован в качестве средства второй линии в комбинации со статинами, когда монотерапия статинами не позволяет достичь целевого уровня даже при их назначении в максимальных дозах, а также при непереносимости статинов или противопоказаниях к их приему [1].
8
• У пациентов с очень высоким риском и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина в комбинации с эзетимибом рекомендовано добавить алирокумаб (ЕОК/ЕОА – IA), эволокумаб (ЕОК/ЕОА – IA) или инклисиран (ЕОК/ЕОА – нет) с целью вторичной профилактики ССЗ: УУР – А, УДД – 1 [1].
• Ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9) алирокумаб в дозировках 75 и 150 мг и эволокумаб в дозировке 140 мг подкожно с частотой введения 1 раз в 2 нед в клинических исследованиях показали возможность снижения уровня ХС ЛНП на 60% и риска сердечно-сосудистых осложнений на 15% у больных с атеросклеротическими ССЗ в комбинации с умеренной и высокоинтенсивной терапией статинами. Исследование FOURIER включило 27 564 пациентов с атеросклеротическим поражением различных сосудистых бассейнов: 22 040 пациентов (81%) в прошлом перенесли инфаркт миокарда (из них 5500 в сроки от 4 нед до 1 года перед включением в исследование), у 5330 (19%) в анамнезе был негеморрагический инсульт и у 3640 (13%) – периферический атеросклероз. Пациенты находились на адекватной гиполипидемической терапии: 69,2% получали статины в режиме высокой интенсивности и 30,4% – умеренной интенсивности, у 5,1% дополнительно к статину назначали эзетимиб. Участники, рандомизированные в группу активного лечения, получали эволокумаб подкожно в дозе 140 мг 1 раз в 2 нед или 420 мг/мес, тогда как пациентам в группе контроля на протяжении исследования подкожно вводили плацебо [1, 13]. Медиана наблюдения в исследовании составила 2,2 года. Была подтверждена высокая гиполипидемическая эффективность эволокумаба: уровень ХС ЛНП снизился на 59% – с 2,40 до 0,78 ммоль/л. Впервые было продемонстрировано положительное влияние терапии эволокумабом на сердечно-сосудистые исходы: частота событий, оцениваемых по первичной конечной точке, в группе эволокумаба была ниже на 15% (ОР 0,85, 95% ДИ: 0,79–0,92; p <0,001), по вторичной точке — ниже на 20% (ОР 0,80, 95% ДИ: 0,73–0,88; p <0,001), чем в группе плацебо [1, 13].
• Исследование ODYSSEY OUTCOMES с участием 18 924 пациентов с перенесенным 1–12 мес назад ОКС продемонстрировало, что алирокумаб статистически значимо снижает риск крупных сердечно-сосудистых событий. Они отмечались у 903 пациентов (9,5%) в группе терапии препаратом алирокумаб и у 1052 пациентов (11,1%) в группе плацебо, что соответствует снижению относительного риска на 15% (ОР 0,85; 95% ДИ: 0,78–0,93; p <0,001). Кроме того, на фоне алирокумаба снижался риск смерти от всех причин на 15%. У пациентов с исходно более высоким уровнем ХС ЛНП (≥2,6 ммоль/л) при применении алирокумаба отмечалось более выраженное снижение риска сердечно-сосудистых событий на 24% ниже (ОР 0,76; 95% ДИ: 0,65–0,87), а смерти от всех причин – на 29% (ОР 0,71; 95% ДИ: 0,56–0,90), в сравнении с плацебо [1, 14].
• В серии клинических исследований [1, 15–17] была подтверждена долгосрочная гиполипидемическая эффективность инклисирана у пациентов с СГХС, атеросклеротическими ССЗ и эквивалентными факторами сердечно-сосудистого риска, такими как как СД 2-го типа, СГХС или 10-летний риск ССО >20% по Фрамингемской шкале. Было установлено, что назначение инклисзирана приводит к снижению уровня ХС ЛНП у указанных категорий больных на 50–58% как в краткосрочной, так и в долгосрочной перспективе [1]. Профиль безопасности инклисирана сопоставим с плацебо [1], не было получено данных о возникновении специфических серьезных нежелательных явлений, возникших в ходе лечения [1, 2]. В метаанализе по результатам трех рандомизированных клинических исследований было показано снижение частоты серьезных неблагоприятных сердечно-сосудистых событий на 24% (отношение рисков = 0,76; 95% доверительный интервал, 0,61–0,92) [1, 18].
• Пациентам с непереносимостью любой дозы статина, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП, рекомендовано добавление к терапии алирокумаба или эволокумаба или инклисирана: ЕОК/ЕОА – IIbC (УУР – А, УДД – 2) [1].
• В случае значительного повышения уровня ХС ЛНП у больных экстремального или очень высокого риска (>5,0 ммоль/л) рекомендуется рассмотреть возможность инициального назначения статина в максимально переносимой дозе + эзетимиба + ингибитора РС8К9: алирокумаба (ЕОК/ЕОА – IА; УУР – А, УДД – 1) или эволокумаба (ЕОК/ЕОА – IА; УУР – А, УДД – 1) или инклисирана (ЕОК/ЕОА – нет; УУР – А, УДД – 1) [1].
• У пациентов очень высокого сердечно-сосудистого риска без СГХС, не достигших целевого уровня ХС ЛНП на фоне максимально переносимых доз статина с эзетимибом/без эзетимиба, рекомендовано добавить к терапии алирокумаб или эволокумаб или инклисиран с целью первичной профилактики ССЗ: ЕОК/ЕОА – IIbС (УУР – А, УДД – 2) [1].
• Сравнение эффективности различных вариантов медикаментозной гиполипидемической терапии приведено в таблице 10.