Коронарная болезнь сердца в настоящее время является причиной смерти 75% больных сахарным диабетом (СД) 2-го типа [1]. В связи со стремительно возрастающей численностью больных количество операций реваскуляризации миокарда у пациентов с СД увеличивается [2].
СД — один из главных предикторов неблагоприятных клинических исходов после чрескожных коронарных вмешательств (ЧКВ) [3]. Использование стентов с лекарственным покрытием существенно улучшило клинические результаты ЧКВ у пациентов с ишемической болезнью сердца (ИБС) и СД [4—8]. Среди множества стентов выбор наиболее эффективного и безопасного лекарственного покрытия для ЧКВ у пациентов с ИБС в сочетании с СД представляет сложную задачу.
Стент Cypher, покрытый сиролимусом (СПС), — стент первого поколения, эффективность которого в лечении пациентов с ИБС и СД доказана. По сравнению с другим стентом первого поколения — Taxus с лекарственным покрытием паклитакселем — использование СПС снижает риск повторной реваскуляризации целевого поражения (РЦП) [9, 10]. СПС оказался не только эффективнее, но и безопаснее стента второго поколения Endeavor, покрытого зотаролимусом [11]. Подобные результаты позволили стенту Cypher стать «золотым стандартом» при выполнении ЧКВ у пациентов с ИБС и сопутствующим СД. На данный момент применение СПС является наиболее изученным, прослежены 5—10-летние отдаленные результаты [12, 13]. Однако проблема рестенозов и тромбозов стентов (ТС), в частности, очень поздних тромбозов, все еще актуальна, особенно у пациентов с ИБС в сочетании с СД. Стенты второго поколения, покрытые эверолимусом (Xience и Promus Element), призваны обеспечить лучшие результаты ЧКВ у пациентов с ИБС и сопутствующим СД, которые являются самой тяжелой группой по частоте развития сердечно-сосудистых осложнений.
Исследований, сравнивающих результаты ЧКВ с использованием СПС и стентов, покрытых эверолимусом (ЭПС), у пациентов с ИБС в сочетании с СД, немного.
Целью настоящего исследования явилось изучение влияния лекарственного покрытия стента на результаты ЧКВ у больных ИБС в сочетании с СД по данным 12-месячного периода наблюдения.
Материал и методы
В исследование были включены 112 пациентов со стабильной стенокардией напряжения III—IV функционального класса (ФК) в сочетании с СД 2-го типа. В зависимости от типа лекарственного покрытия имплантируемого стента пациенты были подразделены на 2 группы. В 1-ю группу были включены 54 пациента, которым имплантированы ЭПС, во 2-ю (контрольную) группу — 58 пациентов с имплантированными СПС. Контрольная группа была отобрана ретроспективно, чтобы полностью соответствовать исследуемой группе. Обе группы были сопоставимы по основным клиническим и ангиографическим характеристикам — возрасту, полу, сопутствующим заболеваниям, протяженности поражения коронарных артерий (КА) и локализации поражения в КА (табл. 1).

Критериями включения являлись стабильная стенокардия напряжения III—IV ФК по классификации Канадской ассоциации кардиологов; СД 2-го типа; наличие гемодинамически выраженного (70% и более) стеноза КА в системе передней межжелудочковой артерии, огибающей артерии или правой КА; положительный непосредственный ангиографический результат после ЧКВ.
Критерии исключения: СД 1-го типа; гемодинамически значимое (более 50%) поражение ствола левой КА; многососудистое поражение КА (оценка по шкале Syntax >22 баллов); невозможность приема двухкомпонентной антиагрегантной терапии; диаметр пораженного сосуда менее 2,0 мм; имплантация стентов с различным лекарственным покрытием; наличие ЧКВ или аортокоронарного шунтирования (АКШ) в анамнезе.
Стандартный объем клинико-инструментальных и лабораторных исследований включал физикальное, инструментальное и лабораторное исследования согласно протоколу, принятому в РНЦХ им. Б.В. Петровского [14]. Диагноз СД считался подтвержденным у всех пациентов, получающих пероральную гипогликемическую терапию или инсулинотерапию.
Под непосредственным положительным ангиографическим результатом ЧКВ понимали отсутствие или наличие <10% остаточного стеноза, кровоток по шкале TIMI III и отсутствие любых типов диссекции в стентированной артерии.
Под непосредственным положительным клиническим результатом ЧКВ понимали полное исчезновение стенокардии (или уменьшение как минимум на 2 ФК) и объективных признаков ишемии миокарда, а также отсутствие острого нарушения мозгового кровообращения в госпитальном периоде и ИМ.
Под госпитальным периодом наблюдения подразумевали время пребывания больного в клинике со дня проведения ЧКВ и до дня выписки.
Под отдаленной клинической эффективностью ЧКВ понимали отсутствие повторных реваскуляризаций в ранее стентированном сегменте.
Под клинической безопасностью ЧКВ в отдаленном периоде наблюдения понимали отсутствие развития острого ИМ и летальных исходов.
Конечной точкой исследования выбран комбинированный показатель безопасности и эффективности — частота развития неблагоприятных клинических событий (НКС) в течение 12 мес. Под ними подразумевали смерть пациента, развитие нефатального ИМ и клинически показанную РЦП в течение 12 мес. Диагноз ИМ после ЧКВ выставляли согласно принятому 3-му универсальному определению ИМ [15].
 РЦП — повторное выполнение ЧКВ или АКШ ввиду возникновения рестеноза (более 50%) целевого поражения в сочетании с объективными признаками ишемии миокарда. Под целевым поражением понимали участок КА с имплантированным стентом плюс 5 мм по проксимальному и дистальному краям стента.
РЦП — повторное выполнение ЧКВ или АКШ ввиду возникновения рестеноза (более 50%) целевого поражения в сочетании с объективными признаками ишемии миокарда. Под целевым поражением понимали участок КА с имплантированным стентом плюс 5 мм по проксимальному и дистальному краям стента.
ТС оценивали согласно принятой в настоящее время классификации ARC [16].
Под прогрессированием атеросклеротического процесса подразумевали возникновение гемодинамически значимого стеноза в ранее неизмененном сегменте КА или увеличение степени выраженности ранее выявленных стенозов.
Отдаленные результаты исследования оценивали при амбулаторном обследовании больных, по данным телефонного опроса, а также при повторной госпитализации. Пациентов, у которых повторная реваскуляризация проводилась не в РНЦХ им. Б.В. Петровского, просили предоставить диск с записью коронарографии или повторного вмешательства (в случае ЧКВ).
Результаты исследования оценивали по 3 контрольным точкам: 30 дней, 6 и 12 мес после ЧКВ.
Статистическая обработка результатов исследования проводилась с использованием программ MedCalc, BioStat, Excel. Количественные показатели оценивались с помощью сравнения средних величин с использованием двухвыборочного t критерия Стьюдента. Для оценки достоверности различий качественных признаков использовались непараметрические критерии – точный критерий Фишера (при значениях одного из признаков ≤5) и критерий χ2 с поправкой Йетса. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Из 112 пациентов, включенных в исследование, 12-месячное наблюдение завершили все (100%) пациенты. Для оценки клинической эффективности различных видов установленных стентов рассматривали частоту повторных вмешательств на ранее стентированном сегменте.
Через 30 дней наблюдения после коронарного стентирования повторных РЦП в обеих группах не потребовалось (табл. 2).
Через 6 мес наблюдения повторное вмешательство на целевом поражении выполнено 1 (1,85%) пациенту из 1-й группы (ЭПС) и 3 (5,2%) пациентам из контрольной группы (р=0,61) (табл. 3).
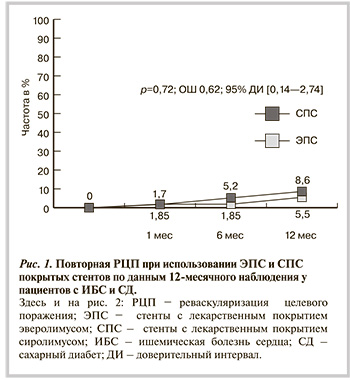
Через 12 мес наблюдения количество повторных РЦП в 1-й группе возросло (3 пациента, 5,5%), в то время как в контрольной группе их число составило 5 (8,6%) (отношение шансов — ОШ 0,62 при 95% доверительном интервале — ДИ — от 0,14 до 2,74; p=0,72) (рис.1).
Частота повторной реваскуляризации, связанной с прогрессированием атеросклероза, составила 2 (3,7%) в группе ЭПС и 1 (1,7%) в группе СПС (p=0,94).
Безопасность коронарного стентирования оценивали исходя из частоты развития острых ИМ и летальных исходов (табл. 2—4).
По частоте развития ИМ в группах отмечена следующая динамика: через 1 мес наблюдения в обеих группах зарегистрированы по одному случаю не Q-образующего ИМ; через 6 мес в обеих группах количество случаев ИМ не изменилось. Через 12 мес число пациентов с ИМ в группе ЭПС составило 2 (3,7%), в контрольной группе — увеличилось до 3 (5,2%) за счет Q-образующего ИМ (ОШ 0,71 при 95% ДИ от 0,11 до 4,4; p=0,94).
Достоверные различия по частоте развития ИМ с зубцом Q между группами также не зарегистрированы (0 против 2 (3,4%); p=0,49).
Через 1 и 6 мес наблюдения в обеих группах летальные случаи не зарегистрированы. Через 12 мес наблюдения в обеих группах отмечено по одному летальному случаю в связи с кардиальной причиной.
При оценке конечной точки проведенного исследования — частоты развития НКС (комбинация кардиальной смерти, нефатального ИМ и клинически показанной РЦП в течение 12 мес) достоверные различия между двумя группами не выявлены — 6 (11,1%) против 9 (15,5%) (ОШ 0,68 при 95% ДИ от 0,225 до 2,059; р=0,69) (рис.2).
По частоте развития ТС (подтвержденных, наиболее вероятных, возможных), по данным 12-месячного наблюдения статистически значимые различия также не выявлены — 1 (1,85%) против 2 (3,4%) (р=0,94)
Обсуждение
ИБС является главной причиной инвалидизации и смертности пациентов с СД [17]. Даже в эру стентов с лекарственным покрытием ЧКВ у больных ИБС с СД имеют худшие результаты по сравнению с таковыми у больных без СД [8, 18, 19]. Предпочтительным методом реваскуляризации у пациентов с СД, особенно с двух- и трехсосудистым поражением, является операция коронарного шунтирования — КШ (BARI, SYNTAX, CARDIa, FREEDOM) [20].
У пациентов с СД имеется склонность к диффузному и быстрому прогрессированию атеросклероза, что увеличивает вероятность потребности в реваскуляризации [21, 22]. Высокая частота повторной реваскуляризации и смертность больных ИБС с СД после ЧКВ связаны главным образом с 2 причинами: рестенозом и прогрессированием атеросклероза, что напрямую связаны с метаболической дисрегуляцией и хронической гипергликемией [23—25].
Известно, что частота рестеноза зависит от диаметра стентированного сегмента и протяженности поражения. Пациенты с СД в отличие от пациентов без СД имеют более диффузный тип поражения КА, что приводит к имплантации длинных стентов с небольшим диаметром и неблагоприятно влияет на результаты ЧКВ [25]. В проведенном исследовании частота повторных РЦП по данным 12-месячного наблюдения составила 5,5% в группе ЭПС и 8,6% в группе СПС (p=0,72). Помимо рестеноза стента пациенты с СД имеют больший риск развития самого грозного осложнения коронарного стентирования — ТС.
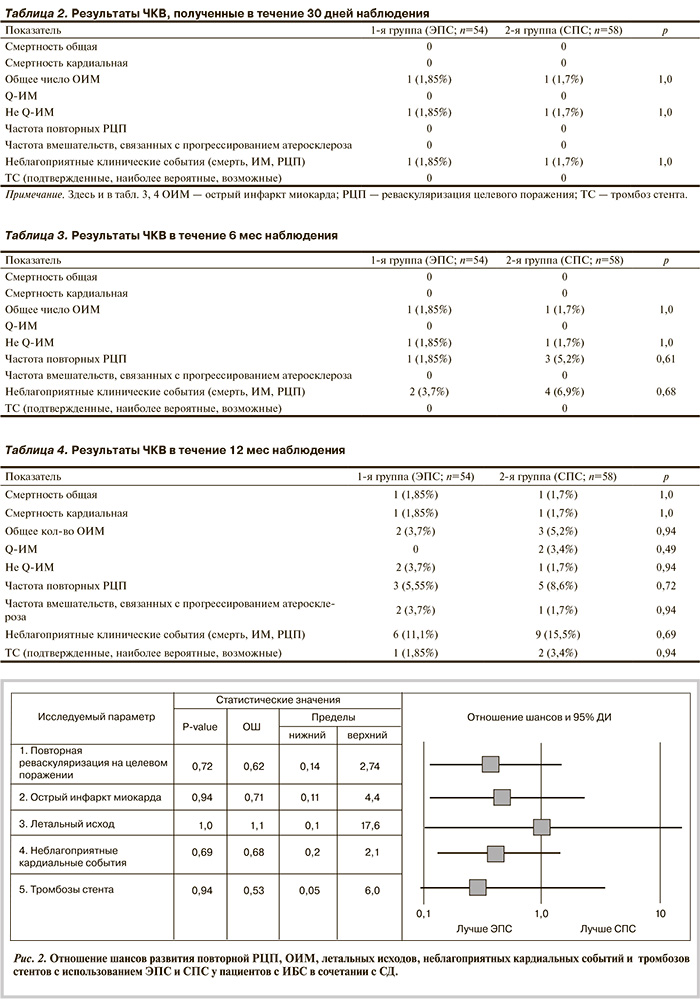
ТС остается главной проблемой после имплантации стентов с лекарственным покрытием, особенно у пациентов с СД [8, 26]. ТС приводит к развитию острого ИМ, а в ряде случаев к летальному исходу. Повышенный риск ТС, особенно в течение первых 12 мес после имплантации стента, у пациентов с СД может быть связан с протромботическим статусом, характерным для этой популяции. Известно, что СД ассоциируется с меньшим кардиопротективным эффектом ацетилсалициловой кислоты и клопидогрела [27]. ТС в 1-й группе отмечен у 1 (1,85%) пациента, в то время как в контрольной группе зарегистрировано 2 (3,4%) случая позднего ТС (р=0,94). Однако необходимо понимать, что ТС — редкое осложнение (до 1,2% по данным различных мета-анализов), и выборка в исследовании недостаточна, чтобы показать различия между группами. По комбинированному показателю эффективности и безопасности — частоте развития неблагоприятных коронарных событий — достоверных различий между группами ЭПС и СПС не выявлено — 6 (11,1%) против 9 (15,5%) (р=0,69).
Многие исследователи в настоящее время уделяют особое внимание развитию очень поздних тромбозов (после 12 мес). Одной из причин очень позднего ТС с лекарственным покрытием является более длительная их эндотелизация по сравнению с непокрытыми стентами [26]. В 2012 г. появились данные, что ЭПС подвергается эндотелизации в течение 3 мес, и это позволяет отменять двухкомпонентную антиагрегантную терапию по истечении указанного времени без риска ТС [28]. Возможно, ранней эндотелизацией объясняются результаты немногочисленных исследований, показывающих достоверно лучшие результаты в отношении ТС и ИМ в группе пациентов с ЭПС в отличие от СПС (LESSON, SORT OUT IV).
Несмотря на бурный прогресс в интервенционной кардиологии и кардиохирургии, СД остается «ахиллесовой пятой» как для эндоваскулярной, так и хирургической тактики реваскуляризации миокарда.
В настоящее время исследователи и производители коронарных стентов нацелены на создание более эффективных лекарственных покрытий, которые должны давать сильный антипролиферативный и противовоспалительный эффект, минимизировать время процесса реэндотелизации [29]. До тех пор пока не получены доказательства эффективности новейших устройств, СПС и ЭПС остаются предпочтительными для выполнения коронарной ангиопластики и стентирования у больных ИБС с СД.
В проведенном исследовании не получены данные, свидетельствующие о клиническом превосходстве ЭПС над СПС у больных ИБС с СД. Полученные результаты согласуются с данными крупных исследований и мета-анализов, подтверждающих одинаковую эффективность и безопасность СПС и ЭПС у пациентов с ИБС и СД [30].
Выводы
Годичные результаты чрескожного коронарного вмешательства с применением стентов, покрытых эверолимусом, у больных ишемической болезнью сердца в сочетании с сахарным диабетом достоверно не отличаются от результатов чрескожного коронарного вмешательства с использованием стентов, покрытых сиролимусом.
Чрескожные коронарные вмешательства с использованием стентов, покрытых эверолимусом, так же безопасны, как и использование стентов, покрытых сиролимусом, у больных ишемической болезнью сердца в сочетании с сахарным диабетом.



