Живой организм является динамичной системой, которая постоянно реагирует на различные виды нагрузок: физические, эмоциональные, пищевые. Последний вид нагрузок человек испытывает регулярно в течение всей своей жизни, а изменившиеся условия существования приводят к тому, что пищевые нагрузки постепенно превращаются в пищевые перегрузки. Постпрандиальное состояние считается прооксидантным, причем уровень оксидантного стресса зависит от насыщения пищи углеводами и концентрации глюкозы и инсулина [1]. Острая гипергликемия через оксидантный стресс может повышать содержание провоспалительных цитокинов [2, 3].
В последние годы возрос интерес к определению роли воспаления и иммунного ответа при артериальной гипертензии (АГ). Ангиотензин II, альдостерон, возросшее напряжение сдвига способствуют образованию активных форм кислорода, которые индуцируют воспалительную реакцию, повышают проницаемость эндотелия, хемотаксис гранулоцитов и макрофагов, их активацию и синтез цитокинов. Провоспалительные цитокины в свою очередь могут изменять экспрессию генов, индуцировать ремоделирование сосудов, вазоконстрикцию и повреждение почек. Рост артериального давления (АД) вызывает воспалительную реакцию с аккумуляцией активированных Т-клеток в периваскулярной жировой ткани и в почках, где они продуцируют провоспалительные цитокины, влияющие на сосуды и канальцы почек, что в дальнейшем способствует прогрессированию АГ. Клетки иммунной системы несут на своей поверхности адрено- и холинорецепторы, модулирующие синтез цитокинов при активации различных отделов вегетативной нервной системы (ВНС), — симпатическая стимуляция Т-клеток селезенки способствует синтезу провоспалительных цитокинов, а парасимпатическая уменьшает его [4—6].
Определение вариабельности ритма сердца (ВРС) позволяет неинвазивным способом на основе анализа продолжительности интервалов RR электрокардиограммы (ЭКГ) оценить состояние ВНС обследуемых. Известно, что нарушения вегетативной регуляции способствуют развитию гиперинсулинемии, характерной для больных с АГ [6, 7]. Преходящая гиперинсулинемия ведет к снижению ВРС у здоровых людей [8, 9], а транзиторная гипергликемия оказывает различное влияние на показатели ВРС у пациентов с АГ 1-й степени и обследованных без повышения АД [10]. Остается малоизученной динамика индексов ВРС при проведении перорального теста на толерантность к глюкозе (ПТТГ) у пациентов с высоким нормальным АД.

Целью исследования являются оценка реакции ВНС, выявление особенностей динамики уровня провоспалительных цитокинов и метаболизма углеводов при проведении ПТТГ у лиц с высоким нормальным АД.
Материал и методы
В исследование включены 29 человек. У 14 из них уровень АД соответствовал высокому нормальному, у 15 — оптимальному АД (табл. 1). Обследованные с высоким нормальным АД составили основную группу, с оптимальным — группу контроля. Группы не отличались по возрасту и полу. Все обследованные лица в течение месяца, предшествовавшего исследованию, не принимали антигипертензивные препараты.
 В исследование не включали больных с доказанной первичной или вторичной АГ; пациентов, перенесших инсульт, транзиторную ишемическую атаку, инфаркт миокарда, коронарную реваскуляризацию; больных с сахарным диабетом, нарушением толерантности к глюкозе, гипергликемией натощак; болезнями почек; периферических артерий; выраженной ретинопатией; пациентов с нарушениями ритма и проводимости, в том числе с частой наджелудочковой или желудочковой экстрасистолией; больных с сердечной недостаточностью выше II функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA); пациентов с воспалительными заболеваниями различной этиологии.
В исследование не включали больных с доказанной первичной или вторичной АГ; пациентов, перенесших инсульт, транзиторную ишемическую атаку, инфаркт миокарда, коронарную реваскуляризацию; больных с сахарным диабетом, нарушением толерантности к глюкозе, гипергликемией натощак; болезнями почек; периферических артерий; выраженной ретинопатией; пациентов с нарушениями ритма и проводимости, в том числе с частой наджелудочковой или желудочковой экстрасистолией; больных с сердечной недостаточностью выше II функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA); пациентов с воспалительными заболеваниями различной этиологии.
Высокое нормальное АД диагностировали на основании расчета среднего АД во время трех последовательных визитов к врачу, если уровень систолического АД находился в пределах 130—139 мм рт.ст., диастолического АД — 85—89 мм рт.ст. У обследованных контрольной группы величина АД не превышала 120/80 мм рт.ст. (оптимальное АД). Во всех случаях офисное измерение АД проводили в положении сидя, после отдыха, продолжавшегося не менее 15 мин.
В группе пациентов с высоким нормальным АД у одного пациента АГ наблюдалась у 3 его ближайших родственников, у двух пациентов — у 2, и у 7 пациентов — у 1 родственника. Среди обследованных лиц с оптимальным АД отягощенная наследственность по АГ выявлена у 3 человек. В двух случаях повышение АД отмечалось у 2 ближайших родственников и в одном — у 1. В целом наследственная предрасположенность к повышению АД была выше (p<0,01) среди пациентов с высоким нормальным АД (см. табл. 1).
Отсутствовали межгрупповые различия при оценке частоты выявления стабильной стенокардии напряжения I и II ФК, которую определяли по результатам теста с дозированной физической нагрузкой на велоэргометре Esaote P8000 Power (Италия). При наличии стенокардии напряжения антиангинальные препараты отменяли за 3 дня до проведения комплекса исследований, включавшего проведение велоэргометрии.
Содержание общего холестерина (ХС) в крови было выше (p<0,05) у пациентов с высоким нормальным АД. Средняя концентрация глюкозы в крови натощак в основной и контрольной группах не различалась.
В контрольной группе 1 человек имел ожирение II степени и 8 — избыточную массу тела. В основной группе у 3 человек было ожирение II степени, у 3 — ожирение I степени и у 7 — избыточная масса тела. В целом индекс массы тела (ИМТ) в основной группе был больше, чем в контрольной (p<0,01).
Наряду с общеклиническими исследованиями всем обследованным проводился ПТТГ. Утром натощак в сыворотке крови определяли содержание глюкозы, инсулина, С-реактивного белка (СРБ), интерлейкина-1β (ИЛ-1β), интерлейкина-6 (ИЛ-6) и α-фактора некроза опухоли (α-ФНО). Все показатели (за исключением СРБ) определяли повторно через 60 и 120 мин после перорального приема 75 г глюкозы.
Измеряли содержание глюкозы в капиллярной крови ферментативным методом, а остальных показателей — в венозной крови с помощью иммуноферментного анализа (на аппарате Stat Fax 2100, США). Для определения СРБ и инсулина применяли диагностические тест-системы DRG Diagnostics (США). ИЛ-1β, ИЛ-6 и α-ФНО измеряли с использованием тест-систем Vector-Best (Россия).
ИР рассчитывали по критерию HOMA-IR.
НОМА-IR = концентрация инсулина (мкед/мл) натощак · концентрация глюкозы (ммоль/л) натощак / 22,5.
ИМТ рассчитывали по формуле: ИМТ = масса тела (кг) / рост2 (м).

Исходную ВРС определяли в период с 8 до 9 ч утра натощак. Повторный анализ ВРС выполняли через 1 и 2 ч после приема 75 г глюкозы. Обследование проводили после 15 мин отдыха в горизонтальном положении. Запись ЭКГ осуществляли в течение 5 мин на аппарате Кардиолаб-2000 (Харьков) с последующим анализом частотных показателей ВРС: высокочастотного компонента — HF (0,04—0,15 Гц), низкочастотного компонента — LF (0,15—0,4 Гц), их соотношения — L/H и общей мощности спектра — TP. Анализ области очень низких частот не проводили, так как на коротких временных промежутках он малоинформативен [11]. Кроме того, определяли среднюю частоту сердечных сокращений (ЧСС) на момент регистрации ЭКГ.
Статистический анализ проводили с помощью пакета программ Statistica 7. Сравнение независимых и зависимых выборок осуществляли с использованием t-критерия Стьюдента при нормальном распределении данных и непараметрических критериев Манна—Уитни и Вилкоксона при распределении, отличном от нормального. Проверку гипотезы соответствия данных нормальному закону распределения осуществляли с помощью критерия χ2 по методу Пирсона. Коэффициент корреляции рассчитывали по методу Спирмена. Данные представлены в виде среднего арифметическое (М) ± стандартная ошибка среднего (m). Различия считали достоверными при p<0,05.
Результаты и обсуждение
Исходная ЧСС составила 66,9±2,0 уд/мин у обследованных с оптимальным и 71,8±4,8 уд/мин у лиц с высоким нормальным АД (рис. 1). Через 60 мин соответствующие показатели составили 70,1±2,1 и 72,4±3,4 уд/мин (p>0,05); через 120 мин — 75,3±4,4 и 79,0±3,1 уд/мин (p>0,05). У обследованных с оптимальным АД повышение ЧСС по сравнению с исходным зарегистрировано уже через 1 ч после начала теста (p<0,05). Через 2 ч достоверный рост ЧСС отмечался в обеих группах (p<0,05 — в основной и p<0,01 — в контрольной).
В данном исследовании, как и в предыдущих работах [12, 13], частотный анализ ВРС выявил исходное снижение общей мощности спектра у обследованных с повышенным АД (p<0,05). Через 60 мин после приема 75 г глюкозы отмечалось появление достоверных различий всех основных показателей спектрального анализа (табл. 2), наиболее выраженных для низкочастотного компонента (p<0,01). Они были обусловлены повышением LF по сравнению с исходной (p<0,05) и тенденцией к увеличению HF в группе обследованных с оптимальным АД. Через 120 мин межгрупповые различия нивелировались за счет существенного снижения HF (p<0,01), LF (p<0,01) и TP (p<0,05) у обследованных контрольной группы. У пациентов с высоким нормальным АД при проведении ПТТГ не обнаружено изменений LF, HF и TP. Постпрандиальный рост L/H (p<0,05) и увеличение ЧСС выявлены в обеих группах (p<0,05 — в основной и p<0,01 — в контрольной), но у обследованных с оптимальным АД они возникали раньше.
Одновременно с изменениями ВРС наблюдались изменения уровня провоспалительных цитокинов, различные для обследованных с высоким нормальным и оптимальным АД. Содержание ИЛ-1β натощак в основной группе составило 0,38±0,15 пг/мл, в контрольной — 0,38±0,09 пг/мл (p>0,05). Через 60 мин после приема 75 г глюкозы показатели достигли достоверных различий — 0,25±0,11 и 0,75±0,16 пг/мл (p<0,05). Через 120 мин различия нивелировались — 0,36±0,11 и 0,58±0,15 пг/мл (p>0,05). При этом уровень ИЛ-1β достоверно увеличился по сравнению с исходным через 60 мин после начала ПТТГ в контрольной группе (p<0,05) и не изменился в основной (см. рис. 1).
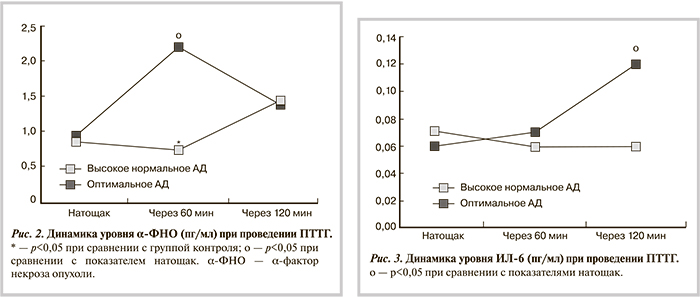
Уровень α-ФНО натощак составил 0,85±0,35 пг/мл у обследованных с высоким нормальным АД (рис. 2) и 0,94±0,25 пг/мл у обследованных с оптимальным АД (p>0,05). Через 60 мин после приема глюкозы у пациентов основной группы его концентрация практически не изменилась — 0,73±0,33 пг/мл, у обследованных контрольной группы увеличилась до 2,22±0,69 пг/мл, превышая как показатели основной группы, так и уровень α-ФНО натощак (p<0,05). Через 120 мин показатели составили 1,45±0,54 и 1,39±0,49 пг/мл соответственно (p>0,05). У обследованных с оптимальным АД отмечалась отрицательная корреляция концентрации α-ФНО через 1 ч после приема глюкозы с содержанием инсулина в это время (r=–0,61) и индексом ИР HOMA (r =–0,65).
Уровень ИЛ-6 (рис. 3) натощак у обследованных с высоким нормальным АД составил 0,07±0,02 пг/мл, с оптимальным АД — 0,06±0,01 пг/мл (p>0,05). Через 1 ч концентрация ИЛ-6 составила 0,06±0,01 пг/мл в основной и 0,07±0,01 пг/мл — в контрольной группе (p>0,05), через 2 ч — 0,06±0,01 и 0,12±0,03 пг/мл соответственно (p>0,05). В основной группе не выявлено колебаний содержания ИЛ-6 в ответ на глюкозную нагрузку. В контрольной группе концентрация ИЛ-6 возросла через 120 мин после приема 75 г глюкозы (p<0,05).
Как систолическое, так и диастолическое АД у обследованных контрольной группы через 120 мин после начала ПТТГ положительно коррелировало с концентрацией ИЛ-6 в крови (r=0,59 и r=0,57 соответственно), что согласуется с результатами, полученными другими исследователями [14].
Уровень СРБ утром натощак был выше (p<0,05) при наличии прегипертензии, чем в ее отсутствие. Он составил 7,8±0,6 мг/л в основной и 5,3±0,9 мг/л в контрольной группе (норма <8,2 мг/л). Повторных определений СРБ через 1 и 2 ч после приема глюкозы не проводили, так как для существенных изменений его экспрессии требуется более продолжительное время.
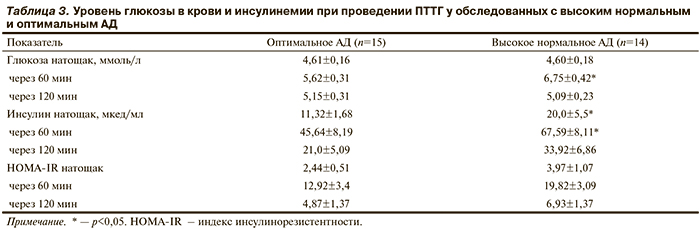
Показатели гликемии, инсулинемии и индекс ИР (HOMA-IR) до и после нагрузки глюкозой у обследованных с оптимальным и высоким нормальным АД представлены в табл. 3. Уровень глюкозы в крови натощак и через 120 мин после стандартной нагрузки глюкозой не различался у обследованных с высоким нормальным и оптимальным АД. Через 60 мин содержание глюкозы в периферической крови у пациентов с высоким нормальным АД было выше, чем у обследованных с оптимальным АД (p<0,05).
Концентрация инсулина натощак и через 60 мин после приема 75 г глюкозы была выше в основной группе, чем в контрольной (p<0,05), тогда как через 120 мин межгрупповые различия исчезали. Индекс HOMA не отличался у обследованных обеих групп как до, так и после нагрузки глюкозой. ИР (HOMA-IR >2,86) выявлена у 5 (36%) пациентов с высоким нормальным АД и у 1 (7%) обследованного с оптимальным АД (p<0,01). У всех обследованных отмечалась положительная корреляция индекса ИР HOMA и ИМТ (r=0,7 в основной и r=0,78 в контрольной группе).
Среди причин более выраженной инсулинемии и гликемии у пациентов с высоким нормальным АД по сравнению с группой контроля можно выделить наличие ожирения или избыточной массы тела, постпрандиальное уменьшение синтеза провоспалительных цитокинов и нарушение вегетативной регуляции их синтеза.
Ранее показано, что для больных с АГ 1-й степени как натощак, так и постпрандиально характерны более низкие значения частотных показателей ВРС по сравнению с нормотензивными пациентами [10]. У обследованных с высоким нормальным АД снижение ВРС наблюдается преимущественно постпрандиально. При этом реакция ВНС на прием углеводов более выражена у обследованных с оптимальным (нормальным) АД, чем при его повышении. Отсутствие динамики показателей ВСР в ответ на нагрузку глюкозой у пациентов с высоким нормальным АД сочетается с отсутствием существенного изменения уровня провоспалительных цитокинов — ИЛ-1β, ИЛ-6, α-ФНО.
Известно, что ИЛ-1β повышает захват глюкозы периферическими тканями, стимулируя экспрессию мембранных транспортеров глюкозы (GLUT3 и GLUT1), снижает распад и повышает синтез гликогена. ИЛ-1 и α-ФНО увеличивают захват и фосфорилирование глюкозы астроцитами, существенно меняя их метаболизм и способность доставлять энергию нейронам [15—18]. Нагрузка глюкозой ведет к росту концентрации α-ФНО у здоровых добровольцев [3, 19]. Преходящее повышение содержания ИЛ-1β и α-ФНО у обследованных с оптимальным АД сочетается с более низким уровнем гликемии, чем их монотонная секреция у пациентов с высоким нормальным АД. Вероятно, повышение уровня этих цитокинов на фоне пульсативной гипергликемии способствует лучшему усвоению глюкозы центральной нервной системой и периферическими тканями.
ИЛ-6 в печени и жировой ткани стимулирует развитие ИР, в мышцах — повышает чувствительность к инсулину и усвоение глюкозы [1, 20, 21]. Постпрандиальное увеличение уровня цитокина у обследованных контрольной группы можно рассматривать как физиологическое, ведущее к улучшению метаболизма глюкозы в мышечной ткани. В группе пациентов с высоким нормальным АД отсутствие существенных изменений уровня ИЛ-6 при проведении ПТТГ, вероятно, сопровождается ухудшением усвоения глюкозы мышечной тканью и улучшением — жировой, что может способствовать росту ИМТ.
Полученные результаты подтверждают наличие многочисленных взаимосвязанных изменений в организме, которые возникают уже на стадии высокого нормального АД. Повышения напряжения сдвига, уровня ангиотензина II и альдостерона, характерные для роста АД, способствуют появлению системного воспаления, что подтверждается увеличением концентрации СРБ в крови. Нарушение вегетативного контроля, проявляющегося снижением ВРС натощак и (в большей степени) постпрандиально, сопровождается нарушением синтеза провоспалительных цитокинов, что может способствовать изменению усвоения глюкозы различными тканями и возникновению ожирения, которое в свою очередь оказывает существенное влияние на развитие АГ.
Заключение
Для пациентов с высоким нормальным артериальным давлением характерно снижение общей мощности спектра ТР и отсутствие динамики показателей вариабельности ритма сердца в ответ на нагрузку глюкозой. У обследованных с оптимальным артериальным давлением отмечается существенный прирост LF и L/H через 60 мин после приема глюкозы. Постпрандиальный рост L/H и увеличение частоты сердечных сокращений наблюдаются в обеих группах, но у обследованных с оптимальным артериальным давлением они возникают раньше. Изменения активности вегетативной нервной системы в группе лиц с оптимальным артериальным давлением сопровождаются преходящим повышением концентрации провоспалительных цитокинов — интерлейкина-1β и α-фактора некроза опухоли через 60 мин и интерлейкина-6 через 120 мин после начала перорального теста на толерантность к глюкозе, которые превышают соответствующие показатели группы с высоким нормальным артериальным давлением. У пациентов с высоким нормальным артериальным давлением по сравнению с лицами с оптимальным артериальным давлением имеются более высокие концентрации в крови С-реактивного белка. Содержание инсулина (натощак и постпрандиально) и глюкозы в крови через 60 мин после начала проведения перорального теста на толерантность к глюкозе у пациентов с высоким нормальным давлением выше, чем у лиц с оптимальным артериальным давлением.



