Липопротеид(а) — Лп(а) представляет собой сложный надмолекулярный комплекс, в котором молекула апоВ100 частицы, подобной липопротеиду низкой плотности (ЛНП), соединена дисульфидной связью с полиморфной молекулой апобелка(а), имеющего высокую гомологию первичной структуры с проферментом фибринолитической системы плазминогеном. Согласно многочисленным исследованиям Лп(а) признан независимым причинным фактором риска раннего развития атеросклероза и его осложнений, особенно у мужчин молодого и среднего возраста [1, 2]. Несмотря на длительный период изучения, ни физиологическая роль, ни механизм атерогенности до конца неясны, однако морфологические исследования показывают наличие Лп(а) в нестабильных атеросклеротических бляшках [3, 4]. Роль хронического воспаления и локальных иммунных реакций в развитии и прогрессировании атеросклероза активно изучается [5—7]. Сумма имеющихся данных свидетельствует о том, что гуморальный иммунный ответ на модифицированные липопротеиды является патогенным, а образование аутоантител (аутоАТ), принадлежащих к классу IgG, приводит к появлению соответствующих иммунных комплексов с выраженными провоспалительными свойствами. Так как в большинстве исследований демонстрировались провоспалительные и проатерогенные свойства иммунных комплексов с окисленными ЛНП (окЛНП), можно предположить, что аутоАТ и иммунные комплексы, специфичные к апоВ-содержащим липопротеидам, имеющим различные модификации (в том числе окисленные фосфолипиды или комплекс с 2GP1), могут быть в равной степени патогенными [8].
Иммунные комплексы, содержащие в своем составе Лп(а), найдены у детей, при этом их уровень коррелировал с концентрацией Лп(а), полом, уровнем холестерина (ХС) ЛНП и был достоверно выше, чем у новорожденных [9]. Взаимодействие таких комплексов с рецепторами на тромбоцитах и нейтрофилах может инициировать раннее развитие атеросклеротических поражений. Имеются данные, что Лп(а) представляет собой основной переносчик окисленных фосфолипидов в клетки и ткани [10—13]. При гидролизе таких окисленных фосфолипидов специфическими ферментами, в частности фосфолипазой А2, образуются сильнодействующие медиаторы воспаления, такие как лизофосфатидилхолин и окисленные свободные жирные кислоты, которые играют важную роль в развитии атеросклероза и его осложнений. Следует отметить, что ранее проатерогенные эффекты, обусловленные продуктами гидролиза окисленных фосфолипидов, ассоциировались исключительно с окислением ЛНП. Среди опубликованных в мировой литературе работ, посвященных исследованию аутоАТ и циркулирующих иммунных комплексов к модифицированным ЛНП, практически отсутствуют данные о Лп(а) как о возможном активаторе иммунного ответа. Наличие в составе Лп(а) частицы, подобной ЛНП, физико-химические особенности этого липопротеида и отсутствие понимания механизмов высокой атеро- и тромбогенности Лп(а) делают актуальными исследования связи Лп(а) с иммуноэффекторными механизмами атеросклероза.
Целью настоящей работы было выявление в плазме крови человека циркулирующих аутоАТ к Лп(а), относящихся к различным классам иммуноглобулинов, и изучение их связи с наличием и тяжестью поражения коронарных артерий у больных ишемической болезнью сердца среднего возраста.
Материалы и методы
В исследование были включены 97 мужчин в возрасте от 33 до 82 лет, которым проведена количественная коронарография. Из исследования исключали больных с острым инфарктом миокарда (ИМ) или нестабильной стенокардией; перенесших хирургические вмешательства менее чем за 1 мес до исследования; с выраженной дисфункцией печени, почек и щитовидной железы; с хронической сердечной недостаточностью III—IV функционального класса согласно классификации NYHA. Кроме того, исключали больных, которые в момент исследования принимали гормональные препараты, некоторые липотропные средства (никотиновая кислота, фибраты, омега-3 ненасыщенные жирные кислоты), и больных, у которых применяли экстракорпоральные методы лечения ввиду их возможного влияния на уровень Лп(а). Коронарный атеросклероз (КА) верифицировали при наличии стеноза >50% по диаметру в одной или более из магистральных артерий. Тяжесть поражения выражали в количестве сосудов, имеющих гемодинамически значимые (>50%) стенозы.
Концентрацию Лп(а) определяли методом твердофазного иммуноферментного анализа (ИФА) с использованием моноспецифических поликлональных антител барана против Лп(а) человека, как описано ранее [14]. Концентрацию общего холестерина (ОХС), ХС ЛНП, ХС липопротеидов высокой плотности (ЛВП), триглицеридов (ТГ) АпоВ100 определяли ферментативным и иммунотурбидиметрическим методами с использованием коммерческих наборов «Biocon» и «Boehringer Mannheim», «Витал Диагностик». Концентрацию иммуноглобулинов G и M определяли методом ИФА при помощи коммерческих наборов «Вектор Бест». Уровень окЛНП измеряли набором «Cayman».
Уровень специфических аутоАТ к Лп(а) оценивали методом твердофазного ИФА согласно методике, использованной для определения аутоАТ к β1-адренорецептору [15], модифицированной для выявления аутоАТ к липопротеидам. Для проведения анализа на плашке иммобилизованы высокоочищенные препараты Лп(а) или ЛНП из расчета 1 мкг белка апоВ100/лунка. Исследуемые образцы разводили в фосфатном буфере, содержащем 0,1% альбумина и 0,05% Твина-20 в соотношении 1:20 в 2 параллелях. В качестве проявляющих антител использовали иммуноглобулины козы к иммуноглобулинам G или М человека (специфичные к γ-цепи и µ-цепи соответственно), конъюгированные с пероксидазой хрена. Регистрацию реакции проводили с использованием ортофенилендимина, измеряя поглощение при длине волны 492 нм на оптическом анализаторе Anthos 2010 Standart. Выделение ЛНП и Лп(а) плазмы крови человека, использованных в качестве первого слоя, проводили по модифицированной методике, основанной на дифференциальном ультрацентрифугировании в ступенчатом градиенте плотности нейтральной соли NaBr с использованием ультрацентрифуги Optima L 90 [16].
Статистическую обработку данных осуществляли с помощью пакета прикладных статистических программ Med Calc 12.5.0. При сравнении показателей между группами использовали критерий t Стьюдента или Вилкоксона с поправкой Манна—Уитни. Для сравнения частоты данных в группах применяли критерий Пирсона и точный критерий Фишера. Корреляционный анализ по Спирмену и Пирсону, а также множественный регрессионный анализ использовали при изучении связи между исследуемыми параметрами. Метод анализа кривых операционных характеристик (ROC-анализ) использовали для определения порогового уровня концентрации Лп(а) и титра аутоАТ к Лп(а) как диагностических показателей наличия атеросклеротических поражений коронарных артерий в группе обследованных пациентов. Для сравнения влияния Лп(а) и аутоАТ к Лп(а) как факторов риска развития КА рассчитывали отношение шансов (ОШ) и 95% доверительный интервал (ДИ).
Результаты и обсуждение
Количественная коронарография проведена 97 мужчинам в возрасте от 33 до 82 лет, средний возраст 58±10 лет. Из них 17 пациентов имели непораженные сосуды, КА был верифицирован у 80 больных, по наличию стеноза более 50% по диаметру в одной или более магистральных артериях: 20, 25 и 35 больных имели одно-, двух- и трехсосудистое поражение коронарных артерий соответственно. Больные из группы с КА были несколько старше, чем пациенты с непораженными сосудами (58,4±9,5 и 53,2±8,1 года соответственно), тогда как по показателям липидного состава крови достоверных различий не выявлено (табл. 1).
Отсутствие различий в показателях липидного состава крови у больных со значимыми поражениями коронарного русла и больных без поражений, по-видимому, объяснялось приемом липидснижающих препаратов пациентами с умеренным или высоким риском развития сердечно-сосудистых осложнений по шкале SCORE.
Уровень Лп(а) в группе больных с КА был достоверно выше (медиана 19,0 мг/дл при 95% ДИ от 12,5 до 27,4 мг/дл), чем в контрольной группе (10,3 мг/дл при 95% ДИ от 4,1 до 19,1 мг/дл; p=0,05). Связь повышенного уровня Лп(а) с наличием поражений коронарных артерий показана во многих исследованиях, проведенных как в России, так и в многоцентровых международных исследованиях [2].
Участие гуморального и клеточного иммунного ответа при атеросклерозе активно изучается на протяжении последних десятилетий. При этом, согласно недавним исследованиям, аутоАТ, принадлежащие к IgM против окЛНП, вырабатываемые клетками B1, оказывают кардиопротективное действие, в то время как IgG к окЛНП, вырабатываемые клетками B2, являются проатерогенными [7, 17]. Исходя из этого, мы изучали уровень аутоАТ к Лп(а) и ЛНП, относящихся к иммуноглобулинам обоих классов — IgG и IgM. Выявлено, что содержание аутоАТ к Лп(а), относящихся к IgG, в плазме крови было повышенным у больных с верифицированным КА, относительно больных с непораженными коронарными артериями (264±188 и 187±59 усл. ед. соответственно; p=0,003).
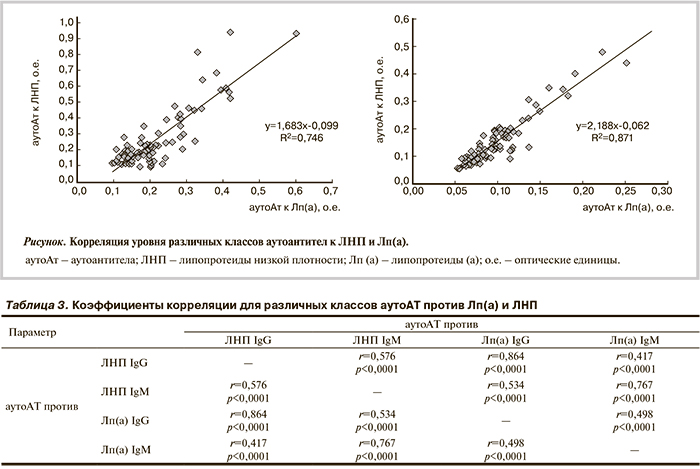
Корреляционный анализ показал достоверную связь между концентрацией Лп(а) и наличием у пациентов значимых поражений хотя бы в одной коронарной артерии (r=0,21; p=0,04), а уровень аутоАТ к Лп(а), принадлежащих к IgG и IgM, коррелировал с количеством пораженных магистральных коронарных артерий (r=0,27; p=0,008 и r=0,28; p=0,005 соответственно; табл. 2). Средний титр аутоАТ к Лп(а), принадлежащих к IgG, возрастал в подгруппах больных с увеличением количества пораженных коронарных артерий и составил 180±10, 210±110 и 240±100 усл. ед. соответственно (p<0,05 для групп с одно- и трехсосудистым поражениями).
С использованием анализа ROC-кривых мы рассчитали пороговое значение уровня аутоАТ к Лп(а), принадлежащих к IgG (186 усл. ед.), и концентрации Лп(а) (20 мг/дл) с максимальной чувствительностью и специфичностью, связанными с наличием стеноза более 50% по диаметру хотя бы в одной магистральной коронарной артерии. ОШ поражения коронарных артерий у больных, имеющих уровень Лп(а) более 20 мг/дл, относительно больных с концентрацией Лп(а) менее 20 мг/дл составило 4,2 (при 95% ДИ от 1,1 до 15,8; p<0,05). При этом ОШ КА у больных, имеющих такое сочетание, как повышенные концентрации Лп(а) и аутоАТ к Лп(а) класса G, возрастало в 2 раза и составило 9,9 (при 95% ДИ от 1,2 до 85,2; p<0,05).
По данным многофакторного регрессионного анализа с включением в модель возраста, параметров липидного состава крови и аутоАТ к Лп(а) класса G, в группе обследованных пациентов только возраст и уровень аутоАТ к Лп(а) класса G были достоверно связаны с тяжестью КА (r=0,30; p=0,001 и r=0,29; р=0,01 соответственно).
Таким образом, показано, что уровень аутоАТ к Лп(а) связан с наличием и тяжестью поражения магистральных коронарных артерий у обследованных больных.
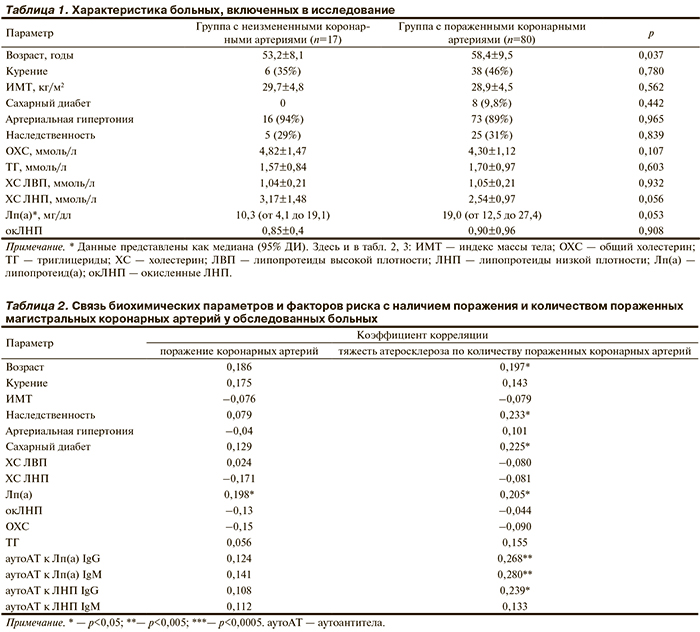
Корреляционный анализ не показал связи между уровнем аутоАТ против Лп(а) и ЛНП, принадлежащих к классам G и M, с такими показателями липидного обмена, как концентрация ОХС, ХС ЛНП, ТГ. При этом обнаружено, что уровень аутоАТ IgG как к Лп(а), так и к ЛНП, связан с исходной концентрацией Лп(а) (r=0,247; р=0,016 и r=0,267; р=0,009 соответственно), тогда как уровень аутоАТ IgM, как к Лп(а), так и к ЛНП, положительно коррелировал с уровнем ХС ЛВП (r=0,278; p=0,018 и r=0,285; p=0,015 соответственно). Следует отметить, что коэффициент корреляции между титрами аутоАТ одной специфичности (например, к Лп(а) или ЛНП), но принадлежащих к различным классам, был в 1,5 раза ниже, чем у аутоАТ разной специфичности, но одного класса (табл. 3 и рисунок).
Следует отметить, что уровень аутоАТ к Лп(а) как IgG, так и IgM, был в 1,5—2 раза ниже, чем уровень аутоАТ к ЛНП. С учетом одинаковой концентрации иммобилизованного на плашке апоВ100 этот факт может свидетельствовать о возможных стерических затруднениях в связывании аутоАТ с апоВ100, входящим в состав Лп(а). Различия по иммунохимическим свойствам апоВ100, входящих в состав Лп(а), показано ранее в ряде биохимических работ [18, 19] и объясняется пространственной структурой Лп(а). Согласно рентгеноструктурному анализу гидрофильная молекула апо(а) находится на поверхности ЛНП-подобной частицы и частично экранирует антигенные детерминанты апоВ100, влияя на способность связываться с рецептором В/Е [20], а также на скорость окисления данного липопротеида [21].
Обращает внимание отсутствие связи между уровнем аутоАТ к ЛНП, принадлежащих к IgM, и степенью тяжести КА, тогда как аутоАТ к Лп(а) вне зависимости от их изотипа были связаны с количеством пораженных коронарных артерий. Несколько работ, посвященных связи аутоАТ к модифицированным ЛНП, свидетельствуют об увеличении титра аутоАТ IgG и одновременном уменьшении IgМ к модифицированным ЛНП у больных со стабильной формой ишемической болезни сердца относительно пациентов с интактными коронарными артериями [22].
Обнаруженная в нашем исследовании корреляция уровня ХС ЛВП с аутоАТ к Лп(а) и ЛНП класса M обусловливает необходимость дальнейшего исследования и может представлять большой интерес. По данным ряда работ, проведенных с использованием животных моделей, аутоАТ к модифицированным липопротеидам, принадлежащих к IgM, способны предотвращать развитие атеросклероза, взаимодействуя с популяцией B-лимфоцитов [23]. В других исследованиях показана взаимосвязь ЛВП и апоАI с регуляцией ответов клеток различных типов, вовлеченных в процесс атерогенеза, включая Т- и В-лимфоциты [24].
Наличие показанной в нашем исследовании положительной связи концентрации Лп(а) с содержанием аутоАТ и к Лп(а), и к ЛНП в отсутствие таковой связи с концентрацией ХС ЛНП позволяет предположить наличие независимых от ЛНП механизмов иммунного ответа на Лп(а). В то же время продемонстрированная связь Лп(а) и аутоАТ к Лп(а) с наличием и степенью тяжести коронарного атеросклероза может свидетельствовать об участии Лп(а) в атерогенезе на уровне гуморального и клеточного иммунитета.



