Современные Рекомендации по лечению фибрилляции предсердий предполагают использование лекарственных антиаритмических препаратов (ААП) для предупреждения рецидивов аритмии, в частности при ее персистирующей форме после успешно проведенной кардиоверсии [1]. Российские национальные рекомендации [2] к числу рекомендуемых для этих целей ААП относят аллапинин (лаппаконитина гидробромид). Данная рекомендация, однако, основана исключительно на согласованном мнении экспертов и не подтверждена результатами ни одного из опубликованных исследований. В то же время в рамках клинических испытаний препарата такое изучение проводилось, и представление его результатов служит предметом настоящей работы.
Целью исследования явилась оценка эффективности и безопасности аллапинина в сравнении с одним из наиболее изученных ААП — хинидином, в предупреждении рецидивов персистирующей мерцательной аритмии — МА (фибрилляции и трепетания предсердий) после успешного восстановления синусового ритма.
Материал и методы
В исследование включали мужчин в возрасте от 16 до 60 лет с персистирующей формой МА. Под персистированием МА понимали неспособность к спонтанному восстановлению синусового ритма на протяжении не менее 7 сут [2]. Для включения пациентов в исследование требовалось как минимум двукратное электрокардиографическое подтверждение МА. О длительности существования МА судили по дате ее первой регистрации на электрокардиограмме (ЭКГ), а о длительности текущего эпизода аритмии — по дате первой ЭКГ с МА, после которой не регистрировали синусовый ритм вплоть до момента включения в исследование.
Критериями исключения пациентов из исследование служили длительность текущего эпизода МА более 3 лет; ишемическая болезнь сердца (ИБС) со стенокардией II функционального класса и выше или перенесенным инфарктом миокарда; наличие клинических симптомов сердечной недостаточности III функционального класса и выше по классификации NYHA; наличие органической патологии сердца с фракцией выброса левого желудочка (ЛЖ) менее 40% или гипертрофией ЛЖ с толщиной стенок более 1,4 см; тиреотоксикоз; некомпенсированные электролитные нарушения; пороки сердца, требующие хирургической коррекции; удлинение интервала QT (QT >450 мс), нарушения внутрижелудочковой проводимости (длительность комплекса QRS >110 мс). В исследование не включали также пациентов с увеличением левого предсердия более 5,0 см и пациентов с перенесенными тромбоэмболическими состояниями.
Исследование планировали как открытое рандомизированное сравнение двух препаратов в параллельных группах. Все пациенты подлежали обследованию и начальному лечению в условиях стационара. После включения пациентов в исследование методом простой рандомизации [3] проводили распределение их по группам, соответствующим назначаемому ААП. Пациентам 1-й группы назначали аллапинин (производства Института химии растительных веществ АН Узбекистана), во 2-й группе использовали хинидина бисульфат (кинилентин, «Laers», Финляндия). Лечение начинали на фоне существующей МА. Дозу аллапинина определяли из расчета 1,5 мг/кг/сут, что составило дозу 125 (100—200) мг/сут (медиана; минимальное и максимальное значение), распределенную на 3—5 приемов. Дозу кинилентина определяли из расчета 12,5 мг/кг/сут, что составило 1000 (750—2000) мг/сут, распределенные на 3—4 приема. Если через 5—7 сут от начала лечения не происходило восстановления синусового ритма (медикаментозная кардиоверсия), на фоне продолжающейся антиаритмической терапии (ААТ) выполняли электрическую кардиоверсию. При ее неэффективности состояние рассматривали как перманентную МА [1], и пациентов исключали из исследования, применяя к ним для дальнейшего лечения стратегию контроля частоты ритма. При успешной кардиоверсии (медикаментозной или электрической) лечение изучаемыми препаратами продолжали в прежних дозах, и дальнейшее наблюдение проводили в амбулаторных условиях.
Наблюдение продолжали до 1 года. Пациенты подлежали обязательным контрольным обследованиям через 1, 3, 6 и 12 мес. Внеочередные визиты происходили в случаях развития событий, соответствующих конечным исходам исследования. На каждом визите кроме опроса и осмотра пациентов производили регистрацию ЭКГ, а также исследование лабораторных показателей для контроля возможного токсического действия препаратов.
 Первичным исходом исследования служила комбинация событий, отражающих одну из следующих причин прекращения лечения пациента изучаемым препаратом: факт и время развития рецидива персистирующей формы МА; побочные действия препарата; смерть пациента или развитие сердечно-сосудистых осложнений, вынуждающих к прекращению приема изучаемых препаратов. Вторичным исходом исследования служили только факт и время развития рецидива персистирующей формы МА, при этом все выбывшие по другим причинам пациенты считались не участвующими в исследовании. По достижении конечного исхода наблюдение за пациентами в рамках исследования прекращали. Из-за невозможности выявления и (или) электрокардиографического подтверждения транзиторные бессимптомные и симптоматичные эпизоды аритмии не рассматривались в качестве исходов исследования.
Первичным исходом исследования служила комбинация событий, отражающих одну из следующих причин прекращения лечения пациента изучаемым препаратом: факт и время развития рецидива персистирующей формы МА; побочные действия препарата; смерть пациента или развитие сердечно-сосудистых осложнений, вынуждающих к прекращению приема изучаемых препаратов. Вторичным исходом исследования служили только факт и время развития рецидива персистирующей формы МА, при этом все выбывшие по другим причинам пациенты считались не участвующими в исследовании. По достижении конечного исхода наблюдение за пациентами в рамках исследования прекращали. Из-за невозможности выявления и (или) электрокардиографического подтверждения транзиторные бессимптомные и симптоматичные эпизоды аритмии не рассматривались в качестве исходов исследования.
Для подтверждения установления персистирующей МА пациенты подлежали дополнительному обследованию с использованием холтеровского 24-часового наблюдения и (или) повторной регистрации ЭКГ с недельным интервалом. По прекращении исследования в отношении дальнейшего лечения пациентов решали вопрос о повторной кардиоверсии или переходе к стратегии контроля частоты ритма сердца.
При планировании исследования для определения необходимого числа наблюдений исходили из нулевой гипотезы об отсутствии в двух группах различий по частоте конечных исходов исследования к 12 мес наблюдения. При различии указанной частоты между группами, равном 30%, α=0,05, планируемой мощности исследования 80% и при одностороннем критерии необходимое число наблюдений в каждой группе составляет 33. При предполагаемом выбывании из исследования 15% пациентов считали достаточным включение 38 пациентов в каждой группе.
При статистической обработке параметрические данные подвергали тесту Колмогорова—Смирнова на нормальность распределения. Сравнение данных двух групп проводили с использованием t-теста для независимых выборок при нормальном распределении и теста Манна—Уитни для независимых выборок при ненормальном распределении. Сравнение непараметрических данных проводили с использованием теста χ2. Для сравнительной оценки показателей эффективности и безопасности лечения в двух группах определяли относительный риск (ОР) как отношение пропорций конечных исходов в двух группах с одновременной оценкой числа больных, которых необходимо лечить, чтобы предотвратить неблагоприятный исход у одного больного (ЧБНЛ). Оценку влияния различных факторов на эффективность лечения проводили только у пациентов с вторичными исходами исследования. Влияние параметрических факторов оценивали методом ROC-анализа. Показатели значимых факторов затем трансформировали в непараметрические с использованием полученной в ROC-анализе линией оптимального отсечения. Влияние непараметрических факторов оценивали с помощью метода χ2, и при p≤0,05 определяли отношение шансов (ОШ) как отношение вероятности развития события под влиянием изучаемого фактора к вероятности в его отсутствие. Для многофакторного анализа использовали метод логистической регрессии, включая в него факторы, статистически значимые по результатам однофакторного анализа. Расчеты производили с помощью компьютерной программы Med-Calc v 12.7.0. Статистически значимыми считали результаты при p<0,05.
Результаты
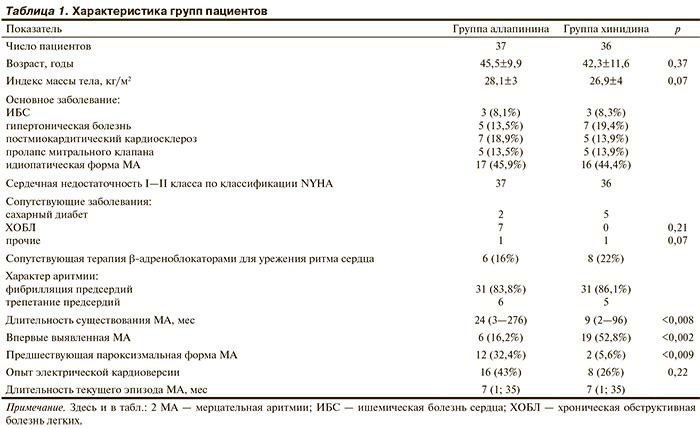
В исследование изначально включены 76 пациентов, рандомизированных поровну в каждую из групп. У 3 пациентов (1 в группе аллапинина и 2 в группе хинидина) по результатам электрической кардиоверсии установлена перманентная форма МА, и они исключены из исследования. Таким образом, группу аллапинина составили 37, а группу хинидина — 36 пациентов. Их характеристики по демографическим данным, характеру основного и сопутствующих заболеваний и имеющейся аритмии представлены в табл. 1. При полной сопоставимости большинства параметров в двух группах выявляется статистически значимое преобладание в группе аллапинина пациентов с более длительным анамнезом МА при неразличающейся длительности текущего эпизода аритмии, и по числу пациентов с предшествующей пароксизмальной МА. Напротив, в группе хинидина статистически значимо преобладали пациенты с впервые выявленной МА, что отражалось меньшим числом предшествующих электрических кардиоверсий, но последний результат не был статистически значимым. По исходным гемодинамическим и эхокардиографическим показателям, оцененным перед назначением изучаемых препаратов на фоне МА, группы оказались абсолютно равноценными (табл. 2).
После начала лечения изучаемыми препаратами в сроки от 3 до 5 сут у 9 пациентов (5 в группе аллапинина и 4 в группе хинидина) отмечено восстановление синусового ритма. Остальным произведена электрическая кардиоверсия. Не было ни одного случая немедленного рецидива МА. Ранние рецидивы (до 5 сут) произошли у 4 пациентов по 2 в каждой группе. В эти же сроки у 3 пациентов хинидин был отменен из-за развития побочных действий: 2 случая желудочно-кишечных расстройств и 1 — аллергической реакции. Поздние рецидивы МА происходили в разные сроки у 13 пациентов группы аллапинина и у 18 пациентов группы хинидина. Кроме того, у 2 пациентов хинидин был отменен из-за побочных эффектов: 1 случай желудочно-кишечных расстройств и 1 случай симптоматичной синоатриальной блокады. Подробно динамика сохранения синусового ритма и развития рецидивов МА и побочных действий препаратов в течение года наблюдения представлена в табл. 3. Не было ни одного случая пропуска пациентами назначенных визитов, прекращения исследования по иным причинам помимо рецидивов аритмии и побочных действий препаратов. Не было ни одного случая тромбоэмболических осложнений и смерти пациентов.
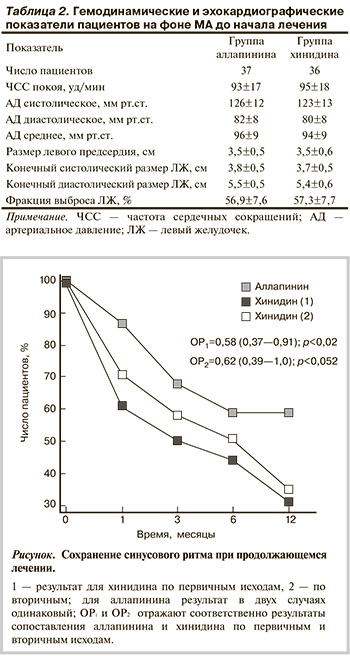
На рисунке представлена динамика сохранения синусового ритма, рассчитанная в пропорциях первичных и вторичных исходов исследования. При оценке по первичным исходам к концу 12-го месяца наблюдения продолжают прием аллапинина и имеют синусовый ритм 22 пациента из 37, начавших это лечение. Из 36 пациентов группы хинидина только 11 к указанному сроку имеют аналогичный результат. При оценке ОР (аллапинин против хинидина) он составляет 0,58 (при 95% доверительном интервале – ДИ от 0,37 до 0,91; р<0,02). При этом ЧБНЛ составляет 3,46 [1,97÷14,2].
При оценке по вторичным исходам, когда из анализа исключены пациенты, выбывшие по причине побочных действий хинидина, ОР составляет 0,62 (при 95% ДИ от 0,39 до 1,0; р=0,052). При этом ЧБНЛ составляет 4,2 (2,1÷122,7). Мощность исследования, однако, снизилась до 67% (односторонний критерий).
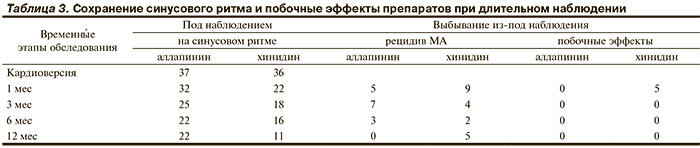
При однофакторном анализе влияние на частоту рецидивов МА оценивали для всех показателей, представленных в табл. 1 и 2, исходя из вторичных исходов исследования. Для группы аллапинина только один показатель — ЧСС в покое — статистически значимо выделял пациентов с рецидивом аритмии. Площадь под ROC-кривой составила 0,689 (при 95% ДИ от 0,52 до 0,82; р<0,03) с оптимальным уровнем отсечения ЧСС ≤89 уд/мин (ОШ -5,33 при 95% ДИ от 1,28 до 22,19; p<0,02). Для группы хинидина в однофакторном анализе 2 показателя имели статистическую значимость: конечный диастолический размер (КДР) ЛЖ и среднее АД. Для первого показателя площадь под ROC-кривой составила 0,757 (при 95% ДИ от 0,57 до 0,89; р<0,003) с оптимальным уровнем отсечения КДР >5,41 см (ОШ -6,75 при 95% ДИ от 1,14 до 39,8; p<0,03). Для второго показателя площадь под ROC-кривой составила 0,803 (при 95% ДИ от 0,62 до 0,92; р<0,001) с оптимальным уровнем отсечения среднего АД ≤93,3 мм рт.ст. (ОШ -10 при 95% ДИ от 1,07 до 93,4; p<0,04). Многофакторный анализ указал на независимый характер этих двух показателей.
Обсуждение
Стратегия контроля ритма при лечении больных с МА при ее персистирующей форме предполагает восстановление синусового ритма и последующее удержание его на протяжении длительного времени с помощью ААП [1, 2]. Важнейшим свойством используемых для этих целей ААП, таким образом, является их способность проявлять анти-аритмическую активность, достаточную для предотвращения рецидивов аритмии. Показано, что по сравнению с плацебо ААП класса IA, IC, III и β-адреноблокаторы повышают частоту сохранения синусового ритма при длительном лечении больных с персистирующей МА после кардиоверсии на 17,4—33,1% [4] при ЧБНЛ от 3 до 16 [5]. Однако все они оказывают неблагоприятные побочные действия, в том числе проаритмические эффекты, приводящие к необходимости отмены препарата, и индекс потенциального вреда (ИПВ) — число больных, которые должны получить экспериментальное лечение, чтобы у 1 дополнительного больного развился неблагоприятный исход, составляет от 9 до 27 [5]. Кроме того, хинидин, дизопирамид и соталол могут увеличивать смертность, оцениваемую значением ИПВ от 109 до 166 [5]. Все это ограничивает возможности лекарственной ААТ таких больных и требует строгого учета соотношения риска и пользы при выборе ААП.
Перечисленные неблагоприятные эффекты хинидина — наиболее часто применяемого в начале 90-х годов XX века ААП [6], привели сначала к снижению его использования в клинической практике [6], а со временем к отнесению его в разряд не рекомендуемых для лечения больных с МА [1, 2]. Одновременно происходило повышение частоты использования соталола и амиодарона, имевших, как казалось, большую эффективность и безопасность по сравнению с хинидином [6]. Более позднее крупное многоцентровое исследование показало, однако, что хинидин (в комбинации с верапамилом) не только не уступает, но и превосходит соталол по благоприятному влиянию на частоту рецидивов МА, не проявляя при этом большего числа побочных, в том числе проаритмических эффектов [7]. Это позволяет и сегодня рассматривать хинидин в качестве надежного стандарта для сравнения с новыми ААП при лечении больных с МА. При этом использование хинидина бисульфата имеет определенные преимущества перед другими лекарственными формами хинидина [8].
Сравнительная оценка аллапинина и хинидина в нашем исследовании имела целый ряд ограничений. Важнейшим из них являлось отсутствие технических возможностей электрокардиографической регистрации эпизодов аритмии, что не позволяло не только выявлять транзиторные эпизоды аритмии, но и точно устанавливать временны'е параметры рецидивов персистирующей МА. Роль этого момента во влиянии на конечные результаты исследования, особенно в части выявления бессимптомных аритмий, ярко продемонстрирована в исследовании PAFAC [7]. В свою очередь, это определило отказ от использования при анализе метода построения таблиц дожития, естественного в случае оценки зависимых от времени показателей. Применение прямого метода оценки результатов в виде отношения пропорций определило правомерность комбинированного первичного исхода исследования, включающего как аритмические события, так и лимитирующие лечение факторы. Благоприятным моментом при этом оказалось полное отсутствие выбывания пациентов из исследования по иным причинам.
В то же время при анализе по вторичным исходам исследования, когда оценивались только аритмические события, выбывание пациентов по причине побочных действий препаратов происходило в ранние сроки наблюдения и почти одновременно, что позволяло игнорировать влияние временнóго фактора.
Результаты проведенного сравнения отчетливо показывают преимущества аллапинина по сравнению с хинидином по суммарному показателю эффективности и безопасности в предупреждении рецидивов МА после восстановления синусового ритма. При лечении аллапинином шансы развития рецидива МА или прекращения лечения из-за побочных эффектов более чем в 3 раза ниже по сравнению с таковыми при лечении хинидином. Именно меньшее число побочных эффектов, требующих отмены аллапинина, в основном определяет эти различия, поскольку анализ по вторичным исходам исследования не выявил статистически значимых различий. В то же время это заключение не может быть принято окончательно, так как низкая статистическая мощность при данном сопоставлении не позволяет исключить проявления значимых преимуществ аллапинина при достаточном увеличении числа наблюдений. Этот вопрос требует дальнейшего изучения в новых исследованиях, протокол которых будет учитывать в том числе ограничения настоящего исследования. Тем не менее, можно утверждать, что аллапинин по своей антиаритмической эффективности не уступает хинидину, который, в свою очередь, по данным мета-анализов сопоставим с эффективностью рекомендованных ААП [5].
Другим ограничением данного исследования явилось его построение как открытого протокола с простой рандомизацией. С недостатками такого протокола могут быть связаны различия в групповых частотах таких показателей, как предшествующая пароксизмальная форма МА, длительный анамнез МА и впервые выявленная МА. Между тем, по результатам анализа, ни один из этих факторов не влиял на риск рецидива МА. Не оказывали влияния и такие известные факторы, как возраст, размер левого предсердия и длительность текущего эпизода МА [9]. Это во многом объяснимо с учетом тех ограничений, которые определялись критериями включения и невключения в исследование. На результат не оказывало влияние также сопутствующее назначение β-адреноблокаторов, которые сами дают противорецидивный эффект [5]. Важно подчеркнуть еще, что в исследование включали только лиц мужского пола.
В то же время факторами, влияющими на частоту рецидивов МА, оказались вполне неожиданные показатели. Они различались для аллапинина и хинидина. Для аллапинина таким единственным фактором явилась низкая ЧСС покоя. Возможное объяснение сводится к тому, что низкая частота ритма сердца при МА на безмедикаментозном фоне может отражать диффузные поражения предсердий, при которых риск предсердного проаритмического эффекта аллапинина выше за счет дополнительного замедления скорости проведения импульсов. Для хинидина такими факторами оказались КДР ЛЖ и среднее АД. В связи с этим можно предполагать, что минимальные признаки сердечной недостаточности создают неблагоприятные условия для действия хинидина, оказывающего, кроме всего прочего, собственный кардиодепрессивный эффект.
Заключение
Аллапинин не уступает хинидина бисульфату в эффективности по предотвращению рецидивов персистирующей формы мерцательной аритмии после восстановления синусового ритма, при этом аллапинин вызывает меньшее число неблагоприятных побочных эффектов, при которых требуется прекращение лечения.



