Тахиаритмии (ТА) — опасные осложнения коронарного шунтирования, возникающие в послеоперационном периоде, угрожающие жизни пациентов и встречающиеся, по данным разных авторов, в 13—40% случаев [1—5]. Наиболее часто ТА развиваются на 2—4-й день после операции [4, 6, 7]. Прогностически значимыми формами ТА являются фибрилляция предсердий (ФП) и желудочковые экстрасистолы высоких градаций (IV и V классов по классификации B. Lown и M. Wolf в модификации M. Ryan). Наличие ТА до операции служит предиктором возникновения ее в послеоперационном периоде [2, 4].
Для большинства пациентов ТА — доброкачественное осложнение. Вместе с тем возникнув в послеоперационном периоде, она может стать причиной тромбоэмболических осложнений, способствовать прогрессированию сердечной, дыхательной, почечной недостаточности, влиять на функциональное состояние шунтов, ухудшать качество жизни оперированных пациентов, удлинять сроки и увеличивать стоимость стационарного лечения [1, 7].
Несмотря на это тактика лечения пациентов с послеоперационной ТА до настоящего времени не стандартизирована. Во многих клинических исследованиях оценивалась эффективность фармакологической и нефармакологической профилактики ТА. Однако лишь в некоторых из них получены статистически достоверные результаты [7].
Ограничение применения антиаритмиков 1С класса у пациентов с ишемической болезнью сердца (ИБС) обусловлено публикациями исследований CAST I и II, выполненных около 20 лет назад. Однако результаты этих исследований связаны с применением только определенных препаратов (флекаинид, энкаинид и морацизин). На остальных представителей этого класса запрет распространился априори.
Минувшее десятилетие, прежде всего, благодаря развитию и принятию идей Сицилианского гамбита [8—10], продемонстрировало, что оценка роли отдельных препаратов или групп антиаритмических средств требует дифференцированного подхода с учетом соотношения пользы и риска, присущих препарату в конкретных ситуациях при строго сформулированных и достаточно узких показаниях. Поэтому понятно возобновление интереса к применению антиаритмических препаратов 1С класса у пациентов с ИБС [11, 12].
В этом контексте определение широты клинического применения аллапинина вновь становится актуальным, поскольку препарат обладает уникальными свойствами, позволяющими ему претендовать на роль препарата первого ряда при лечении определенных форм нарушений ритма сердца.
Аллапинин — антиаритмический препарат, разработанный в конце 70-х гг. XX века и разрешенный к клиническому применению в 1986 г. Несмотря на длительный срок использования этого препарата в клинической практике, сведения о результатах его изучения до настоящего времени немногочисленны и часто противоречивы.
По электрофизиологическим свойствам препарат наиболее близок к антиаритмикам 1C подкласса [13]. Аллапинин, как и другие антиаритмики 1C класса, длительно блокирует «быстрые» натриевые каналы, находящиеся в открытом состоянии. Но некоторые особенности электрофизиологических эффектов аллапинина отличают его от применяемых в настоящее время антиаритмиков 1С класса и определяют качественно иной, чем у этих препаратов, механизм реализации противоаритмического действия. Это диктует необходимость углубленного изучения данного лекарственного средства при соблюдении некоторых ограничений исследования: 1) аллапинин у пациентов с ИБС может применяться только коротким курсом, а не назначаться в виде постоянной, неопределенно долгой терапии; 2) аллапинин у пациентов с ИБС может быть использован только в условиях специализированного стационара, что обеспечит должный контроль не только эффективности, но и, что более важно, безопасности терапии.
Эти две позиции позволили авторам преодолеть ограничения, сформировавшиеся по результатам исследования САST.

Целью настоящей работы явилось сравнительное изучение профилактической эффективности аллапинина в периоперационном периоде коронарного шунтирования у больных ИБС с ТА в анамнезе по сравнению с общепринятыми антиаритмическими препаратами.
Материал и методы
В исследование были включены оперированные пациенты, имевшие в анамнезе документально подтвержденные пароксизмы ФП (пароксизмальная и персистирующая формы ФП) или желудочковую экстрасистолию (ЖЭ) высоких градаций (IV—V по классификации B. Lown и M. Wolf, 1971 г. в модификации M. Ryan, 1975). Именно эта категория оперированных пациентов с ИБС, согласно данным нашего ретроспективного анализа, имеет высокий риск возникновения ТА в послеоперационном периоде. ЖЭ высоких градаций считаются факторами риска внезапной смерти аритмического генеза.
Из исследования исключались следующие пациенты: с пароксизмальными наджелудочковыми тахикардиями, наджелудочковыми экстрасистолиями, так как эти виды аритмий принято считать прогностически незначимыми; с перманентной формой ФП; с размерами предсердий, превышающими границы нормы; с явлениями ишемической кардиомиопатии и снижением контрактильности миокарда левого желудочка сердца (ФВ≤40%); с тромбами в предсердиях или в левом желудочке сердца; с аневризмой левого желудочка; с поражением клапанного аппарата сердца; с недостаточностью кровообращения IIБ—III стадии (по классификации Образцова—Стражеско—Василенко); с дисфункцией щитовидной железы и сопутствующими заболеваниями, при которых требовалось назначение средств, влияющих на хронотропную функцию сердца (сердечные гликозиды, симпатомиметические и психотропные средства).
 Нами проанализированы медицинские карты 1526 стационарных больных ИБС, которым была выполнена хирургическая реваскуляризация миокарда в отделении сосудистой хирургии Республиканского кардиологического диспансера г.Уфы в период с 2004 по 2009 г.
Нами проанализированы медицинские карты 1526 стационарных больных ИБС, которым была выполнена хирургическая реваскуляризация миокарда в отделении сосудистой хирургии Республиканского кардиологического диспансера г.Уфы в период с 2004 по 2009 г.
В основу исследования вошли данные о 218 оперированных больных ИБС (204 мужчины и 14 женщин), исходно имевших в анамнезе указанные выше формы ТА. Возраст обследуемых больных колебался от 38 до 71 года, в среднем составил 55,8±5,3 года.
Постинфарктный кардиосклероз отмечен у 160 пациентов. Один инфаркт миокарда перенесли 106 больных, 2 инфаркта миокарда — 42 пациента, 3 инфаркта миокарда — 10, 4 инфаркта миокарда — 2 больных.
На фоне нестабильной стенокардии оперированы 6 пациентов. Функциональный класс стабильной стенокардии по классификации Канадского общества кардиологов (CCS) составил 3,01±0,23, функциональный класс недостаточности кровообращения по классификации Нью-Йоркской ассоциации сердца (NYHA) — 2,29±0,57.
Из сопутствующих заболеваний артериальная гипертензия отмечена у 164 (75,2%) пациентов, сахарный диабет — у 4 (1,8%).
По данным коронарографии, поражение одного коронарного сосуда выявлено у 14 (6,42%) больных, двухсосудистое поражение — у 57 (26,15%), трехсосудистое — у 147 (67,43%).
Среднее число пораженных артерий составило 2,61±0,6.
Гемодинамически значимое поражение передней межжелудочковой артерии диагностировано у 89,91% больных, огибающей артерии — у 77,06% и правой коронарной артерии — у 83,95%.
Показаниями к хирургическому лечению служили следующие критерии: выраженные стенозы коронарных артерий, по данным коронарографии; наличие у больного клинических проявлений стенокардии.

Средняя продолжительность операции составила 237,23±61,21 мин. С использованием искусственного кровообращения хирургическая реваскуляризация миокарда проведена у 214 (98,2%) пациентов, 4 оперированы в условиях «off pump». Средняя продолжительность искусственного кровообращения составила 88,36±26,01 мин, среднее время окклюзии аорты — 56,83±16,81 мин.
Среднее количество сформированных дистальных анастомозов в расчете на одного больного (индекс шунтирования) достигало 2,77±0,46. Левая внутренняя грудная артерия в качестве кондуита использовалась у 213 (97,71%) пациентов. У 2 больных из-за варикозной деформации стволов большой подкожной вены использовались лучевые артерии. У 4 больных коронарное шунтирование сочеталось с каротидной эндартерэктомией вследствие сопутствующего критического стеноза сонных артерий.
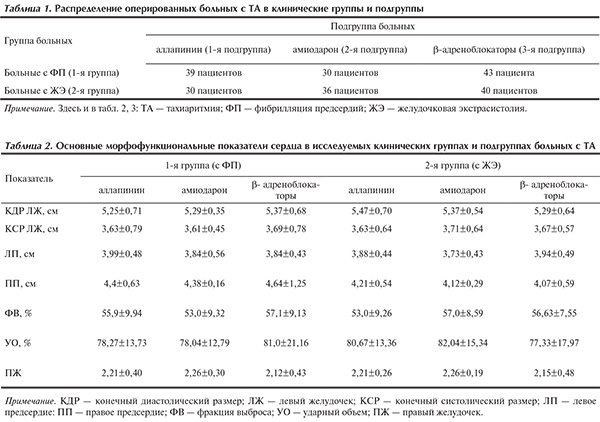
В зависимости от исходного вида ТА все 218 пациентов были разделены на 2 группы. В 1-ю группу вошли 112 оперированных пациентов с пароксизмальной и персистирующей формами ФП, 2-ю группу составили 106 пациентов, перенесших коронарное шунтирование, имеющие ЖЭ IV—V градаций по Lown—Wolf—Ryan.
В зависимости от вида профилактической медикаментозной антиаритмической терапии все пациенты в каждой группе были подразделены на 2 подгруппы (табл. 1).
Отбор пациентов в подгруппы 1.1, 1.3, 2.1 и 2.3 производили слепым методом. В подгруппы 1.2 и 2.2 попали больные с исходно подобранной схемой приема амиодарона, так как терапия этим препаратом требует кумуляции.
Все пациенты получали базисную терапию β-адреноблокаторами (метопролол 25—100 мг/сут). Аллапинин и амиодарон назначали за 7—8 дней до операции и их применение продолжалось в течение 10—12 дней послеоперационного периода. Аллапинин пациенты получали 3 раза в день по одной таблетке (25 мг) до операции и по 1—1,5 таблетки после операции. Амиодарон (200 мг) назначали в таблетках по общепринятой схеме. Сравнительный анализ не выявил достоверных различий по всем сравниваемым критериям в клинических группах и подгруппах (р>0,05 по методу Манна—Уитни и χ2). Основные клинические параметры групп представлены в табл. 2 и 3. Индекс шунтирования у пациентов подгруппы 1.1 составил 2,72±0,65; подгруппы 1.2 — 2,87±0,35; подгруппы 1.3 — 2,67±0,71; подгруппы 2.1 — 2,70±0,53; подгруппы 2.2 — 2,89±0,67; подгруппы 2.3 — 2,78±0,70.

За исследуемые критерии были приняты данные суточного мониторирования электрокардиограммы (ЭКГ) в течение 2 сут после операции и на 7—15-й день после операции, а также данные ежедневных ЭКГ после операции в течение 10—12 дней и клинические наблюдения. Электрокардиографическое исследование проводили на аппарате «BIOSET 8000» . ЭКГ снимали в 12 общепринятых отведениях. Обработку данных при суточном мониторировании ЭКГ осуществляли с помощью программного комплекса «Дарвин» или «Инкарт». Препарат считали эффективным в отсутствие пароксизмов ТА по данным клинического наблюдения, холтеровского мониторирования ЭКГ и ежедневных ЭКГ. Удлинения комплекса QRS более чем на 50% от исходного не наблюдалось ни в одном случае.
Обработку данных проводили с использованием методов статистического пакета Statistica 8.0. Полученные различия считали статистически достоверными при р<0,05.
Результаты и обсуждение
Эффективность исследуемых антиаритмических препаратов (амиодарон и аллапинин) оценивали в отношении профилактики пароксизмов ФП и ЖЭ высоких градаций (IV и V классов) у больных ИБС после коронарного шунтирования.
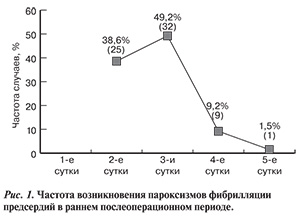
 Препарат считали неэффективным при возникновении хотя бы одного стойкого (более 30 с) пароксизма. Пароксизмы ФП регистрировались чаще на 2—3-и сутки послеоперационного периода. Частота их возникновения представлена на рис. 1. На момент выписки у всех больных сохранялся стойкий синусовый ритм. Эффективность препаратов по предупреждению пароксизмов ФП в послеоперационном периоде коронарного шунтирования представлена на рис. 2. В подгруппе больных, принимавших в периоперационном периоде только β-адреноблокаторы, пароксизмы ФП возникли у 40 (95,3%). В подгруппе больных, принимавших с профилактической целью амиодарон, пароксизмы ФП в послеоперационном периоде сохранились у 16 (53,3%). В подгруппе пациентов, принимавших аллапинин, эпизоды ФП, несмотря на увеличение дозы препарата, сохранились у 9 (23,1%).
Препарат считали неэффективным при возникновении хотя бы одного стойкого (более 30 с) пароксизма. Пароксизмы ФП регистрировались чаще на 2—3-и сутки послеоперационного периода. Частота их возникновения представлена на рис. 1. На момент выписки у всех больных сохранялся стойкий синусовый ритм. Эффективность препаратов по предупреждению пароксизмов ФП в послеоперационном периоде коронарного шунтирования представлена на рис. 2. В подгруппе больных, принимавших в периоперационном периоде только β-адреноблокаторы, пароксизмы ФП возникли у 40 (95,3%). В подгруппе больных, принимавших с профилактической целью амиодарон, пароксизмы ФП в послеоперационном периоде сохранились у 16 (53,3%). В подгруппе пациентов, принимавших аллапинин, эпизоды ФП, несмотря на увеличение дозы препарата, сохранились у 9 (23,1%).
В отношении ЖЭ препарат считался неэффективным при сохранении в периоперационном периоде экстрасистол IV—V классов, несмотря на профилактическую терапию. Эффективность препаратов по предупреждению ЖЭ высоких градаций представлена на рис. 3 и 4. Исходно в каждой подгруппе пациентов около 50% имели парные желудочковые экстрасистолы и по 25% групповые желудочковые экстрасистолы и короткие пароксизмы желудочковой тахикардии. В послеоперационном периоде желудочковая тахикардия не была зарегистрирована ни в одном случае. Однако прогностически опасные экстрисистолы (4А, 4Б) в группе больных, принимавших в периоперационном периоде только β-адреноблокаторы, сохранились у 29 (72,5%). У пациентов, принимавших антиаритмические препараты, групповые желудочковые экстрасистолы также не были зарегистрированы.
В подгруппе больных, принимавших с профилактической целью амиодарон, ЖЭ высоких градаций (4А) сохранились у 8 (22,2%). В подгруппе пациентов, принимавших аллапинин, ЖЭ высоких градаций (4А) сохранились лишь у 1 (3,3%).
Следует отметить, что наличие у больных ИБС в анамнезе ФП (пароксизмальной и персистирующей форм) и ЖЭ высоких градаций является предиктором высокого риска возникновения их в раннем послеоперационном периоде. По полученным данным, частота их возникновения в послеоперационном периоде у больных, получавших только базисную терапию β-адреноблокаторами, составила 95,3 и 72,5% соответственно. Эффективность изученных антиаритмических препаратов в большей степени проявлялась в отношении ЖЭ. При этом ФП были более устойчивы к антиаритмической терапии. Однако при сравнительной оценке эффективности аллапинина в отношении ФП и ЖЭ достоверных различий не получено (χ2=0,13; р=0,7230) (рис. 5). По результатам сравнительной оценки клинической эффективности исследуемых антиаритмических препаратов было установлено, что применение препарата аллапинин является безопасным и одним из наиболее эффективных методов профилактики пароксизмов как ФП, так и ЖЭ у оперированных больных ИБС. Ни одного случая проаритмогенного эффекта препарата зарегистрировано не было.
Выводы
Таким образом, в ходе исследования мы получили следующие выводы.
- Изолированное применение у больных ишемической болезнью сердца в периоперационном периоде β-адреноблокаторов с целью профилактики тахиаритмий недостаточно эффективно.
- Аллапинин — высокоэффективное антиаритмическое средство для профилактики тахиаритмий в периоперационном периоде коронарного шунтирования у пациентов с ишемической болезнью сердца.
- При сравнении антиаритмической активности аллапинин достоверно превосходит амиодарон.
- Применение короткого курса аллапинина в периоперационном периоде у больных ишемической болезнью сердца в условиях специализированного стационара является безопасным.



