Эффективное лечение больных гипертонической болезнью (ГБ) предупреждает сердечно-сосудистые осложнения (ССО). Мета-анализ 28 клинических исследований показал, что около 75% пациентов с артериальной гипертензией (АГ) нуждаются в комбинированной антигипертензивной терапии (АГТ) [1]. При назначении антигипертензивных препаратов следует учитывать не только уровень артериального давления (АД), но и сопутствующую патологию. АГ часто сочетается с избыточной массой тела и дислипидемией, т.е. нередко является компонентом метаболического синдрома (МС) [2].
МС считается «предиабетическим» состоянием, и у таких пациентов следует использовать препараты, улучшающие или, по крайней мере, не ухудшающие чувствительность к инсулину, и не усугубляющие дислипидемию, такие как блокаторы ренин-ангиотензин-альдостероновой системы (РААС) и антагонисты кальция [3].
Атерогенная дислипидемия у пациентов с МС, как правило, обусловливает необходимость медикаментозной коррекции. Польза от сочетанной терапии антигипертензивными препаратами и ингибиторами ГМГ-КоА-редуктазы (статинами) доказана. В частности, в исследовании ASCOT-LLA показано, что добавление статина к АГТ на основе амлодипина может снизить частоту тяжелых ССО сильнее, чем добавление статина к терапии на основе атенолола [4].
 Доказана высокая эффективность статинов при первичной и вторичной профилактике сердечно-сосудистых заболеваний (ССЗ). Исследование JUPITER обосновало применение статинов в целях первичной профилактики — установлено, что снижение уровня холестерина (ХС) липопротеинов низкой плотности (ЛНП) на фоне лечения розувастатином на 50% снижало частоту развития ССО на 44% [5].
Доказана высокая эффективность статинов при первичной и вторичной профилактике сердечно-сосудистых заболеваний (ССЗ). Исследование JUPITER обосновало применение статинов в целях первичной профилактики — установлено, что снижение уровня холестерина (ХС) липопротеинов низкой плотности (ЛНП) на фоне лечения розувастатином на 50% снижало частоту развития ССО на 44% [5].
У 58—74% больных абдоминальным ожирением встречается неалкогольная жировая болезнь печени (НАЖБП), что дает основание рассматривать эту патологию в качестве печеночного компонента МС. НАЖБП ассоциируется с ССЗ, в частности, с АГ [6, 7]. Эти патологические состояния имеют общие механизмы развития: инсулинорезистентность (ИР), лептинорезистентность [8].
При лечении пациентов с АГ и с дислипидемией следует учитывать наличие НАЖБП, так как антигипертензивные препараты и статины могут оказывать нежелательное воздействие на печень. В частности, нифедипин и дилтиазем могут вызывать неалкогольный стеатогепатит и их, по-видимому, не следует назначать пациентам со стеатозом печени. Статины могут оказывать гепатотоксическое действие, приводить к повышению уровня аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) и, как следствие этого, врачи нередко опасаются назначать статины пациентам с патологией печени. Вследствие этого нередко даже больные из группы высокого риска развития ССЗ не получают терапию, которая является «золотым стандартом» лечения.
Антигипертензивный эффект ингибитора ангиотензинпревращающего фермента (АПФ) лизиноприла и антагониста кальция амлодипина доказан (ACCOMPLISH, TOMHS, ALLHAT, STOP-Hypertension-2), равно как и гиполипидемическое действие розувастатина (JUPITER, STELLAR). Убедительным подтверждением высокой эффективности и безопасности лизиноприла, амлодипина и розувастатина у больных АГ и дислипидемией из группы высокого и очень высокого риска является завершившееся в 2015 г. исследование ROSALIA, которое включало 2452 пациента [9]. Терапия лизиноприлом в сочетании с амлодипином (с титрацией доз) привела к снижению АД с 159,9±13.3/90,0±8,6 до 129,5±9,1/78,1±6,1 мм рт.ст. При этом АД снизилось до целевого уровня (менее 140/90 мм рт.ст.) у 91% пациентов, а у 57% больных АД достигло значений ниже 130/80 мм рт.ст. Через 6 мес терапии розувастатином уровень ХС ЛНП снизился до менее 2,5 ммоль/л у 49% пациентов, достиг значение менее 1,8 ммоль/л у 40% больных, а у 67% снизился менее 3,0 ммоль/л [9].
Преимуществом лизиноприла, амлодипина и розувастатина является то, что в отличие от других препаратов эти лекарства подвергаются минимальному метаболизму в печени. Предполагается, что это сочетание препаратов у больных с АГ и дислипидемией не только эффективно, но и безопасно при лечении пациентов с МС и стеатозом печени.
Цель данного исследования — изучить эффективность и безопасность комбинации лизиноприла и амлодипина в сочетании с розувастатином у пациентов с МС и НАЖБП из группы высокого риска развития ССЗ.
Материал и методы
В исследование включали больных ГБ в возрасте 45—65 лет с АГ 2-й степени с систолическим АД (САД) >160 и/или диастолическим АД (ДАД) >100 мм рт.ст., не получавших АГТ, либо пациентов с неконтролируемой АГ на фоне монотерапии с САД >150 и/или ДАД >95 мм рт.ст. и имевших по данным суточного мониторирования АД (СМАД) среднесуточное АД >130/80 мм рт.ст. и/или дневное АД>135/85 мм рт.ст. Для включения в исследование пациенты должны были иметь МС и признаки НАЖБП. У пациентов измеряли антропометрические показатели: массу тела, рост, окружность талии (ОТ). МС был определен как наличие АГ, абдоминального ожирения (ОТ >94 см у мужчин и >80 см у женщин) в сочетании с хотя бы одним из признаков: уровень ХС ЛНП>3,0 ммоль/л, ХС липопротеинов высокой плотности (ЛВП) <1,0 ммоль/л у мужчин или <1,2 ммоль/л у женщин, триглицеридов (ТГ) >1,7 ммоль/л, гликемия натощак ≥6,1 ммоль/л, нарушение толерантности к глюкозе (глюкоза в плазме через 2 ч после приема 75 г глюкозы ≥7,8 и ≤11,1 ммоль/л). У всех больных определяли уровень глюкозы, инсулина натощак и индекс ИР HOMA. Ультразвуковое исследование (УЗИ) печени выполняли с целью выявления у пациентов признаков стеатоза и определения размеров печени. НАЖБП была диагностирована ультразвуковым методом, если эхогенная плотность печени превышала эхогенную плотность паренхимы почек. Наличие и степень выраженности фиброза печени оценивали с помощью шкалы NAFLD Fibrosis Score с использованием калькулятора http://nafldscore.com с учетом возраста, индекса массы тела, уровней АлАТ, АсАТ, альбумина, тромбоцитов, наличия нарушенной гликемии натощак и сахарного диабета (СД) [10].
При сборе анамнеза у пациентов анализировали частоту употребления алкоголя и оценивали признаки хронической алкогольной интоксикации. Алкогольную жировую болезнь печени исключали с помощью опросника AUDIT (Alcohol Use Disorders Inventory Test), выявлявшего чрезмерное употребление алкоголя [11]. В исследование включали пациентов, не злоупотреблявших алкоголем в прошлом и с уровнем потребления алкоголя менее 21 дозы в неделю для мужчин и менее 14 доз в неделю для женщин (1 доза =12,8 г чистого этанола).
В исследование не включали больных с вирусным гепатитом В и/или С, с положительными тестами на HCV-антитела, HBs-антиген, с превышением более чем в 2 раза верхних границ норм трансаминаз, щелочной фосфатазы (ЩФ), γ-глутамилтранспептидазы (ГГТП), общего билирубина. В исследование не включали пациентов с тяжелыми хроническими заболеваниями, пороками сердца, хронической сердечной недостаточностью, фибрилляцией предсердий, инфарктом миокарда, инсультом, нестабильной стенокардией, в том числе в анамнезе, с противопоказаниями к приему ингибиторов АПФ, амлодипина, статинов или с непереносимостью этих препаратов в анамнезе.
Всем пациентам были даны рекомендации по изменению образа жизни и назначена АГТ амлодипином и лизиноприлом (экватор, «Гедеон Рихтер», Венгрия) в дозе 5 мг амлодипина/10 мг лизиноприла. Через 4 нед лечения при уровне АД >140/90 мм рт.ст. дозу препарата удваивали.
Пациенты были рандомизированы методом конвертов для назначения или неназначения розувастатина (мертенил, «Гедеон Рихтер», Венгрия). Решение о начальной дозе и необходимости повышения дозы розувастатина принимали на основании исходных и целевых уровней ХС ЛНП, определенных индивидуально на основании Российских рекомендаций по диагностике и коррекции нарушений липидного обмена (2012) [12].
Измерение АД и частоты сердечных сокращений (ЧСС) проводили утром, до приема препаратов, трижды, с интервалом 1 мин, в положении больного сидя, и одно измерение АД и ЧСС проводили через 2 мин после перехода пациента в вертикальное положение. АД измеряли стандартизированным автоматическим прибором для измерения АД, манжету выбирали с учетом окружности плеча пациента.
СМАД выполняли с использованием осциллометрического прибора Кардиотехника-04-АД-1. Манжету выбирали индивидуально, у пациентов с окружностью плеча более 32 см использовали большую манжету. Интервалы между измерениями АД составляли 15 мин в период с 7 до 22 ч и 30 мин с 22 до 7 ч.
Выполняли стандартную трансторакальную эхокардиографию с определением размеров полостей сердца, расчетом индекса массы миокарда левого желудочка (ЛЖ), определения толщины стенок ЛЖ, диастолической функции. Наряду со стандартными показателями определяли толщину эпикардиальной жировой ткани.
Статистический анализ данных проводили с использованием программы SPSS 17.0 с учетом характера распределения данных. Данные с нормальным распределением представлены как среднее ± ошибка среднего. Различия считали достоверными при р<0,05.
Результаты
В исследование включены 20 пациентов (12 женщин и 8 мужчин), характеристика которых представлена в табл. 1. Возраст обследованных составил 52,3±2,5 года. ОТ у женщин составила 110,2±3,3 см, у мужчин — 120,0±6,0 см. Индекс массы тела (ИМТ) у обследованных достигал 37,7±1,6 кг/ м2 (у женщин — 38,2±2,1 кг/м2, у мужчин — 37,0±2,8 кг/м2). Всем больным были даны рекомендации по изменению образа жизни, и через 6 мес у 13 пациентов (у 7 из группы сочетанной терапии и у 6 из группы АГТ) масса тела снизилась с 0,7 до 23 кг, что в среднем составило 6,9±1,7 кг. Средний ИМТ у обследованных снизился (см. табл. 1).
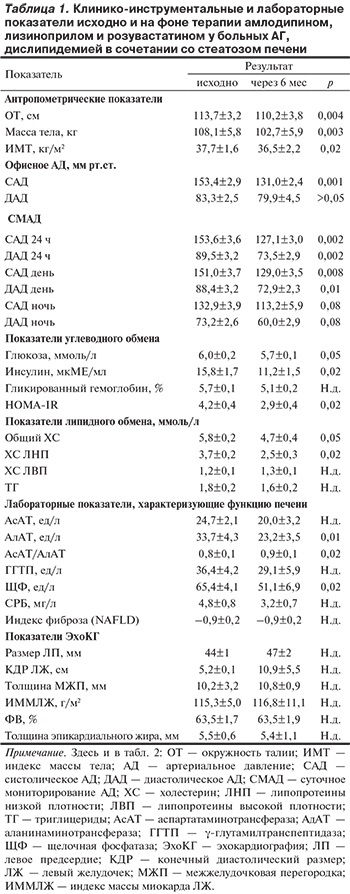
 Исходный уровень АД, измеренный амбулаторно врачом, составил 153,4±2,9/83,3±2,5 мм рт.ст. Отчетливый антигипертензивный эффект комбинации амлодипина и лизиноприла был зарегистрирован в первые дни приема и к 4-й неделе терапии АД достоверно снизилось до 145,0±2,1/79,4±3,5 мм рт. ст. Через 4 нед 2 больным доза комбинированной терапии амлодипином и лизиноприлом была увеличена до 10/20 мг, у остальных пациентов доза препарата оставалась прежней. На фоне терапии в течение 6 мес АД снизилось до 131,0±2,4/79,9±4,5 мм рт.ст. (р=0,001 для САД). У 17 больных АД нормализовалось, у 3 снизилось до субнормального уровня.
Исходный уровень АД, измеренный амбулаторно врачом, составил 153,4±2,9/83,3±2,5 мм рт.ст. Отчетливый антигипертензивный эффект комбинации амлодипина и лизиноприла был зарегистрирован в первые дни приема и к 4-й неделе терапии АД достоверно снизилось до 145,0±2,1/79,4±3,5 мм рт. ст. Через 4 нед 2 больным доза комбинированной терапии амлодипином и лизиноприлом была увеличена до 10/20 мг, у остальных пациентов доза препарата оставалась прежней. На фоне терапии в течение 6 мес АД снизилось до 131,0±2,4/79,9±4,5 мм рт.ст. (р=0,001 для САД). У 17 больных АД нормализовалось, у 3 снизилось до субнормального уровня.
Среднесуточное САД (по данным СМАД) снизилось с 153,6±3,6 до 127,1±3,0, а ДАД — с 89,5±3,2 до 73,5±2,9 мм рт.ст. Через 6 мес целевое АД по СМАД было достигнуто у 85% больных, высокое нормальное АД — у 10% и АГ 1-й степени — у 5%. Пациентам, не достигшим целевого уровня АД, к терапии был добавлен гидрохлоротиазид.
АД в дневные и в ночные часы по данным СМАД также снизилось (см. табл. 1). У 4 пациентов на фоне терапии нормализовался профиль АД: 2 пациента из категории нон-диппер и 2 пациента из найт-пикер перешли в катерогию диппер.
Эхокардиографические показатели, характеризующие основные структурно-функциональные параметры сердца, в том числе толщину эпикардиальной жировой ткани, в течение 6 мес терапии не изменились.
Исходно у всех обследованных отмечалась резистентность к инсулину, о чем свидетельствовал высокий индекс ИР (HOMA-IR) — 4,2±0,4. На фоне изменения образа жизни и проведенной АГТ и гиполипидемической терапии уровень инсулина натощак, индекс ИР HOMA-IR достоверно снизились, уровень глюкозы натощак также снизился (р=0,05) (см. табл. 1).
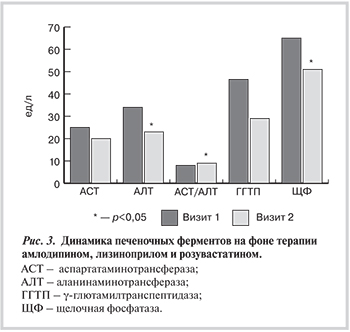
Средние уровни АсАТ и АлАТ не отличались от нормы, но у 3 обследованных уровень АлАТ был выше нормы и отношение АсАТ/АлАТ у них было ниже 1,0, что нередко наблюдается при НАЖБП. На фоне изменения образа жизни и проводимой терапии снизился уровень АлАТ и ЩФ.
У больных, включенных в исследование, был рассчитан индекс фиброза печени по шкале NAFLD Fibrosis. Среднее значение индекса составило –0,9±0,2, что соответствует промежуточному уровню фиброза. Детальный анализ показал, что у 15 человек выявлена промежуточная степень фиброза (–0,4±0,2) и у 5 пациентов — низкая степень (–2,25±0,2) по шкале NAFLD Fibrosis .
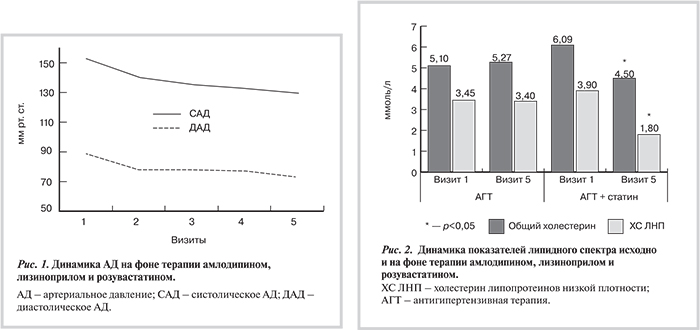
Динамика показателей липидограммы и лабораторных параметров, характеризующих функцию и структуру печени, проанализирована в группах больных, получавших (n=11) и не получавших (n=9) розувастатин в сочетании с амлодипином и лизиноприлом (табл. 2). Группы были сопоставимы по антропометрическим параметрам, исходному уровню АД. Уровень ТГ был выше у больных, получавших розувастатин (2,1±0,2 и 1,3±0,1 ммоль/л соответственно; р=0,01). Исходный уровень АлАТ был также выше у пациентов, включенных в группу терапии розувастатином (38,0±4,3 и 27,9±8,1 ед/л соответственно; р=0,04). По другим клиническим и инструментально-лабораторным показателям группы были сопоставимы.
Исходно у всех пациентов уровень ХС ЛНП был выше нормы. На фоне лечения розувастатином снизился уровень общего ХС и ХС ЛНП (см. табл. 2). Поскольку у этих пациентов имелся высокий риск развития ССЗ, то целевой уровень ХС ЛНП у них составлял менее 2,5 ммоль/л. В группе больных, получавших розувастатин, уровень ХС ЛНП снизился у всех пациентов. При этом у 45% человек уровень ХС ЛНП стал менее 1,8 ммоль/л и у всех пациентов этот показатель стал менее 2,5 ммоль/л. Среди пациентов, получавших лишь АГТ, уровень ХС ЛНП стал менее 2,5 ммоль/л только у одного больного и у 2 пациентов — менее 3,0 ммоль/л, у остальных пациентов уровень ХС ЛНП существенно не изменился. Уровень ТГ у больных, получавших розувастатин, снизился с 2,1±0,3 до 1,4±0,3 ммоль/л (р=0,03). Уровень ХС ЛВП на фоне лечения розувастатином не изменился. Показатели липидограммы у больных, получавших только АГТ, не изменились.
Для пациентов с НАЖБП (стеатозом, стеатогепатитом) большое значение имеет влияние гиполипидемической терапии и АГТ на функциональное и структурное состояние печени. Через 6 мес терапии в группе больных, получавших розувастатин, уровень АсАТ составил 26,9±3,8 ед/л, АлАТ 32,7±3,0 ед/л, ЩФ 44,5±8,9 ед/л, ГГТП 29,1±8,9 ед/л. Индекс фиброза по шкале NAFLD не изменился в обеих группах лечения.
Переносимость препаратов экватор и мертенил была хорошей. Вместе с тем у 2 больных отмечалось избыточное снижение АД и обусловленная этим слабость, у одной больной возникли нежелательные явления — отеки голеней.
Обсуждение
Абдоминальное ожирение, АГ и дислипидемия — наиболее характерные проявления МС. Вместе с тем пациентам с МС свойственна и более высокая частота развития стеатоза печени — начальной стадии НАЖБП [8]. Стеатоз печени в нашем исследовании доказан результатами УЗИ; отношение АсАТ/АлАТ у пациентов в исследовании составило 0,73, т.е. было менее 1, что соответствует НАЖБП. Для алкогольного стеатогепатита характерно преимущественное повышение уровня АсАТ и коэффициент АсАТ/АлАТ у таких больных, как правило, выше 1 [11].
При абдоминальном ожирении в жировой ткани усиливается липолиз с высвобождением свободных жирных кислот (СЖК). В гепатоцитах блокируется β-окисление жирных кислот, нарушаются внутриклеточные сигналы ядерных рецепторов активатора пролиферации пероксисом и ферментная система печени не может метаболизировать избыток СЖК, формируются липидные вакуоли — стеатоз печени. Он может прогрессировать с формированием стеатогепатита и фиброза. Интраабдоминальная жировая ткань оказывает прямой профиброгенный эффект, продуцируя норадреналин и ангиотензин II, провоспалительные адипоцитокины. СЖК индуцируют цитохром Р450-2Е1 с последующей продукцией реактивных форм кислорода, которые путем усиления перекисного окисления липидов приводят к активации фибронеогенеза. Накопление СЖК в печени способствует и гиперинсулинемии. Следовательно, абдоминальному ожирению, АГ, дислипидемии и стеатозу печени свойственны общие механизмы: ИР, хроническое воспаление, увеличенное образование фиброза [13]. В нашем исследовании у всех пациентов со стеатозом печени до начала лечения выявлена ИР, о чем свидетельствует индекс ИР (HOMA-IR), превышающий 2,7. Кроме того, у обследованных нами пациентов обнаружены косвенные признаки формирования фиброза печени — увеличение индекса фиброза по шкале NAFLD Fibrosis.
Стеатоз печени диагностируется у некоторых больных ГБ в отсутствие других признаков МС. Существует предположение, что не только снижение массы тела у больных ожирением, но и эффективный контроль АД может благоприятно воздействовать на течение стеатоза печени и предупреждать прогрессирование НАЖБП [8].
При лечении пациентов с сочетанием ГБ, дислипидемии и НАЖБП следует принимать во внимание наличие патологии печени. Ингибиторы АПФ, блокирующие РААС, подавляют активность тканевого и циркулирующего ангиотензина II, уменьшая выраженность процессов образования фиброза и синтеза коллагена в сосудистой стенке, в миокарде. Антагонисты кальция наряду со снижением АД уменьшают дисфункцию эндотелия, активность неспецифического воспаления. Возможно, применение этих препаратов может предупреждать и прогрессирование НАЖБП.
Фиксированные комбинации ингибиторов АПФ и блокаторов медленных кальциевых каналов снижают частоту развития ССО. Этим препаратам свойственна метаболическая нейтральность, что особенно ценно при лечении пациентов с гиперлипидемией и МС [3].
Использование лизиноприла и амлодипина представляется обоснованным выбором у больных с АГ и НАЖБП, поскольку эти компоненты препарата экватор практически не метаболизируются в печени. В частности, гидрофильный ингибитор АПФ лизиноприл является активным препаратом, в отличие от других ингибиторов АПФ, у которых активным является не сам препарат, а его метаболит после трансформации в печени. Эффективность и безопасность препарата экватор доказана в клинических исследованиях [9, 14—16]. В нашем исследовании отчетливый антигипертензивный эффект комбинации препаратов амлодипин/лизиноприл был установлен уже через 4 нед лечения и сохранялся на протяжении всего периода наблюдения за пациентами.
При лечении пациентов с дислипидемией из группы высокого риска развития ССЗ, как в нашем исследовании, следует применять статины. Наличие НАЖБП не является противопоказанием к назначению этих препаратов. У пациентов с НАЖБП ССЗ, в том числе ИБС, несоизмеримо чаще приводят к смерти, чем заболевание печени [17]. В связи с этим назначение статинов таким пациентам, безусловно, оправдано. Безопасность применения статинов у больных с НАЖБП была продемонстрирована ранее в исследовании GREACE в котором было показано, что из 880 больных с НАЖБП, которые принимали статины, менее 1% прекратили прием статинов из-за негативного влияния на печень — повышения активности АсАТ или АлАТ более чем в 3 раза по сравнению с верхней границей нормы. Более того, у пациентов с исходно умеренным повышением активности трансаминаз или ГГТП, на фоне терапии статинами отмечалось даже снижение повышенных уровней трансаминаз и ГГТП. В течение 3 лет показатели, характеризующие функции печени, нормализовались у 89% пациентов. При этом риск развития ССО снизился на 68% [18]. Таким образом, у больных с умеренным повышением активности трансаминаз, обусловленных НАЖБП, применение статинов безопасно и может не только улучшить биохимические показатели, характеризующие функцию печени, но и снижать частоту развития ССО [18].
Механизмы, объясняющие положительное влияние статинов на функциональное состояние печени при НАЖБП, следующие:
- снижение уровня окисленных ЛНП;
- снижение уровня фактора некроза опухоли, интерлейкина-6;
- снижение транспорта СЖК в печень;
- воздействие на сигнальную систему инсулина через адипонектин [19].
Розувастатин — гидрофильный статин четвертого поколения, а при НАЖБП предпочтительно использовать именно гидрофильный статин. В исследовании MERCURY было показано, что при использовании розувастатина в дозе 10 мг/сут у 60—80% пациентов были достигнуты целевые уровни ХС ЛНП [12]. Исследования СТРЕЛА и ROSALIA, продемонстрировали высокую эффективность и безопасность розувастатина у пациентов с НАЖБП и МС [9, 20].
Ранее в исследовании «От 5 до 40» была установлена не только эффективность, но и безопасность применения розувастатина. В частности, на фоне лечения уровни АсАТ, АлАТ и креатинкиназы не отличались от исходных значений [21]. Ранее были выявлены и плейотропные эффекты розувастатина — снижение продукции провоспалительных цитокинов (фактора некроза опухоли и интерлейкина-6) [22]. Прямое сравнение в рамках рандомизированного исследования розувастатина — мертенила («Гедеон Рихтер») и розувастатина — крестора («Astrazeneka UK Ltd») у пациентов с гиперлипидемией продемонстрировало сопоставимую степень снижения уровня ХС ЛНП и частоту достижения целевого уровня ХС ЛНП у пациентов, принимавших мертенил и крестор. Статистически значимых отклонений лабораторных показателей (АсАТ, АлАТ, креатинкиназы) на фоне применения мертенила и крестора не выявлено [23].
В нашем исследовании на фоне терапии розувастатином в дозе 10—20 мг/сут целевой уровень ХС ЛНП (менее 2,5 ммоль/л) был достигнут у всех пациентов, при этом повышения активности трансаминаз не зарегистрировано ни у одного пациента, средние уровни АлАТ и АсАТ не увеличились.
Терапия амлодипином, лизиноприлом и розувастатином в нашем исследовании сопровождалась снижением индекса HOMA-IR, что свидетельствует об уменьшении выраженности ИР. Вместе с тем при лечении статинами пациентов с МС следует учитывать, что эти препараты в высоких дозах несколько увеличивают риск развития СД. Абсолютный риск развития СД составляет 2,0 дополнительных случаев СД у пациентов, получающих симвастатин или аторвастатин в дозе 80 мг/сут на 1000 человеко/лет [24]. Мета-анализ, проведенный N. Sattar и соавт. в 2010 г., продемонстрировал, что соотношение пользы (предупреждения тяжелых ССО) и вреда (риск развития СД) на фоне лечения статинами составляет 9:1 в пользу предупреждения ССО [25]. Следовательно, у больных группы высокого риска развития ССЗ целесообразно применение статинов, несмотря на небольшой риск развития СД. Вместе с тем для снижения риска развития СД у пациентов с МС следует максимально корригировать факторы риска развития СД, в частности, увеличивать физическую нагрузку и снижать энергетическую ценность употребляемой пищи. При лечении пациентов со стеатозом печени следует также резко ограничить или исключить употребление алкоголя, учитывая, что ожирение и злоупотребление алкоголем действуют как синергисты, способствуя формированию и прогрессированию фиброза печени.
Ограничениями данного исследования являются небольшая группа наблюдения и сравнительно короткий срок наблюдения.
Заключение
Неалкогольная жировая болезнь печени, абдоминальное ожирение, метаболический синдром нередко сочетаются и имеют общие механизмы развития и прогрессирования. При лечении артериальной гипертензии и гиперлипидемии у больных из группы высокого риска развития сердечно-сосудистых осложнений следует учитывать наличие стеатоза печени. Проведенное исследование подтвердило, что коррекция образа жизни в сочетании с фармакотерапией амлодипином и лизиноприлом (экватор) позволяет нормализовать артериальное давление у большинства пациентов с артериальной гипертензией 2-й степени и уменьшить выраженность резистентности к инсулину. Полученные данные продемонстрировали, что терапия розувастатином (мертинил), в том числе в сочетании с амлодипином и лизиноприлом, эффективна и безопасна, так как позволяет уменьшить выраженность атерогенной дислипидемии и не усугубляет проявления неалкогольной жировой болезни печени.



