Операция коронарного шунтирования (КШ), особенно выполняемая в условиях искусственного кровообращения (ИК), у 20—90% пациентов может приводить к развитию послеоперационной когнитивной дисфункции (ПОКД) [1—5]. Этиология когнитивной дисфункции после операции на открытом сердце является многофакторной и включает микроэмболизацию мозговых сосудов, глобальную гипоперфузию головного мозга, системный воспалительный ответ, повреждение гематоэнцефалического барьера [6—8]. Когнитивные нарушения в отсутствие их коррекции приводят к усугублению клинического состояния и снижению качества жизни пациентов, более скорому наступлению деменции и сопровождаются повышенной смертностью [9—11]. В то же время сохранность когнитивных функций служит показателем успешного лечения заболевания, высокой приверженности пациента к назначенному лечению [11, 12].
 Ряд исследователей придают особое значение в развитии ПОКД системной воспалительной реакции (СВР) [13, 14]. Реологическая, иммунная и эндокринная системы взаимосвязанно и взаимозависимо формируют СВР, которая сама может приводить к повреждению, а также является фоном, усугубляющим последствия микроэмболии и гипоперфузии ткани головного мозга при КШ в условиях ИК. Цитокины, образующиеся при СВР под воздействием ИК, исследователями рассматриваются как непосредственный фактор агрессии по отношению к гематоэнцефалическому барьеру и клеточным компонентам мозга. Тем не менее недостаточно данных о влиянии СВР на формирование ПОКД, а также неясно, какие из его маркеров играют наибольшую роль в развитии когнитивного дефицита в послеоперационном периоде.
Ряд исследователей придают особое значение в развитии ПОКД системной воспалительной реакции (СВР) [13, 14]. Реологическая, иммунная и эндокринная системы взаимосвязанно и взаимозависимо формируют СВР, которая сама может приводить к повреждению, а также является фоном, усугубляющим последствия микроэмболии и гипоперфузии ткани головного мозга при КШ в условиях ИК. Цитокины, образующиеся при СВР под воздействием ИК, исследователями рассматриваются как непосредственный фактор агрессии по отношению к гематоэнцефалическому барьеру и клеточным компонентам мозга. Тем не менее недостаточно данных о влиянии СВР на формирование ПОКД, а также неясно, какие из его маркеров играют наибольшую роль в развитии когнитивного дефицита в послеоперационном периоде.
Актуален поиск средств, способных подавить активность СВР и предупредить развитие ПОКД. В последние годы появились исследования, доказавшие возможность проявления таких эффектов при использовании статинов. Известно, что статины благодаря плейотропным эффектам благотворно влияют на функцию эндотелия, повышают стабильность атеросклеротических бляшек [15]. В ряде исследований показано, что применение статинов в предоперационный период КШ снижает выраженность СВР [16], частоту развития фибрилляции предсердий в послеоперационном периоде, а также длительность пребывания в стационаре кардиохирургических пациентов [17—19]. Показано, что предоперационная терапия статинами сопровождается снижением частоты развития неврологических нарушений I типа после КШ [20, 21]. Однако остается неясным влияние статинов на частоту неврологических осложнений II типа после КШ.
Целью настоящего исследования явилось изучение влияния розувастатина на развитие ранней ПОКД у пациентов после КШ в условиях ИК.
Материал и методы
Дизайн исследования был одобрен локальным Этическим комитетом института. В исследование были включены 109 пациентов мужского пола, средний возраст которых составил 55,9±5,3 года, госпитализированных в кардиологическое отделение института для подготовки к плановому КШ в период с 2009 по 2011 гг. Критериями для включения в исследование были возраст моложе 70 лет, проведение КШ в условиях ИК, праворукость пациента, отсутствие липидснижающей терапии до госпитализации в течение 1 мес и более, согласие на проведение исследования. Критериями исключения были возраст пациента старше 70 лет, стенозы сонных артерий 50% и более, наличие тяжелых нарушений ритма, хроническая сердечная недостаточность (ХСН) IIБ стадии, сахарный диабет, хронические обструктивные заболевания легких, онкологические заболевания, заболевания центральной нервной системы, травмы головного мозга, эпизоды нарушения мозгового кровообращения, оценка по шкале MMSE (Mini-mental State Examination) менее 24 баллов и/или менее 11 баллов по шкале FAB (Frontal Assessment Battery), оценка по шкале Бека более 8 баллов, отказ пациента от начала или продолжения исследования.
Распределение пациентов по группам происходило методом простой рандомизации с использованием таблицы случайных чисел. В 1-ю группу (четные номера) включены пациенты, принимающие розувастатин (n=69), во 2-ю группу (нечетные номера) — пациенты, не принимающие розувастатин и другие холестеринснижающие препараты в период пребывания в стационаре (n=40). Разное число пациентов в группах объясняется тем, что период набора их в группу не принимавших статины оказался короче, чем в группе, где статины назначались, так как в 2011 г. были введены Международные рекомендации по ведению пациентов, планируемых на КШ (www.circ.ahajournals.org/content/124/23/e652), согласно которым рекомендуется назначение статинов перед КШ. В обеих группах пациенты не принимали статины на догоспитальном этапе в течение не менее 1 мес по следующим причинам: препарат не назначили на амбулаторном этапе (7%), непонимание пациентами цели назначения препарата (22%), пациент забыл (35%), не купил препарат (20%), другие причины (16%). Группы пациентов до операции были сопоставимы по основным клинико-анамнестическим, интраоперационным показателям (табл. 1).
Пациенты получали до и после операции базисную и симптоматическую терапию, соответствующую общим принципам лечения ишемической болезни сердца (ИБС), ХСН и артериальной гипертензии согласно Национальным рекомендациям: ограничение приема поваренной соли (<5 г/сут), гипохолестериновая диета, прием β-адреноблокаторов (бисопролола фумарата), ингибиторов ангиотензинпревращающего фермента (эналаприла малеата), дезагрегантов (ацетилсалициловая кислота). По показаниям использовали непрямые антикоагулянты, антагонисты кальция (амлодипин), нитраты (изосорбида динитрат). Пациентам 1-й группы назначали розувастатин за 10—14 дней до операции в дозе 20 мг/сут. Последний прием розувастатина был утром в день операции. Прием препарата возобновляли в первые сутки послеоперационного периода в той же дозе. Таким образом, прием розувастатина осуществлялся в течение всего периода пребывания в стационаре с рекомендациями дальнейшего приема на амбулаторном этапе. Пациентам 2-й группы также рекомендовали прием статинов при выписке из стационара. Неиспользование на догоспитальном этапе статинов объясняется исключительно низкой приверженностью пациентов лечению.
Нейропсихологическое тестирование проводили за 10—14 дней до операции, затем на 2-е, 7—10-е сутки после КШ с использованием программного психофизиологического комплекса Status PF, состоящего из стандартизованных тестов [22]. Оценивали внимание (корректурная проба Бурдона), память (тесты запоминания 10 чисел и слов), нейродинамику (сложная зрительно-моторная реакция, уровень функциональной подвижности нервных процессов, работоспособность головного мозга). Проводили индивидуальный анализ изменений нейропсихологических показателей. ПОКД диагностировали у пациента при наличии снижения послеоперационных показателей на 20% по сравнению с дооперационными в 20% из всех использованных нейропсихологических тестов [8].
Помимо стандартных клинико-лабораторных показателей выраженность СВР оценивали по уровню в плазме крови цитокинов: интерлейкинов (ИЛ) 1, 6, 8, 12, фактора некроза опухоли-альфа (α-ФНО) и противовоспалительных цитокинов: ИЛ-10, а также высокочувствительного С-реактивного белка (вч-СРБ) с помощью однофазного иммуноферментного анализа по ELISA с использованием наборов фирмы «Bender MedSystems» (Австрия). Кровь из локтевой вены брали в пробирки с активатором свертывания, подвергали центрифугированию 15 мин при 1500 об/мин. Сыворотку аликвотировали и замораживали при температуре –70 °С. Концентрацию цитокинов в плазме определяли при поступлении в стационар, за 2 дня до хирургического вмешательства, на 2-е и 7—10-е сутки после него.
Статистическую обработку данных исследования осуществляли с помощью программы Statistica 6.0 (StatSoft Inc.). Анализ исследуемых параметров на нормальность распределения производили с помощью критерия Колмогорова—Смирнова. Распределение данных отличалось от нормального, в связи с чем для анализа клинико-анамнестических и нейропсихологических показателей были использованы непараметрические критерии (χ2, Манна—Уитни, Вилкоксона и Фридмана). Показатели цитокинового статуса подвергали логарифмированию для нормализации распределения и оценивали с помощью t-критерия Стьюдента для независимых выборок. Данные представлены в виде средних значений и стандартного отклонения (Μ±σ). Различия между группами считали статистически значимыми при р<0,05.
Результаты
При обследовании пациентов в послеоперационном периоде в группе не принимавших розувастатин у 2 (2,5%) выявлено развитие неврологических осложнений I типа, в связи с этим они были исключены из последующего анализа. В группе принимавших розувастатин очаговой неврологической симптоматики и аффективных расстройств не наблюдалось. Однако на 2-е сутки после КШ астенический синдром и синдром вегетативной дисфункции наблюдались у всех пациентов и имели обратное развитие к 7—10-м суткам после операции.
На фоне терапии розувастатином не выявлено побочных эффектов. На протяжении всего периода пребывания в стационаре не выявлено статистически значимых различий по уровню аспартатаминотрансферазы, аланинаминотрансферазы и креатинфосфокиназы между двумя группами.
Сравнительный анализ динамики нейропсихологических показателей и маркеров воспаления в зависимости от приема розувастатина показал следующие результаты.
Пациенты, принимавшие розувастатин, на 7—10-е сутки послеоперационного периода демонстрировали лучшие показатели памяти (в тестах запоминания 10 чисел и слов) (р=0,01 и р=0,05 соответственно) и внимания (количество переработанных знаков в корректурной пробе на 1-й и 4-й минутах) (р=0,005 и р=0,01 соответственно) по сравнению с группой не принимавших статины (рис. 1).
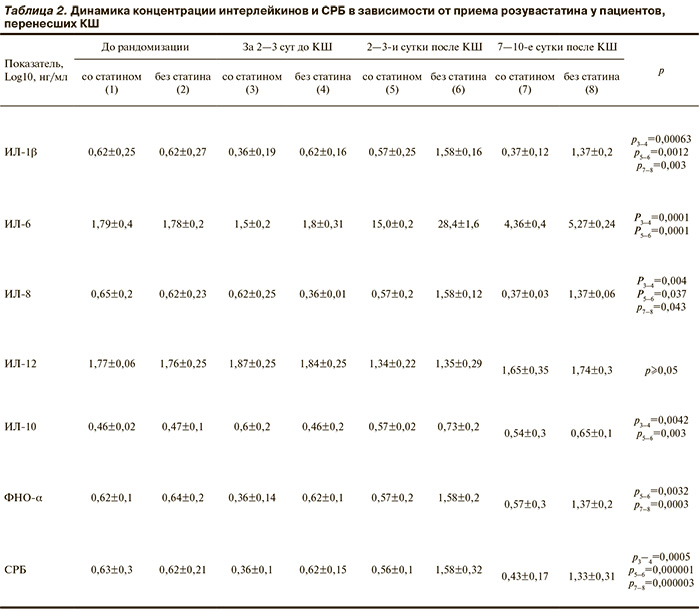
Следующим этапом исследования был анализ концентрации маркеров воспаления в системном кровотоке у пациентов исследуемых групп. До применения розувастатина межгрупповых различий по концентрации маркеров воспаления выявлено не было. Обнаружено, что за 2 дня до операции у пациентов, которые не принимали розувастатин, уровни провоспалительных цитокинов были выше, чем у пациентов, которые в предоперационном периоде в течение 10—14 дней принимали розувастатин: вч-СРБ — в 2 раза (р=0,0005), ИЛ-1β — в 1,7 раза (р=0,00063), ИЛ-8 и ИЛ-6 — в 1,2 раза (р=0,004 и р=0,0001 соответственно), α-ФНО — в 2 раза (р=0,00034) (табл. 2). На 2-е сутки после хирургического вмешательства у пациентов обеих групп выявлено повышение в плазме концентрации вч-СРБ, ИЛ-1β, ИЛ-6, ИЛ-8, α-ФНО по сравнению с дооперационными показателями. Однако в группе пациентов, которые не принимали розувастатин, эти показатели были выше, чем у пациентов, которые его принимали: вч-СРБ и ИЛ-6 — в 2 раза (р=0,000001 и р=0,0001 соответственно), ИЛ-1β — в 1,4 раза (р=0,0012), ИЛ-8 — в 1,2 раза (р=0,037), α-ФНО — в 2,7 раза (р=0,0032). К 7—10-м суткам послеоперационного периода наблюдалось снижение концентрации провоспалительных цитокинов в обеих группах, однако в группе пациентов, которые не принимали статин, их уровень по-прежнему был выше: вч-СРБ и α-ФНО — в 3,7 раза (р=0,000003 и р=0,0003 соответственно), ИЛ-1β — в 1,3 раза (р=0,003), ИЛ-8 — в 1,25 раза (р=0,043). На 2-е сутки после КШ как в группе пациентов, принимавших розувастатин, так и в группе пациентов, которые его не принимали, концентрация ИЛ-12 в плазме снизилась по сравнению с дооперационными показателями (р=0,003 и р=0,0028 соответственно), однако к 10-м суткам послеоперационного периода наблюдалось повышение его концентрации. Межгрупповые различия по концентрации ИЛ-12 в плазме как до операции, так и в послеоперационном периоде были статистически незначимыми.
Кроме того, у пациентов, не принимавших статины, наблюдался ряд корреляций между концентрацией цитокинов и показателями когнитивных функций. Так, увеличение концентрации α-ФНО, ИЛ-1β на 2-е сутки и ИЛ-12 на 10-е сутки после КШ ассоциировалось со снижением скорости реакции в нейродинамических тестах (r=0,61; p=0,01, r=0,6; p=0,035 и r=0,8; p=0,003 соответственно). Высокие концентрации ИЛ-6, ИЛ-12 на 2-е сутки после КШ были ассоциированы с меньшим количеством запомненных слов (r=–0,61; p=0,01 и r=–0,62; p=0,01 соответственно). Помимо этого, высокая концентрация ИЛ-8 на 10-е сутки после КШ была ассоциирована с меньшим количеством переработанных знаков в тесте «корректурная проба Бурдона» (r=–0,8; p=0,04).

В группе, принимавшей розувастатин, статистически значимых корреляций между указанными показателями не обнаружено.
Таким образом, у пациентов, принимавших розувастатин, в послеоперационном периоде после КШ показатели нейропсихологического статуса оказались лучше, чем у пациентов, которые его не принимали. Кроме того, в этой группе пациентов наблюдались более низкие концентрации ИЛ-1β, 6, 8, α-ФНО, а также вч-СРБ и более высокие концентрации ИЛ-10. У группы, не принимавшей розувастатин, худшие нейропсихологические показатели были ассоциированы с более высокой концентрацией провоспалительных цитокинов.
Обсуждение
Повышение концентрации цитокинов служит основой клинических проявлений СВР — разной степени выраженности полиорганной недостаточности в раннем послеоперационном периоде. В проведенном исследовании, как и в ранее опубликованных работах, показано, что КШ в условиях ИК ассоциируется с повышением в плазме крови концентрации α-ФНО, провоспалительных ИЛ-6 и ИЛ-8, вч-СРБ [16, 23]. Известно, что увеличение уровня цитокинов в результате СВР не только приводит к повреждению эндотелия, но и вызывает увеличение продукции индуцибельной синтазы оксида азота, что влечет за собой опосредованную оксидом азота гипотензию, прогрессирование воспалительной реакции, нарушения гематоэнцефалического барьера, апоптоз нейронов [24—26].
В дополнение к непосредственному повреждению нейронов цитокины активизируют микроглию и резидентные макрофаги в головном мозге, которые обычно активируются для очистки ткани мозга от подвергшихся апоптозу клеток [25, 27].
Тяжесть проявлений СВР определяет течение послеоперационного периода, ближайший и отдаленный прогноз у больных ИБС, оперированных в условиях ИК [28], в том числе выраженность ПОКД. W.A. van Gool и соавт. [29] подчеркивают, что эффект активации микроглии может сохраняться в течение нескольких месяцев, что может служить причиной и отдаленной ПОКД. Подтверждением взаимосвязи между СВР и степенью тяжести ПОКД явились представленные в настоящем исследовании корреляции между активностью СВР и выраженностью ПОКД.

Необходимость использования статинов у пациентов с ИБС является доказанным фактом. Согласно современным рекомендациям (ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery, 2011) все пациенты, подвергающиеся КШ, должны получать статины в отсутствие противопоказаний (уровень доказательности I А). Однако в реальной клинической практике в связи с низкими показателями приверженности не все пациенты с коронарной болезнью сердца их применяют [19]. В связи с этим актуален вопрос об эффективности использования коротких курсов статинов в период подготовки к КШ. В проводимых нами ранее исследованиях показано, что использование розувастатина в суточной дозе 20 мг в течение 10—14 дней перед КШ позволяет снизить риск развития инфаркта миокарда, фибрилляции предсердий, гнойно-септических осложнений в период пребывания в стационаре после операции [19].
Результаты, представленные в настоящем исследовании, позволяют утверждать наличие у розувастатина эффекта снижения частоты развития ПОКД. Один из механизмов реализации данного эффекта — противовоспалительный. Снижение концентрации ИЛ-1β, 6, 8, α-ФНО, а также вч-СРБ и более высокие концентрации ИЛ-10 могут свидетельствовать о том, что терапия статинами уменьшает выраженность СВР при кардиохирургических операциях в условиях ИК. Это предположение согласуется с данными ранее проведенных исследований [16, 30], в которых также показано снижение концентрации цитокинов под влиянием терапии статинами. Однако помимо системных эффектов статинов, направленных на подавление генерализованной воспалительной реакции, в литературе активно обсуждаются самостоятельные нейропротективные свойства статинов. Во-первых, можно предположить, что снижение СВР под влиянием терапии статинами может быть, в том числе, в мозговой ткани. Во-вторых, результаты экспериментальных работ на клеточных культурах показали наличие у статинов прямых нейропротективных свойств. Так, розувастатин способен снижать глутаматную эксайтотоксичность, увеличивать жизнеспособность нейрональной культуры и таким образом реализовать прямой нейропротективный эффект [31, 32].
Таким образом, кратковременная периоперационная терапия розувастатином в дозе 20 мг/сут снижает концентрацию в плазме крови провоспалительных цитокинов, α-ФНО, вч-СРБ, повышает концентрацию противовоспалительного ИЛ-10 и оптимизирует послеоперационный нейропсихологический статус пациентов, перенесших КШ в условиях ИК. Выбор в настоящем исследовании в качестве статина розувастатина объясняется данными, полученными по результатам исследований MERCURY II [33] и STELLAR [34]: препарат является самым эффективным из группы статинов для достижения целевого уровня липопротеинов низкой плотности и не менее безопасным, чем другие статины.
Заключение
Периоперационная терапия розувастатином в дозе 20 мг/сут снижает выраженность системной воспалительной реакции и частоту развития ранней послеоперационной когнитивной дисфункции у пациентов, подвергшихся коронарному шунтированию в условиях искусственного кровообращения.



