Несмотря на достигнутые успехи современной кардиохирургии, выполнение операций на открытом сердце сопряжено с риском развития церебральных осложнений [1]. Одним из таких осложнений является нарушение когнитивной функции, которое, по мнению разных авторов, наблюдается у 46—79% пациентов, перенесших коронарное шунтирование (КШ) с использованием искусственного кровообращения (ИК) [2—7]. Причины нейрокогнитивного дефицита при этом остаются недостаточно изученными. Вместе с тем установление причин когнитивной дисфункции после КШ может явиться основой для разработки патогенетически обоснованных способов профилактики и коррекции интраоперационного поражения головного мозга. Существуют данные о том, что одной из важных причин нейропсихологических изменений после операции с применением ИК может служить нарушение перфузии головного мозга [7, 8]. Однако исследования такого плана единичны.
 Однофотонная эмиссионная компьютерная томография (ОЭКТ) головного мозга является наиболее распространенным методом радионуклидной индикации, применяемым для диагностики расстройств мозгового кровообращения при инсульте, транзиторных ишемических атаках, субарахноидальных кровоизлияниях и ряде других нарушений мозговой гемодинамики [9]. Однако работы, посвященные оценке перфузии головного мозга при хирургической реваскуляризации миокарда с применением ИК, единичны [8].
Однофотонная эмиссионная компьютерная томография (ОЭКТ) головного мозга является наиболее распространенным методом радионуклидной индикации, применяемым для диагностики расстройств мозгового кровообращения при инсульте, транзиторных ишемических атаках, субарахноидальных кровоизлияниях и ряде других нарушений мозговой гемодинамики [9]. Однако работы, посвященные оценке перфузии головного мозга при хирургической реваскуляризации миокарда с применением ИК, единичны [8].
Целью настоящего исследования явилось изучение влияние КШ, выполненного в условиях ИК, на регионарный мозговой кровоток и когнитивную функцию у больных ишемической болезнью сердца (ИБС).
Материал и методы
В исследование включены 22 больных ИБС со стенокардией напряжения III—IV функционального класса по Канадской классификации (средний возраст 56,3±1,8 года), которым операцию КШ проводили с использованием ИК. Диагноз ИБС был установлен на основании клинико-инструментального исследования, включающего общеклиническое обследование, электрокардиографию, эхокардиографию и коронаровентрикулографию M. Judkins. Кроме того, у всех больных проводили стандартное неврологическое обследование и ультразвуковое исследование сонных артерий. Степень стенозов в области бифуркации общей сонной артерии и внутренней сонной артерии не превышала 20%.
При этом ОЭКТ головного мозга с 99mТс-ГМПАО и оценку когнитивной функции проводили трижды: до КШ, в ближайшем (10—15 дней) и отдаленном (6 мес) послеоперационных периодах.
Медицинскими критериями исключения пациентов из исследования явились предыдущие операции на открытом сердце с использованием ИК, применение общей анестезии в течение предшествующих 2 лет, хирургические вмешательства на сонных артериях, тяжелые неврологические расстройства (в том числе инсульт) и психические заболевания (включая наркотическую зависимость и хронический алкоголизм) в анамнезе, выраженный дефицит зрения и слуха, а также возраст больных старше 75 лет, стенозы внутренней сонной артерии более 30%.
Всем пациентам была выполнена операция КШ в условия ИК.
Перфузионная томосцинтиграфия головного мозга. ОЭКТ выполняли с использованием 99mТс-ГМПАО. Радиофармпрепарат 99mТс-ГМПАО (Сеrеtеc) готовили из стандартного набора путем добавления 740 МБк 99mТсО4 в 5,0 мл изотонического раствора натрия хлорида. Данный препарат вводили каждому исследуемому внутривенно не позднее 10 мин после приготовления.
Регистрацию изображений выполняли с использованием двухдетекторного эмиссионного компьютерного томографа Forte («Philips»). Расчет объемного регионарного мозгового кровотока (рМК) в передней теменной, задней теменной, лобной верхней, лобной нижней, височной и затылочной областях, а также полушариях мозжечка производили с использованием трехкомпонентной модели кинетики 99mТс-ГМПАО, представленной N. Lassen и соавт. [10], в модификации Y. Yonekura и соавт. [11].
Оценка неврологического статуса и когнитивной функции. Всем пациентам проводили стандартное неврологическое обследование. Когнитивную функцию оценивали, используя нейропсихологические тесты по схеме А.Р. Лурии [12] и методики Векслера [13] (табл. 1).
Перфузионную ОЭКТ головного мозга и нейропсихологическое тестирование проводили трижды: до КШ, а также через 10—15 дней и 6 мес после КШ. При этом для уменьшения эффекта «тест-ретест», учитывая незначительный временной промежуток между дооперационным и ранним послеоперационным обследованиями, использовали чередование версий когнитивных проб.
Методы статистической обработки. Полученные данные обрабатывали при помощи пакета программ Statistica («StatSoft.Inc»), версия 6.0, с использованием описательной статистики. Для оценки различий зависимых совокупностей использовали парный критерий Вилкоксона, для оценки достоверности различий — непараметрический критерий χ2 для парных значений. Для определения взаимосвязи между отдельным (отдельными) качественным признаком (признаками) и отдельным количественным признаком проводили одно- или многофакторный регрессионный анализ с вычислением критерия F Фишера. Качество регрессионной модели оценивали по величине квадрата множественного коэффициента корреляции (коэффициента детерминации) R2. Во всех процедурах статистического анализа уровень значимости p принимали равным 0,05. Результаты представлены как М±SD, где М — среднее арифметическое, SD — среднеквадратичное отклонение.
Результаты
Исследование показало, что операции с использованием ИК сопровождались снижением мозгового кровотока (в целом по группе) в лобной и теменной долях правого полушария (р<0,01) (рис. 1, 2, табл. 2). Так, через 2 нед после КШ по данным перфузионной ОЭКТ головного мозга обнаружено снижение рМК с 44,9±2,0 до 42,6±2,7 мл/100 г/мин (р=0,008) в правой передней теменной доле, с 47,2±2,6 до 44,7±2,0 мл/100 г/мин — в правой задней теменной доле (р=0,013), с 45,5±2,3 до 43,4±2,7 мл/100 г/мин (р=0,008) в правой лобной верхней доле и с 48,0±2,3 до 45,5±2,0 мл/100 г/мин (р=0,006) в правой нижней лобной доле. В височной и затылочной долях достоверных изменений перфузии головного мозга мы не отметили.

Следует отметить, что значительное снижение (более чем на 5%) перфузии головного мозга в ближайшем послеоперационном периоде после хирургического вмешательства в условиях экстракорпорального кровообращения отмечалось у 15 (68%) пациентов, тогда как у 7 (32%) больных ИБС достоверных изменений регионарного кровотока не наблюдалось (см. рис. 2).
Через 6 мес после хирургического вмешательства по данным ОЭКТ с 99mТс-ГМПАО сохранялось снижение перфузии головного мозга в правой задней теменной и верхней лобной областях по сравнению с дооперационным уровнем (см. табл. 2). В остальных регионах головного мозга значительной разницы по сравнению с исходными показателями рМК не отмечено. При индивидуальном анализе результатов мы обнаружили, что у 12 (54,5%) пациентов после операции в условиях ИК в отдаленном периоде выявлено снижение регионарного кровотока по сравнению с исходными значениями, а у остальных 10 (45,5%) столь значительных изменений перфузии головного мозга не отмечалось (см. рис. 2). При этом только у 3 больных мозговой кровоток возвратился к дооперационным значениям.
Результаты неврологического обследования показали, что в послеоперационном периоде у 1 пациента данной группы был диагностирован малый инсульт в бассейне правой средней мозговой артерии. Данный случай можно объяснить аортальной атероэмболией, осложняющей КШ, на что указывают в своих работах и другие исследователи [14]. Известно, что атеросклеротические изменения восходящего отдела аорты являются наиболее важным предиктором инсульта после КШ [15]. Этот факт подтверждает теорию, в соответствии с которой основной причиной ишемических осложнений является дислокация атероматозных масс во время операции [16]. В большинстве случаев церебральные атероэмболии, осложняющие КШ, как правило, возникают интраоперационно в процессе канюляции восходящего отдела и дуги аорты, пережатия аорты и наложения проксимального анастомоза или вследствие разрушения атеросклеротических бляшек струей крови из аортальной канюли [17].

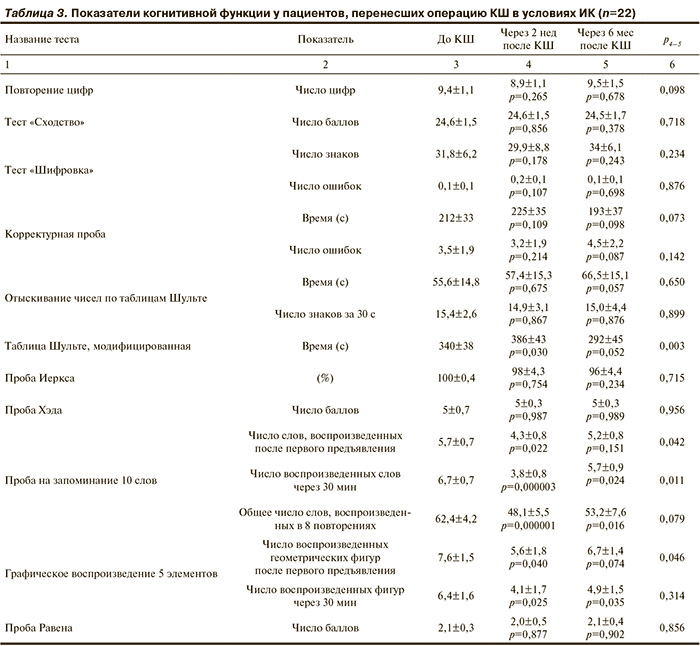
Через 2 нед после операции КШ, выполненной в условиях ИК, у 21 (95%) пациента отмечался нейрокогнитивный дефицит (рис. 3), который проявлялся послеоперационным снижением краткосрочной памяти в среднем на 25,6% (p=0,022), долговременной памяти на 43,3% (p=0,000003) и продуктивности запоминания на 23,1% (p=0,000001) (табл. 3). Кроме того, выявлено ухудшение показателей зрительной кратковременной памяти на 26,3% (p=0,04), долговременной памяти на 36% (p=0,025) и психомоторной скорости на 13,5% (p=0,03).
Как следует из табл. 3, оценка мышления, оптико-пространственного гнозиса и конструктивно-пространственного праксиса не выявила статистически значимых послеоперационных изменений в этой группе пациентов. Попутно следует отметить, что в ряде исследований, в которых определяли функцию головного мозга у пациентов вскоре после операции с использованием экстракорпорального кровообращения, также обнаружено достоверное снижение нейрокогнитивных показателей [18—20]. Так, в работах M.F. Newman и соавт. [19] и M. Sellman и соавт. [21] выявлены изменения в сходных когнитивных областях (памяти, внимания, психомоторной реакции).
В отдаленном послеоперационном периоде (через 6 мес) наблюдалось уменьшение частоты выявления нейропсихологического дефицита по сравнению с ранними сроками после операции (см. рис. 3). В частности, значительное ухудшение когнитивной функции (более чем на 20%) наблюдалось у 55% из общего числа больных данной группы. Продолжительность негативных эффектов КШ в отношении тех или иных когнитивных функций была различной. При этом отмечалось восстановление до исходного уровня кратковременной памяти и психомоторной скорости (см. табл. 3). Следует отметить, что при оценке долговременной слухоречевой и зрительной памяти, а также продуктивности запоминания выявлено их длительное послеоперационное ухудшение. Как представлено в табл. 3, через 6 мес после КШ в среднем по группе продуктивность запоминания, долговременная слухоречевая и зрительная память оставались сниженными по сравнению с дооперационными данными, соответственно, на 14,5% (p=0,016), 15% (p=0,024) и 23% (p=0,035). Однако по сравнению с ранним послеоперационным периодом отмечалось улучшение слухоречевой долговременной памяти (р=0,011), тогда как продуктивность запоминания и зрительная долговременная память имели лишь тенденцию к улучшению.
Следует отметить, что изменениям перфузии головного мозга соответствовала и динамика когнитивного статуса. При индивидуальном анализе результатов выявлено, что у всех 16 пациентов с послеоперационным нарушением рМК отмечалась нейрокогнитивная дисфункция. Среди 6 больных с неизмененной перфузией головного мозга только в одном случае когнитивная функция после операции не изменялась, а у 5 (53%) также отмечался нейрокогнитивный дефицит (р<0,05).

Проведение многофакторного регрессионного анализа позволило выявить достоверную корреляцию между ухудшением долговременной зрительной памяти и снижением рМК в правой задней теменной области (R2=0,612; F=7,886; р=0,035). По данным многофакторного регрессионного анализа, через 6 мес после операции выявлена достоверная корреляция между улучшением краткосрочной памяти и перфузией головного мозга в правой нижней лобной доле (R2=0,665; F=7,950; р=0,048). В то же время мы не отметили взаимосвязи между изменениями показателей других тестов и рМК по данным ОЭКТ головного мозга с 99mТс-ГМПАО. Это, скорее всего, связано с тем, что выполнение большинства неврологических тестов требует множества когнитивных операций, и невозможно выделить конкретные регионы головного мозга, поражение которых специфично к ухудшению показателей того или иного теста. Тем не менее снижение рМК в отдельных областях может приводить к нейрокогнитивной дисфункции. В связи с этим мы считаем, что неврологический дефицит после операции на открытом сердце, вероятнее всего, связан с нарушением крово-снабжения головного мозга.
Обсуждение
Выявленные нами нарушения перфузии головного мозга и ухудшение нейрокогнитивных показателей после хирургического вмешательства с ИК могут быть обусловлены целым рядом факторов, среди которых следует особо выделить микроэмболию сосудов головного мозга различной степени выраженности, а также развитие транзиторной ишемии головного мозга вследствие снижения перфузионного давления во время использования ИК [22]. Несмотря на наличие артериальных фильтров в контуре аппарата ИК, у пациентов, подвергнутых КШ, могут образовываться микроэмболы [23]. Их наличие в церебральном русле было установлено в свое время с помощью транскраниальной допплерографии и ретинальной флюоресцентной ангиографии [22, 24]. Источниками микроэмболии сосудов мозга при кардиохирургических операциях становятся, как правило, агрегаты тромбоцитов, воздух, липидные капли, белковые частицы, фрагменты кальцинированных атеросклеротических бляшек из восходящей аорты [25] и др.
Так, в исследованиях D.A. Stump и соавт. [25] показано, что степень склерозирования аорты и число эмболов, оцениваемое с помощью транскраниальной допплерографии, коррелируют с изменениями когнитивной функции. S. Fearn и соавт. установили, что наличие эмболов во время КШ связано с послеоперационным ухудшением памяти [24]. К настоящему времени накоплены доказательства того, что случаи эмболии сосудов головного мозга во время ИК непостоянны и могут быть связаны со специфическими хирургическими и перфузионными манипуляциями (канюляция крупных сосудов, работа аппарата ИК и, особенно, пережатие аорты) [22]. Именно поэтому в ведущих клиниках во время кардиохирургических операций с ИК для профилактики эмболии нашли применение интрааортальные баллоны-окклюдеры и специальные аортальные канюли с фильтром-уловителем [26].
Как мы уже отмечали, авторы более ранних исследований [27, 28] поддерживают гипотезу об интраоперационной гипотензии как потенциальной причине цереброваскулярных нарушений и ухудшения неврологического статуса после кардиохирургических операций. Однако в более поздних работах эти доводы опровергаются в связи с тем, что на фоне сниженного церебрального кровотока тяжесть эмболии мозговых сосудов оказывается намного меньше, чем при адекватной перфузии [29, 30].
Ранее опубликованные нами данные [31—33] и результаты, полученные в настоящем исследовании, позволяют утверждать, что именно нарушение перфузии головного мозга является одной из важнейших причин развития нейрокогнитивного дефицита у больных ИБС после КШ с использованием ИК.
Заключение
Таким образом, выполнение коронарного шунтирования с применением экстракорпорального кровообращения сопровождается нарушением перфузии головного мозга, приводящим к развитию когнитивной дисфункции. Наиболее чувствительными к негативным влияниям хирургического вмешательства оказались слухоречевая и зрительная краткосрочная и долговременная память, продуктивность запоминания и психомоторная скорость.



