Коронарное шунтирование (КШ) — эффективный метод лечения больных ишемической болезнью сердца (ИБС) [1]. Главными причинами смерти больных в период пребывания в стационаре после КШ остаются инфаркт миокарда (ИМ), инсульт, острое повреждение почек (ОПП) с развитием почечной недостаточности. Для прогнозирования риска смерти в период пребывания в стационаре больных, подвергшихся КШ, традиционно используется шкала EuroSCORE. Однако в этой шкале дисфункция почек оценивается только по уровню креатинина крови >200 мкмоль/л. Адекватная оценка риска нарушения функций почек с помощью биологических маркеров может иметь бо'льшую прогностическую ценность, чем традиционные методы, основанные на количественном определении показателей, повышающихся в случае, если появляется развернутая стадия острой дисфункции почек. Известно также, что в основе сердечно-сосудистых осложнений (ССО) и почечных осложнений КШ находятся единые патофизиологические звенья, включая снижение фракции изгнания левого желудочка, длительность искусственного кровообращения, интенсивность системного воспалительного ответа [2]. Это позволяет использовать ряд ранних маркеров дисфункции почек и для прогнозирования ССО [3, 4].
По мнению некоторых авторов, одним из наиболее информативных биомаркеров раннего повреждения почек может служить молекула повреждения почек 1-го типа (KIM-1) в моче [5, 6]. Этот биологический маркер является структурным гликопротеином I типа эпителиальных клеток проксимальных канальцев почек, который не выделяется почками у здоровых людей, однако при повреждении проксимальных почечных канальцев обнаруживается в моче. До сих пор отсутствуют убедительные данные о возможности использования этого биологического маркера для прогнозирования риска развития осложнений КШ.
Целью настоящего исследования явилась оценка клинической и прогностической значимости KIM-1 в развитии осложнений сосудистого и почечного генеза у больных ИБС в период пребывания в стационаре после операции КШ.
Материал и методы
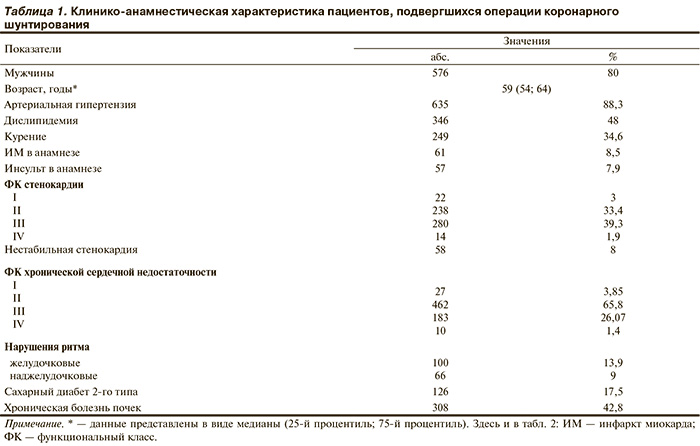
Все пациенты подписывали информированное согласие на участие в исследовании. Проанализировано течение периоперационного периода у 719 пациентов (576 мужчин и 143 женщин), подвергшихся операции КШ в ФГБУ НИИ КПССЗ СО РАМН в период с марта 2011 г. по апрель 2012 г. Возраст пациентов составил от 33 до 78 (средний 59) лет. У всех пациентов перед проведением КШ и на 7-е сутки после вмешательства определяли концентрацию креатинина в сыворотке крови и скорость клубочковой фильтрации (СКФ) по формуле MDRD (Modification of Diet in Renal Disease). Концентрацию KIM-1 в моче определяли с помощью тест-систем за сутки до и на 7-е сутки после операции. Общепринятые референсные значения составляют 0,156—5,33 нг/мл. У всех пациентов оценивали риск летальности в стационаре в баллах по шкале EuroSCORE. В табл. 1 представлена клинико-анамнестическая характеристика пациентов. Диагноз хронической болезни почек верифицирован по ранее принятым критериям [7]. До операции β-адреноблокаторы принимали 690 (96%) пациентов, ингибиторы ангиотензинпревращающего фермента — 702 (97,7%), антагонисты кальция — 654 (91%), нитраты пролонгированного действия — 258 (36%), статины — 194 (27%). Антиагреганты принимали 719 (100%) пациентов, однако за 7 сут до операции их отменяли, и пациентам с высоким функциональным классом (ФК) стенокардии был назначен низкомолекулярный гепарин.
У 668 (96%) пациентов операция КШ выполнялась в плановом порядке, у 24 (3,4%) — по срочным показаниям (без выписки из стационара после проведения коронарографии), у них выявлено субтотальное поражение ствола левой коронарной артерии в сочетании с субтотальным стенозом или окклюзией правой коронарной, передней нисходящей артерии или огибающей артерии. Экстренная операция КШ выполнена у 3 (0,4%) пациентов по поводу острого коронарного синдрома без подъема сегмента ST, в 1 случае — у пациента с кардиогенным шоком.
На 10—12-е сутки после операции оценивали развитие ССО (смерть, ИМ, гемодинамически значимые пароксизмальные нарушения ритма сердца, инсульт, транзиторная ишемическая атака, ОПП или прогрессирование почечной недостаточности, энцефалопатия, прогрессирование ишемии нижних конечностей, выполнение ремедиастинотомии по поводу кровотечения), а также внекардиальных осложнений — желудочно-кишечных (панкреонекроз, непроходимость кишечника, острый холецистит), неотложных операций на других органах (ушивание язвенного дефекта желудка, операции на периферических артериях), гнойно-септических медиастинитов, уретритов, сепсиса. Наличие хотя бы одного из перечисленных осложнений относили к проявлению неблагоприятного госпитального исхода.
Исследуемая группа пациентов соответствовала нормальному распределению. Статистическую обработку данных исследования осуществляли с помощью пакета программ Statistica 8.0.360.0 for Windows. Полученные результаты представлены в виде медианы и интерквартильного интервала (25-й процентиль; 75-й процентиль), средней величины и доверительного интервала. Две независимые группы сравнивали с помощью U-критерия Манна—Уитни, 3 и более — с помощью рангового анализа вариаций по Краскелу—Уоллису с последующим парным сравнением групп тестом Манна—Уитни с применением поправки Бонферрони при оценке значения p. Различия в сравниваемых группах считали достоверными при р<0,05.
Результаты
При оценке риска неблагоприятного исхода хирургического вмешательства на коронарных артериях с использованием классической шкалы EuroSCORE установлено, что 404 (56%) пациента исходно характеризовались низким риском, 245 (34%) — средним и 70 (10%) — высоким риском. Пациенты из группы низкого риска были моложе, чем пациенты группы среднего и высокого риска: медиана возраста пациентов группы низкого риска составила 57 (53; 61) лет, среднего — 62 (57; 68) (р=0,00008), а высокого риска — 65,5 (59; 72) лет (р=0,01). В табл. 2 представлена клиническая характеристика пациентов, подвергшихся операции КШ и разделенных по группам риска EuroSCORE. Увеличение риска по шкале EuroSCORE закономерно ассоциировалось с увеличением тяжести клинического состояния пациентов.

Традиционное использование в шкале EuroSCORE уровня креатинина плазмы >200 мкмоль/л в качестве фактора риска неблагоприятного исхода оперативного вмешательства отражает свершившееся повреждение почек. В настоящем исследовании между пациентами групп низкого, среднего и высокого риска EuroSCORE не было статистически достоверных различий по концентрации креатинина в сыворотке крови и СКФ как до операции, так и после нее. В то же время экскреция KIM-1 в моче за сутки до операции и на 7-е сутки после КШ достоверно увеличивалась по мере повышения группы риска по шкале EuroSCORE (табл. 3).
При анализе госпитального периода наблюдения выявлено 13 (1,7%) летальных исходов в связи с развитием острой сердечно-сосудистой и почечной недостаточности. В группе пациентов низкого риска EuroSCORE число летальных исходов составило 6 (1,4%), в группе среднего риска — 3 (1,2%) и в группе высокого риска — 4 (5,8%) (р1—2=0,8; р1—3=0,04; р2—3=0,06). Острый ИМ зарегистрирован у 2 (0,5%) пациентов группы низкого риска, у 2 (0,8%) — среднего и 2 (2,9%) высокого риска (р>0,05). Инсульт выявлен у 4 (0,9%) пациентов группы низкого риска, у 3 (1,2%) — среднего риска и у 2 (2,9%) высокого риска (р>0,05). Выявлено статистически значимое различие по частоте развития острой дисфункции почек между пациентами групп низкого и высокого риска. Острая почечная недостаточность развилась у 6 (1,4%) пациентов группы низкого риска, у 7 (2,9%) — среднего и у 6 (8,6%) высокого риска (р1—2=0,4; р1—3=0,0001; р2—3=0,07). Прогрессирование имевшейся почечной недостаточности выявлено у 3 (0,7%) пациентов группы низкого риска и у 4 (1,6%) среднего риска. Ремедиастинотомия по поводу кровотечения выполнялась у 3 (0,7%) пациентов группы низкого риска, у 9 (3,6%) — среднего и у 3 (4,3%) высокого риска (р1—2=0,01; р1—3=0,05; р2—3=0,9). Неблагоприятный исход зарегистрирован у 75 (18,5%) пациентов группы низкого риска, у 77 (31,0%) пациентов среднего риска и у 26 (37,0%) пациентов высокого риска (р1—2=0,0003; р1—3=0,0005; р2—3=0,4). Таким образом, с увеличением риска по шкале EuroSCORE увеличивается частота развития госпитальных осложнений.
В настоящем исследовании между группами пациентов с благоприятным и неблагоприятным госпитальными исходами не выявлено достоверных различий по концентрации креатинина в сыворотке крови и СКФ как до, так и после операции КШ.
В то же время как за сутки до, так и на 7-е сутки после КШ уровень KIM-1 в моче у пациентов с неблагоприятным исходом был достоверно выше, чем у пациентов с благоприятным исходом (рис. 1).

При анализе лабораторных данных всех умерших пациентов после выполненного КШ обнаружено, что средний уровень KIM-1 в моче за сутки до операции составил 16,2 (12,1; 19,3) нг/мл, в то время как у живых пациентов концентрация KIM-1 в моче составила 3,2 (1,3; 6,2) нг/мл.
При анализе различий по уровню биомаркера у пациентов с развитием отдельных ССО установлено, что у пациентов с периоперационным ИМ, инсультом и ОПП медиана экскреции KIM-1 в моче до операции была выше, чем у пациентов без этих осложнений (р<0,05) (рис. 2).
Таким образом, определение KIM-1 в моче в дооперационном периоде может быть полезным для выявления групп пациентов с высоким риском развития ССО и ОПП.
Обсуждение
Использование современных калькуляторов для оценки риска, связанного с хирургическим вмешательством в кардиохирургии, — повседневная практика [3]. Ранее нами показано, что шкала EuroSCORE продемонстрировала надежность в отношении оценки риска развития госпитальных осложнений у пациентов с мультифокальным атеросклерозом, подвергшихся КШ [8]. Известно, что шкала EuroSCORE используется для прогнозирования риска смерти в стационаре пациентов, подвергшихся прямой реваскуляризации миокарда. Как аддитивная, так и логистическая шкалы EuroSCORE продемонстрировали надежность при прогнозировании риска смерти пациентов в стационаре после КШ [9]. Одним из достоинств этой прогностической системы является учет отягощающих предоперационных факторов риска, в том числе уровня креатинина >200 мкмоль/л [10, 11]. Кроме того, эта шкала проста в практическом применении. Вместе с тем в последние годы появились сообщения, указывающие на высокий процент ложных результатов прогноза [12], свидетельствующих о том, что шкала EuroSCORE «занижает» риск развития периоперационных осложнений. В последние годы не прекращаются дискуссии о возможности модификации шкалы либо создании принципиально иных шкал, основанных на использовании высокочувствительных биологических маркеров, способных прогнозировать еще в дооперационном периоде развитие неблагоприятных ССО, почечных и других осложнений [13].
Дисфункция почек — независимый фактор риска развития сердечно-сосудистых заболеваний [14, 15], а у лиц с установленным диагнозом ИБС наличие хронического заболевания почек — такой же значимый предиктор неблагоприятного прогноза, как сахарный диабет или артериальная гипертензия [16, 17]. В то же время уровень креатинина является общепринятым лабораторным тестом, простым для определения и необходимым для расчетных методов определения СКФ.
Однако повышение уровня креатинина в сыворотке крови может определяться не только функцией почек, но и множеством других факторов, не связанных с системой выделения [18]. Основным ограничением диагностики ОПП является позднее повышение уровня креатинина: во многих случаях оно происходит лишь через 24—48 ч после развития ОПП. Объяснением может быть то, что почки обладают значительным функциональным резервом, поэтому концентрация креатинина не изменяется до тех пор, пока не утрачено 60% почечной паренхимы. Для ранней (на I и II стадиях) диагностики острой почечной недостаточности по принятым в ведущих клиниках критериям RIFLE [19, 20] необходимы маркеры, более чувствительные, чем повышение уровня креатинина в крови. Подобные ограничения могут касаться и применения СКФ, поскольку основным показателем расчета СКФ служит тот же креатинин крови.
Ранняя диагностика и своевременное начало лечения ОПП — важнейшие задачи, которые в последние годы послужили стимулом для целой волны исследований в поисках более совершенных биомаркеров. Как показали многоцентровые исследования, ОПП — это независимый фактор риска смерти больных в отделениях реанимации и интенсивной терапии, который ассоциируется с повышением сердечно-сосудистой смертности в 10—30 раз [21].

В связи с этим в течение последних нескольких лет идет активный поиск биологических маркеров, которые обладают большей чувствительностью и специфичностью, чем креатинин, на ранних стадиях ОПП, еще до клинических проявлений.
KIM-1 — трансмембранный протеин с доменами иммуноглобулина и муцина, впервые описан в 1998 г. [22].
В неповрежденной почечной ткани он содержится в небольшом количестве, но после ишемии его уровень в регенерирующих проксимальных канальцах значительно возрастает. Как показано на экспериментальных моделях, повышение уровня KИM-1 связано с ишемическим воздействием на почки и не всегда сопровождается повышением содержания азота мочевины и креатинина в крови [6, 23].
Многочисленные исследования показывают, что KIM-1 является высокочувствительным и специфичным маркером при повреждении почек и обладает высокой прогностической ценностью [24, 25]. Некоторые исследования показали, что KIM-1 может играть роль в повреждении и восстановлении почки, однако точный механизм этого пока неизвестен [26, 27]. В последнее время KIM-1 считается идеальным биомаркером в диагностике раннего повреждения почек, так как он не экспрессируется в нормальной почке и появляется только при повреждении проксимальных канальцев. Уровень KIM-1 в моче тесно связан с тканевой KIM-1 и коррелирует с тяжестью поражения почки. Количественное определение KIM-1 в моче является чувствительным неинвазивным методом оценки повреждения почки [28]. При воздействии нефротоксичности различных лекарственных препаратов уровень KIM-1 в моче резко увеличивается намного раньше, чем азот мочевины и креатинин [29]. Аналогичные данные получены в эксперименте: 10-минутная ишемия-реперфузия почки вызвала значительное увеличение мочевой KIM-1 без изменений уровня креатинина в плазме крови или протеинурии [6, 30].
В недавних исследованиях у пациентов с сердечной недостаточностью высокие уровни KIM-1 и других маркеров тубулярного повреждения ассоциируются с развитием неблагоприятных исходов [31]. В другом исследовании [32] принимали участие 123 пациента, подлежащих кардиохирургическому вмешательству. Повышение уровня KИM-1 в моче до операции ассоциировалось с увеличенным риском ОПП в послеоперационном периоде. Корреляция уровня KIM-1 с показателями шкалы APACHE II, летальностью в стационаре и потребностью в диализе отмечена при наблюдении 201 больного, госпитализированного по поводу ОПП [33].
В настоящем исследовании не получено статистически значимых различий по уровню креатинина в сыворотке крови и СКФ как до операции, так и на 7-е послеоперационные сутки среди пациентов различных групп риска по EuroSCORE, а также у пациентов с осложненным и неосложненным течением послеоперационного периода. При этом уровень KIM-1 в моче до операции и на 7-е сутки послеоперационного периода у пациентов групп среднего и высокого риска по шкале EuroSCORE был достоверно выше, чем у пациентов группы низкого риска.
Обнаружение KIM-1 в моче в дооперационном периоде оказалось полезным и для оценки риска развития в послеоперационном периоде отдельных ССО. Установлено, что у пациентов с развитием ИМ или инсульта после КШ предоперационные уровни KIM-1 достоверно выше, чем у пациентов без ИМ или инсульта. Уровни KIM-1 в моче у пациентов с развитием острой почечной недостаточности были также более высокими, чем у пациентов без острой почечной недостаточности.
Анализ уровня KIM-1 у пациентов с развитием в послеоперационном периоде неблагоприятного исхода также выявил статистически достоверно более высокие его значения как в дооперационном, так и в послеоперационном периоде, тогда как такие показатели дисфункции почек, как креатинин и СКФ, не показали значимых различий у пациентов с благоприятным и неблагоприятным исходом. Таким образом, предоперационное количественное определение KIM-1, являющейся доклиническим маркером ОПП, позволяет более точно прогнозировать риск развития неблагоприятных ССО и почечных осложнений в стационаре после КШ.
Вывод
Результаты настоящего исследования позволяют рассматривать определение молекулы повреждения почек 1-го типа в моче как дополнительный прогностический маркер развития их дисфункции и сердечно-сосудистых осложнений у пациентов, подвергшихся операции коронарного шунтирования.



