Сердечно-сосудистые заболевания (ССЗ) — ведущая причина смертности населения не только в России, но и в других странах [1, 2]. ССЗ определяют значительный экономический ущерб, который в 2008—2009 гг. превысил 1 трлн руб. и составил 3% от валового внутреннего продукта России [3].
Несмотря на прогресс в области фармакологии внедрение высокотехнологичной помощи, эффективность лечения больных ССЗ остается низкой. Максимум снижения риска смерти при хирургическом лечении составляет 50%, а при рациональной фармакотерапии не превышает 35% [4].Кроме того, по данным литературы, каждый четвертый пациент не придерживается предписанной лечащим врачом терапии [5]. Всемирной организацией здравоохранения неадекватная приверженность лечению признается «большой международной проблемой», при этом отмечается, что «приверженность долгосрочной терапии при хронических болезнях колеблется в пределах 50%» [6]. Низкая приверженность лечению оборачивается для больных повышенным риском развития осложнений и высокой смертностью, для общества — экономическими потерями и углублением негативных демографических тенденций [7]. Подсчитано, что низкая приверженность лечению служит причиной значительного количества смертельных случаев при ССЗ (в результате сердечной недостаточности и инсульта). Кроме того, предполагается, что почти 23% вызовов на дом, 10% госпитализаций и частых визитов в медицинские учреждения, диагностических мероприятий можно было бы избежать при соблюдении пациентами всех предписаний врача [8, 9]. Особую актуальность приобретает эта проблема у пациентов, подвергшихся коронарному шунтированию (КШ). Данное вмешательство, являясь паллиативным методом лечения больных ишемической болезнью сердца (ИБС), сохраняет необходимость неопределенно долгого использования консервативного лечения в послеоперационном периоде. Существуют лишь единичные зарубежные исследования, показавшие прямую связь между приверженностью пациентов терапии и результатами КШ [10, 11].
 Цель исследования — изучить влияние приверженности пациентов рекомендованной терапии на прогноз послеоперационного периода после КШ.
Цель исследования — изучить влияние приверженности пациентов рекомендованной терапии на прогноз послеоперационного периода после КШ.
Материал и методы
Методом сплошной выборки были обследованы 197 пациентов в возрасте от 38 до 75 лет, из них 164 мужчины и 33 женщины со стабильной ИБС, подвергшиеся КШ в 2009 г. в НИИ комплексных проблем сердечно-сосудистых заболеваний, Кемерово.
Критерии включения: планируемое КШ и добровольное информированное согласие пациента на участие в исследовании.
Критерии исключения: отказ больного от участия в исследовании и смерть в интра- и раннем послеоперационном периодах.
Все обследования соответствовали этическим стандартам биоэтического комитета, разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека». Протокол исследования был одобрен локальным этическим комитетом НИИ КПССЗ СО РАМН.
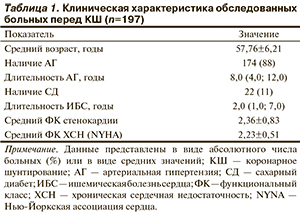
Клиническая характеристика пациентов, включенных в исследование, представлена в табл. 1.
Большинство пациентов до хирургического вмешательства имели стенокардию II и III функциональных классов — 83 (42%) и 85 (43%) соответственно. У 149 (76%) пациентов был зарегистрирован постинфарктный кардиосклероз, 14 (17%) пациентов перенесли 2 инфаркта миокарда (ИМ) и более, 18 (9%) пациентам в анамнезе проводилась чрескожная чреспросветная коронарная ангиопластика со стентированием. При оценке периферических сосудистых бассейнов выявлено сочетанное поражение коронарных и брахиоцефальных артерий у 47 (24%) пациентов, коронарных артерий и артерий нижних конечностей — у 22 (11%), трех сосудистых бассейнов — у 24 (12%).
Пациентов, включенных в исследование, обследовали за 5—7 дней перед проведением КШ и через 3 мес после КШ.
Через год после КШ оценивали клиническое состояние с анализом «конечных точек». В качестве анализируемых «конечных точек» были выбраны случаи повторных атеротромботических осложнений: ИМ, эпизоды нестабильной стенокардии, ишемический инсульт, летальные исходы.
При поступлении в стационар в период подготовки к хирургическому вмешательству всем пациентам была назначена консервативная терапия в соответствии с современными рекомендациями [12]. Перед выпиской из стационара пациентам даны рекомендации по рациональному образу жизни и необходимости долгосрочного применения соответствующей лекарственной терапии.
На каждом этапе оценивали клиническое состояние пациента; для анализа результатов лабораторных и инструментальных обследований использовали данные историй болезни и амбулаторных карт пациентов. В исследовании применяли опросник, который заполняли сами пациенты. Опросник отражал социально-демографические данные, терапию, получаемую до КШ и через 3 мес после КШ. Приверженность пациентов лечению оценивали по методике С.В. Давыдова [13] до КШ и через 3 мес после КШ.
Учитывая наличие множества показателей, которые характеризуют приверженность рекомендациям по терапии, была проведена комплексная оценка приверженности лечению. Каждый из анализируемых факторов был включен в комплексную оценку, итогом которой явился интегральный показатель, отражающий приверженность лечению. Построение интегрального показателя осуществлялось по следующему алгоритму. Все анализируемые факторы (переменные) были разбиты на 2 группы: факторы, характеризующие субъективную и объективную оценки приверженности. В группу факторов, характеризующих субъективную оценку приверженности, вошли 3 показателя, оцениваемые самим пациентом: оценка по методике Давыдова (Х1); соблюдение пациентом приема четырехкомпонентной терапии препаратов (Х4), а также регулярность приема лекарственных средств (Х5).

В качестве факторов, характеризующих объективную оценку приверженности, были отобраны достижение целевого уровня частоты сердечных сокращений (ЧСС, Х2), достижение целевых уровней общего холестерина (ОХС, Х3), артериального давления (АД, Х6), отказ от курения (Х7) и изменение индекса массы тела (ИМТ, Х8). Показатели Х1 и Х8 измеряли в количественной шкале, показатели Х2—Х7 могли принимать только 2 значения: 0 — отсутствие результата, 1 — достижение результата.
Для количественных данных, характеризующих приверженность, использовали преобразования, позволяющие переводить значения показателей Х1 и Х8 в диапазон от 0 до 1.
При этом исходили из того, что чем ближе значение исследуемого показателя к 1, тем выше приверженность больного лечению. Значение, равное 0, характеризовало полное отсутствие приверженности лечению.
Интегральный показатель комплексной оценки приверженности лечению для каждого больного представляли в виде взвешенного евклидового расстояния данного пациента до эталонного больного. В качестве эталонного был выбран виртуальный больной, у которого значения рассматриваемых показателей приверженности являлись максимальными, т.е. равными единице.
При подсчете весовых коэффициентов исследуемых показателей использовали информацию об уровнях значимости их различий в группах больных с осложнениями и без осложнений, полученных с помощью критериев Манна—Уитни и χ2 Пирсона. Данные уровни значимости были переведены в соответствующие весовые коэффициенты: w1=0,079; w2=0,272; w3=0,437; w4=0,048; w5=0,096; w6=0,014; w7=0,018; w8=0,035. Чем меньший уровень значимости имел показатель в критерии различий, тем более высоким был соответствующий ему весовой коэффициент.
На следующем этапе для каждого испытуемого рассчитывали характеристику R, определяющую его близость к эталонному больному. По совокупности составляющих приверженности лечению каждый больной был представлен точкой в восьмимерном пространстве, координатами которой являлись значения составляющих приверженности. «Эталонный» больной представлен в виде точки, координаты которой равны единице (максимальная приверженность). При этом близость рассматриваемого пациента к «эталонному» больному оценивали как взвешенное евклидово расстояние между двумя точками по формуле:

Чем выше у рассматриваемого пациента приверженность лечению, тем меньше его расстояние до «эталонного» больного [14]. Значение интегрального показателя, характеризующего приверженность пациента лечению, равно K=1-R. Значение этого показателя заключается в диапазоне [0; 1]: 0 — приверженность отсутствует, 1 — максимальная приверженность.
Гипотеза о нормальном распределение проверяли с использованием критерия Шапиро—Уилка. Для каждой из непрерывных величин, имеющих нормальное распределение, приведены среднее значение (М) и стандартное отклонение (SD). Для величин с ненормальным распределением результаты представлены в виде медианы и интерквартильного размаха — Ме (25-й процентиль; 75-й процентиль). Проверку однородности двух выборок осуществляли с использованием критериев Манна—Уитни для несвязанных выборок и Вилкоксона — для связанных. Анализ таблиц сопряженности проводили с использованием критерия Пирсона (χ2). Качественную трактовку значений интегрального показателя приверженности лечению давали на основании психофизиологической шкалы желательности Харрингтона. Для выбора факторов, влияющих на прогноз, применяли регрессионный анализ в виде бинарной логистической регрессии.
Для построения бинарной логистической модели использовали статистический пакет SPSS 17.0.
Результаты
Из 197 пациентов, включенных в исследование, в послеоперационном периоде в течение года умерли 3 (через 6, 5, 7 и 11 мес), у 3 развился ИМ, у 2 — острое нарушение мозгового кровообращения, у 10 — прогрессирующая стенокардия. Таким образом, у 18 (9%) пациентов течение послеоперационного периода было неблагоприятным.
При оценке модифицируемых факторов риска (ФР) развития сердечно-сосудистых осложнений установлено, что из 85 (43%) пациентов, куривших на момент госпитализации перед КШ, только 18 (9%) отказались от курения после операции. У 1/3 пациентов (табл. 2) перед КШ ИМТ был ≥30 кг/м2. Средний ИМТ в течение 3 мес после КШ не изменился, однако число пациентов с ожирением увеличилось на 6 (3%).
Абдоминальное ожирение, т.е. окружность талии у мужчин более 94 см, у женщин — более 80 см [12], перед КШ выявлено у 134 (68%) пациентов. После КШ число пациентов с абдоминальным ожирением увеличилось на 16 (8%), однако средняя окружность талии после КШ статистически значимо не изменилась.

Число пациентов, достигавших компенсации артериальной гипертензии (АГ), через 3 мес после КШ не изменилось: до КШ — 114 (58%), после КШ — 120 (61%; р=0,655).
Число пациентов, достигавших целевых уровней ЧСС в динамике, также достоверно не изменилось: до КШ — 108 (55%), после КШ — 122 (62%; p=0,525).
Перед КШ повышенный уровень ОХС, т.е. более 4,5 ммоль/л [12], выявлен у 150 (76%) пациентов. Через 3 мес отмечалось уменьшение числа пациентов с повышенным уровнем ОХС на 57 (29%) — со 150 (76%) до 94 (47%; р<0,001). При этом отмечено достоверное снижение уровня ОХС (с 5,57±1,36 до 4,67±1,12 ммоль/л; p<0,001) и липопротеидов низкой плотности (с 3,31±1,23 до 2,83±0,95 ммоль/л; p=0,013).
При оценке приверженности медикаментозной терапии до КШ только 79 (40%) пациентов принимали антиагреганты, β-адреноблокаторы — 73 (37%), ингибиторы ангиотензинпревращающего фермента (АПФ)/блокаторы рецепторов к ангиотензину II (БРА) — 57 (29%), статины — всего 49 (25%); при этом 8 (4%) из опрошенных пациентов затруднялись назвать принимаемые препараты. Через 3 мес после операции достоверно увеличилось число пациентов, принимавших соответствующие группы препаратов: антиагреганты — до 159 (81%), β-адреноблокаторы — до 167 (85%), ингибиторы АПФ/БРА — до 128 (65%), статины — до 153 (78%). Только 37 (19%) пациентов до КШ принимали препараты всех четырех рекомендованных групп. Через 3 мес после КШ увеличилось число пациентов, принимавших препараты всех четырех групп, в 2,5 раза — с 37 (19%) до 96 (49%; р<0,001).
При анализе различий по средней интегральной оценке приверженности лечению в группах больных после КШ с помощью критерия Манна—Уитни оказалось, что в группе пациентов без осложнений среднее значение приверженности было статистически значимо выше, чем в группе больных с осложнениями (0,465±0,216 и 0,279±0,107 соответственно; р=0,012).
После того как для каждого больного была рассчитана комплексная оценка его приверженности лечению, значение которой изменялось в пределах от 0 до 1, с помощью психофизической шкалы желательности Харрингтона была дана качественная трактовка значения интегрального показателя.
В табл. 3 представлены распределения значений интегрального показателя приверженности больных лечению по интервалам шкалы Харрингтона. Данная таблица позволила осуществить перевод значения интегрального показателя в лингвистическую шкалу, где, например значение приверженности к лечению, равное 0,38, соответствует средней приверженности, а 0,82 — очень высокой.
Анализ результатов, представленных в табл. 3, показал, что в группе больных с осложнениями статистически значимо больше больных с очень низкой приверженностью лечению (р=0,0005) и отсутствуют больные, чью приверженность можно охарактеризовать как очень высокую.
С помощью бинарной логистической регрессионной модели исследовалась прогностическая способность интегрального показателя, характеризующего комплексную приверженность лечению (табл. 4).
Сделан вывод о том, что пациенты с низкой приверженностью имеют худший прогноз, чем пациенты, соблюдающие рекомендации по терапии (p=0,018). У каждого больного по вычисленному для него значению показателя комплексной приверженности (Х) можно оценить вероятность осложнений по формуле:

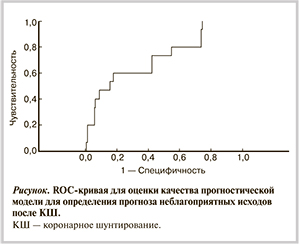
Если при подстановке в данную формулу значение приверженности больного получает величину, меньшую или равную 0,5, то для данного больного прогноз является неблагоприятным. Для улучшения качества модели и повышения процента правильной классификации, полученной по модели, был проведен ROC-анализ. Используя построенную модель, определили пороговое значение приверженности лечению, равное 0,212. При данном значении чувствительность (доля верно классифицированных больных с осложнениями) составила 0,821, а специфичность (доля верно классифицированных больных без осложнений) составила 0,6. Таким образом, при значении приверженности ниже 0,212 процент правильно классифицированных больных с осложнениями больше 80%. При значении приверженности, большей или равной 0,775, больные без осложнений классифицируются правильно на 100%. Проведенный ROC-анализ показал, что площадь под ROC-кривой равна 0,717 (см. рисунок).
Таким образом, можно сделать вывод о том, что модель, построенная на основе данного показателя, обладает хорошей прогностической способностью.
Обсуждение
 Операция КШ остается одним из основных методов реваскуляризации коронарных артерий у пациентов с ИБС [15]. Однако у пациентов, подвергшихся КШ, часто развивается рецидив ишемических осложнений, что обусловлено как атеросклеротическими изменениями шунта, так и прогрессированием ИБС в нативном русле [16]. Роль мероприятий по вторичной профилактике и контролю ФР в снижении частоты рецидивов ишемических осложнений хорошо известна и отмечена в практических рекомендациях Американской коллегии кардиологов, Американской ассоциации сердца, Европейского общества кардиологов [17, 18]. Несмотря на то что польза от мероприятий вторичной профилактики и контроля ФР у пациентов с ИБС доказана, после КШ отмечается низкая приверженность пациентов рекомендованному лечению. При этом даже больным, получающим рекомендованное лечение, часто не удавалось достичь основных целей вторичной профилактики. Об этом свидетельствуют результаты крупного (13 935 больных) международного исследования EUROASPIRE III, в котором в числе 22 европейских стран принимала участие Россия: даже у больных ИБС, перенесших ИМ и вмешательства по реваскуляризации миокарда, не достигается надлежащего контроля уровня АД, ОХС, глюкозы, физической активности [10].
Операция КШ остается одним из основных методов реваскуляризации коронарных артерий у пациентов с ИБС [15]. Однако у пациентов, подвергшихся КШ, часто развивается рецидив ишемических осложнений, что обусловлено как атеросклеротическими изменениями шунта, так и прогрессированием ИБС в нативном русле [16]. Роль мероприятий по вторичной профилактике и контролю ФР в снижении частоты рецидивов ишемических осложнений хорошо известна и отмечена в практических рекомендациях Американской коллегии кардиологов, Американской ассоциации сердца, Европейского общества кардиологов [17, 18]. Несмотря на то что польза от мероприятий вторичной профилактики и контроля ФР у пациентов с ИБС доказана, после КШ отмечается низкая приверженность пациентов рекомендованному лечению. При этом даже больным, получающим рекомендованное лечение, часто не удавалось достичь основных целей вторичной профилактики. Об этом свидетельствуют результаты крупного (13 935 больных) международного исследования EUROASPIRE III, в котором в числе 22 европейских стран принимала участие Россия: даже у больных ИБС, перенесших ИМ и вмешательства по реваскуляризации миокарда, не достигается надлежащего контроля уровня АД, ОХС, глюкозы, физической активности [10].
Курение, как известно, ускоряет процесс коронарного атеросклероза и формирование новых атеросклеротических бляшек. Эффекты отказа от курения в отношении оптимизации прогноза после КШ продемонстрированы в ряде исследований. F.W. van den Berkmortel и соавт. [19] показали, что при отказе от курения после КШ снижается частота развития рецидивов стенокардии, уменьшается число последующих госпитализаций, увеличивается выживаемость больных.
Высокая ЧСС покоя в настоящее время рассматривается не только как маркер тяжести состояния и неблагоприятного прогноза при ИБС, но и как важная терапевтическая мишень, воздействие на которую ассоциировано с улучшением клинического течения стенокардии и отдаленных исходов ИБС.
Согласно рекомендациям Американской коллегии кардиологов/Американской ассоциации сердца и Российского общества кардиологов по лечению стабильной стенокардии, при данном заболевании рекомендовано титрование дозы β-адреноблокаторов до достижения целевой ЧСС в покое 55—60 уд/мин [12, 20]. Однако в реальной клинической практике эти рекомендации не всегда удается выполнить.
По результатам нашего исследования оказалось, что пациенты, подвергшиеся КШ, не мотивированы на проведение немедикаментозной вторичной профилактики. Так, при оценке модифицируемых ФР развития ССЗ установлено, что около 50% пациентов курили до КШ, и только единицы отказались от курения после операции. Число пациентов с абдоминальным ожирением до КШ оказалось крайне высоким и составило 68%, а через 3 мес после операции их число даже увеличилось на 8%. Число пациентов, достигавших компенсации АГ после КШ, также значимо не увеличилось (с 58 до 61%; р=0,665). При этом число пациентов с повышенным уровнем ОХС через 3 мес после КШ уменьшилось почти на 30%. Однако его целевых средних значений достигнуто не было.
У обследованных пациентов до хирургического вмешательства выявлена крайне низкая приверженность медикаментозной терапии. Менее 50% пациентов принимали антиагреганты, β-адреноблокаторы, ингибиторы АПФ/БРА, а статины — всего 25%. Данные показатели значительно уступают результатам исследования EUROASPIRE III [10]. Через год после КШ отмечается достоверное увеличение числа пациентов, принимавших препараты соответствующих групп. Однако и эти показатели по-прежнему уступают результатам исследования EUROASPIRE III [10].
Так, по данным этого исследования, антиагреганты принимали 93% пациентов с ИБС, ингибиторы АПФ /БРА — 75%, гиполипидемические препараты — 87%.
Для оценки приверженности больного лечению в нашем исследовании использовался интегральный показатель, характеризующий комплексную оценку приверженности, который включает показатель, оценка которого производилась по методике Давыдова, достижение уровня ЧСС, достижение целевого уровня ОХС, четырехкомпонентный прием препаратов, регулярность приема лекарственных средств, компенсацию АГ, отказ от курения и изменение ИМТ. При оценке различий по средним значениям интегрального показателя приверженности лечению в группах больных с осложнениями и без них оказалось, что в группе пациентов без осложнений среднее значение приверженности статистически значимо выше, чем в группе больных с осложнениями (p=0,012).
При переводе значения интегрального показателя в лингвистическую шкалу оказалось, что в группе больных с осложнениями статистически значимо больше лиц с очень низкой приверженностью лечению (р=0,0005) и отсутствовали больные, чью приверженность можно охарактеризовать как очень высокую.
По данным бинарного логистического регрессионного анализа сделан вывод о том, что пациенты с низкой приверженностью имеют худший прогноз, чем пациенты, соблюдающие рекомендации по терапии (p=0,018). Проведенный ROC-анализ показал, что качество прогностической модели для определения неблагоприятного прогноза у больных, перенесших КШ, обладает хорошей прогностической способностью.
Заключение
Результаты исследования продемонстрировали, что чем выше приверженность больных рекомендованной терапии в течение года после коронарного шунтирования, тем лучше прогноз, что подчеркивает необходимость совершенствования вторичной профилактики после хирургического вмешательства.



