Тромбоэмболия легочной артерии (ТЭЛА) является третьей по частоте причиной смерти в экономически высокоразвитых странах, уступая только сердечно-сосудистым заболеваниям и злокачественным новообразованиям [1].
Тяжелым прогностически неблагоприятным осложнением хронической ТЭЛА является хроническая постэмболическая легочная гипертензия (ХПЭЛГ). Наряду с высоким систолическим давлением в правом желудочке (ПЖ) при ХПЭЛГ наблюдается высокое сопротивление сосудов малого круга кровообращения (МКК). При длительном течении заболевания легочно-артериальное русло превращается в систему не просто «фиксированного», а постоянно увеличивающегося сопротивления, поддержание эффективного кровотока в которой становится возможным только путем генерации все более и более высокого давления [2—4].
Вторичные морфофункциональные изменения сосудов МКК формируют нарушения вентиляционно-перфузионных отношений (ВПО), что приводит к развитию дыхательной недостаточности и артериальной гипоксемии [5].
Авторами изучались структурно-функциональные изменения камер сердца, внутрисердечная гемодинамика, показатели степени легочной гипертензии и респираторные нарушения на фоне хронической ТЭЛА [6, 7].
После хирургического лечения хронической ТЭЛА исследовались перфузия легких, показатели степени легочной гипертензии и оценивалась динамика ремоделирования сердца [8, 9].
Динамика функции внешнего дыхания (ФВД) с оценкой потребления кислорода на фоне структурно-функциональных изменений камер сердца после хирургического лечения больных с хронической ТЭЛА служит важным показателем степени восстановления эффективности легочной вентиляции и определяет качество жизни и дальнейшую тактику ведения данных пациентов. Этот вопрос нуждается в детальном изучении, поскольку в литературе практически нет данных по этой проблеме.
Целью настоящего исследования явилась оценка эффективности легочной вентиляции в отдаленные сроки после хирургического лечения у больных с хронической ТЭЛА.
Материал и методы
В исследование были включены 29 пациентов в возрасте 49 (38—60) лет с диагнозом хроническая ТЭЛА, ХПЭЛГ. Среди них 21 (72%) мужчина и 8 (27%) женщин. Средняя длительность заболевания составила 2,0 (1,3; 3,3) года. По классификации Нью-Йоркской ассоциации сердца 78% пациентов отнесены к III функциональному классу (ФК) хронической сердечной недостаточности, 22% — к IV ФК. У всех пациентов в анамнезе был тромбоз глубоких вен нижних конечностей. Хирургическое лечение выполнялось в условиях искусственного кровообращения и глубокой гипотермии с применением остановки кровообращения во время тромбэндартерэктомии (ТЭЭ) из ветвей легочной артерии (ЛА).
Из исследования были исключены пациенты с бронхиальной астмой, а также с любыми острыми и хроническими заболеваниями бронхолегочной системы, неопластическими заболеваниями легких и сахарным диабетом.
До операции и в отдаленные сроки (спустя 12 мес) после хирургического лечения всем пациентам проводилось клинико-инструментальное обследование. Объем поражения легочного русла, состояние легочной перфузии определяли при проведении ангиопульмонографии с регистрацией уровня давления в ЛА, сопротивления сосудов МКК. Локализация тромбов имела проксимальный характер.
Анатомо-функциональные параметры правых и левых отделов сердца регистрировали методом трансторакальной эхокардиографии (ЭхоКГ) по стандартной методике [10]. Для анализа использовали следующие данные: конечный диастолический размер (КДР, см), конечный диастолический объем (КДО, мл), фракцию выброса (ФВ, %) ПЖ и левого желудочка (ЛЖ). С помощью модифицированного уравнения Бернулли с использованием пиковой скорости струи трикуспидальной регургитации рассчитывали систолическое давление в ЛА [11].
Исследование ФВД проводили в утренние часы натощак после 15–20-минутного отдыха на компьютерном бодиплетизмографе Master Screen Body (Германия). Метод бодиплетизмографии позволяет провести более точную дифференциальную диагностику обструктивных и рестриктивных изменений в бронхолегочной системе посредством анализа структуры статических объемов и эластических свойств легких. Исследование проводили в соответствии с критериями Американского торакального общества [12]. Окончательному анализу подвергали следующие показатели: сопротивление бронхов (СБ); остаточный объем легких (ООЛ); общая емкость легких (ОЕЛ); жизненная емкость легких (ЖЕЛ) на вдохе, максимальное количество воздуха, которое можно вдохнуть после полного глубокого выдоха; форсированная жизненная емкость легких (ФЖЕЛ), изменение объема легких в результате максимально интенсивного быстрого форсированного выдоха, выполняемого после полного глубокого вдоха; объем форсированного выдоха за 1-ю секунду (ОФВ1), т.е. та часть ЖЕЛ, которая выдыхается за 1-ю секунду после начала форсированного выдоха; максимальная объемная скорость в момент выдоха 25% ФЖЕЛ (МОС25); максимальная объемная скорость в момент выдоха 50% ФЖЕЛ (МОС50); максимальная объемная скорость в момент выдоха 75% ФЖЕЛ (МОС75). Анализировали минутный объем дыхания (МОД, л/мин), характеризующий легочную вентиляцию, — количество воздуха, вентилируемого в легких за 1 мин (произведение частоты дыхания на дыхательный объем). Фиксировали как абсолютные значения перечисленных показателей, выраженные в литрах или в литрах в секунду для потоковых показателей, так и фактические значения показателей, выраженные в процентах от норматива для соответствующего возраста, роста и пола. С помощью газоанализатора на приборе Oxycon Pro (Германия) регистрировали потребление кислорода в покое и оценивали эффективность легочного газообмена — коэффициент использования кислорода (КИО2, мл/л) — отношение поглощенного О2 (мл/мин) к МОД (л/мин).

С помощью пульсоксиметра BCI 3304 Oximeter («Smiths medical», Объединенное Королевство) измеряли артериальную оксигенацию (%).
Статистический анализ полученных данных проведен с использованием пакета статистических программ Statistica 6.1 (США). Данные представлены в виде медианы (Me) и межквартильного размаха (25-й процентиль; 75-й процентиль). Взаимосвязь параметров оценивали с использованием коэффициента ранговой корреляции Спирмена. Статистически значимыми принимали значения при p<0,05.
Результаты
До хирургического лечения у больных хронической ТЭЛА по данным ангиопульмонографии выявлено значительное увеличение сосудистого сопротивления в МКК — 635 (400; 1142) дин·с·см–5. Систолическое давление в ЛА составило 82 (60; 92) мм рт.ст.
Увеличение давления в полости ПЖ на фоне хронического препятствия оттоку из его полости приводит к развитию гипертрофии миокарда. Вследствие истощения компенсаторных механизмов на фоне прогрессирующей гипертензии МКК увеличиваются размеры ПЖ и снижается его сократительная способность (табл. 1). Сократительная способность миокарда ЛЖ у данных пациентов была в пределах нормы.
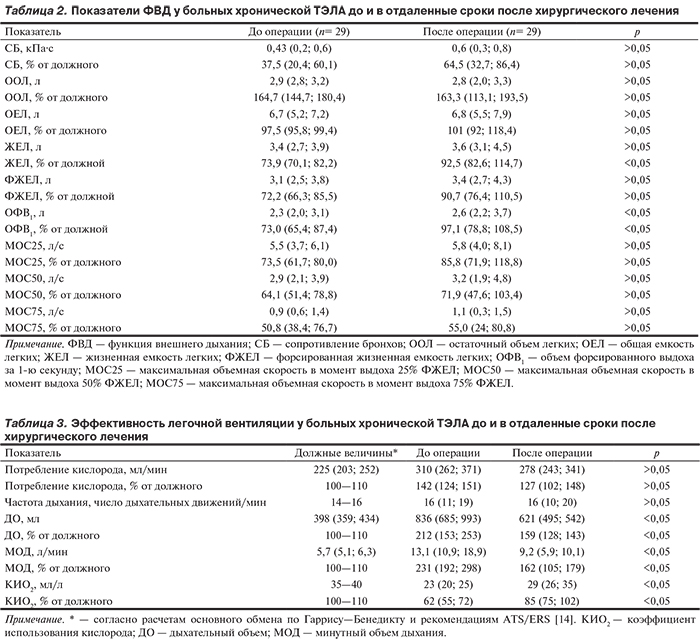
При анализе данных бодиплетизмографии до хирургического лечения у больных хронической ТЭЛА отмечено умеренное снижение ЖЕЛ (в среднем на 26% от нормы). Кроме того, выявлено умеренное снижение всех показателей, отвечающих за проходимость воздухоносных путей: ОФВ1 и ФЖЕЛ — на 27% от нормы; показатели проходимости по крупным, средним и мелким бронхам (МОС25, МОС50, МОС75) были снижены на 26, 36 и 50% соответственно. На фоне снижения проходимости бронхов на выдохе происходит увеличение ООЛ, что может указывать на наличие невентилируемых, но наполненных воздухом участков легких — эмфизематозных «воздушных ловушек», приводящих к снижению полезного объема легких (табл. 2).
В нашем исследовании артериальная оксигенация у больных хронической ТЭЛА была снижена и составила 92 (91; 95)%.
При этом отмечено компенсаторное увеличение потребления кислорода (табл. 3).
Через рефлекторную активацию дыхательного центра увеличивается МОД преимущественно за счет увеличения дыхательного объема (ДО). Компенсаторный рост вентиляции не приводит к существенному улучшению оксигенации в участках легких с нормальным ВПО, так как оттекающая оттуда кровь конечных легочных капилляров уже максимально насыщена кислородом. При этом по мере нарастания гипервентиляции увеличение потребления кислорода изменяется в меньшей степени, в результате чего происходит снижение эффективности вентиляции легких — КИО2.
Таким образом, у больных с хронической ТЭЛА на фоне структурно-функциональной перестройки сердца и сосудов МКК развиваются нарушения ФВД, включающие снижение ЖЕЛ, проходимости бронхов, что в совокупности с изменением ВПО приводит к снижению эффективности вентиляции легких.
В отдаленном периоде после операции у больных с хронической ТЭЛА по данным ангиопульмонографии отмечалось статистически значимое снижение сосудистого сопротивления в МКК и систолического давления в ЛА (p<0,05), что составило 240,7 (152; 387,5) дин·с·см–5 и 41,5 (29; 46) мм рт.ст. соответственно. По данным ЭхоКГ регистрировались статистически значимое снижение КДО ПЖ и увеличение ФВ ПЖ (см. табл. 1). По данным бодиплетизмографии выявлено статистически значимое увеличение ЖЕЛ в процентах от нормы, а также отмечено увеличение ОФВ1 как в абсолютных значениях, так и в процентах от нормы (p<0,05) (см. табл. 2). При этом сохранялось умеренное снижение показателей максимальной объемной скорости в момент выдоха (МОС25, МОС50, МОС75) (p>0,05).
В отдаленном периоде после хирургического лечения у больных хронической ТЭЛА отмечено статистически значимое увеличение КИО2 (см. табл. 3). Повышение эффективности вентиляции легких обусловлено достоверным снижением гипервентиляции на фоне положительных изменений гемодинамических показателей МКК и улучшения параметров внутрисердечной гемодинамики. Артериальная оксигенация после хирургического лечения статистически значимо увеличилась до 96 (95; 98)%. Несмотря на положительную динамику перечисленных параметров, в отдаленные сроки после ТЭЭ из ЛА показатель КИО2 все еще остается ниже нормы, а также сохраняется увеличенный МОД с повышением потребления кислорода по сравнению с нормой.
При корреляционном анализе было выявлено, что у больных с хронической ТЭЛА и увеличением длительности заболевания происходит снижение дооперационных абсолютных показателей, отвечающих за проходимость воздухоносных путей — ОФВ1 (r=–0,52; p<0,05) и ФЖЕЛ (r=–0,28; p<0,05), после хирургического лечения данные корреляции исчезали. Увеличение сопротивления сосудов МКК также обратно взаимосвязано с ОФВ1 и ФЖЕЛ, выраженных в процентах от нормы (r=–0,40; p<0,05) и (r=–0,42; p<0,05) соответственно.
Выявлена обратная взаимосвязь между дооперационными данными КДО ПЖ и показателями проходимости бронхов: МОС50 в процентах от нормы (r=–0,40; p<0,05) и МОС75 в процентах от нормы (r=–0,37; p<0,05). ФВ ПЖ обратно взаимосвязана с ДО в процентах от нормы (r=–0,35; p<0,05), а также МОД в абсолютных значениях и в процентах от нормы (r=–0,41; p<0,05) и (r=–0,43; p<0,05) соответственно. КДО ПЖ прямо коррелировал с ДО в абсолютных значениях и в процентах от нормы (r=0,38; p<0,05), а также с МОД в абсолютных значениях и в процентах от нормы (r=0,43; p<0,05) и (r=0,40; p<0,05) соответственно.
С увеличением возраста у больных с хронической ТЭЛА до хирургического лечения снижается абсолютный показатель максимальной объемной скорости в момент выдоха по мелким бронхам — МОС75 (r=–0,34; p<0,05).
В отдаленный период после операции возрастной фактор обратно взаимосвязан со следующими показателями бронхиальной проходимости: абсолютными значениями МОС50 (r=–0,59; p<0,05), абсолютными значениями МОС75 (r=–0,64; p<0,05), МОС75 в процентах от нормы (r=–0,54; p<0,05). Таким образом, с увеличением возраста больных хронической ТЭЛА в отдаленный послеоперационный период снижаются резервные возможности ФВД.
Обсуждение
В результате ТЭЛА появляется «мертвое пространство» — участок неперфузируемой, но вентилируемой легочной ткани, происходит спадение респираторных отделов легкого, в зоне поражения развивается бронхообструкция. Одновременно снижается выработка альвеолярного сурфактанта, что также способствует развитию ателектаза пораженного участка легкого [15, 16]. В нашем исследовании изменения бронхоальвеолярного звена отражаются в снижении ЖЕЛ и показателей проходимости воздухоносных путей — ОФВ1, ФЖЕЛ, МОС25, МОС50, МОС75. При этом степень снижения проходимости бронхов прямо взаимосвязана с длительностью основного заболевания и КДО ПЖ. Хроническая гипертензия легочных сосудов формирует склеротические изменения легочной ткани, что приводит к значительному снижению ее эластичности [17]. В нашем исследовании снижение проходимости бронхов и эластической отдачи выражается в увеличении ООЛ, что указывает на развитие эмфизематозных изменений в легких.
Некоторыми исследователями отмечено [18 ], что в результате ТЭЛА нередко возникает тахипноэ, связанное с тем, что при альвеолярно-интерстициальном отеке происходит стимуляция юкстакапиллярных рецепторов в альвеолярно-капиллярной мембране. Это приводит к повышению вагусной афферентной активности с последующей стимуляцией респираторных нейронов продолговатого мозга, в результате чего возникает гипервентиляция. Усилению гипервентиляции способствует нарушение функционирования бронхоальвеолярного звена на фоне гипоперфузии [18].
По нашим данным, у пациентов с хронической ТЭЛА в ответ на гипоксию зафиксировано увеличение МОД (более чем в 2 раза от нормы), но не за счет увеличения частоты дыхания, а преимущественно за счет повышения ДО. Данный механизм адаптации к гипоксии наиболее оправдан с физиологической позиции. Увеличение МОД при гипоксии достигается вначале за счет повышения ДО, так как это способствует уменьшению шунтирования крови справа налево и улучшению центральной гемодинамики. При увеличении ДО, как правило, повышается потребление кислорода. Такой механизм обеспечения необходимого уровня вентиляции легких для организма является менее энергозатратным [19]. В нашем исследовании, несмотря на компенсаторное увеличение потребления кислорода (в среднем на 42% по сравнению с нормой), происходит снижение КИО2 на фоне значительного увеличения МОД. Таким образом, данный механизм не обеспечивает полностью метаболические потребности организма в кислороде. По данным корреляционного анализа, нарастание гипервентиляции происходит по мере снижения сократительной способности и увеличения дилатации ПЖ.
В результате снижения эффективности вентиляции альвеол и шунтирования крови из артериол в вены формируется артериальная гипоксемия [16]. Артериальная оксигенация у обследованных нами больных была в пределах 92%.
Улучшить качество жизни, как и ее продолжительность, у больных хронической ТЭЛА возможно с помощью операции ТЭЭ из ветвей ЛА [11, 20]. После выполнения хирургической дезоблитерации легочных ветвей происходят снижение давления в ЛА, нормализация внутрисердечной гемодинамики, что ведет к уменьшению или исчезновению клинических проявлений правожелудочковой сердечной недостаточности [11]. В нашем исследовании в отдаленный период после хирургического лечения на фоне положительной динамики легочной перфузии и структурно-функциональных параметров ПЖ зафиксировано увеличение ЖЕЛ и ОФВ1. При этом показатели проходимости бронхов — МОС25, МОС50, МОС75 – оставались сниженными. По результатам нашего исследования, нарушение проходимости бронхов периферических бронхов (МОС50, МОС75) в отдаленный период после операции было прямо взаимосвязано с возрастом пациентов. При старении происходит ограничение адаптационно-приспособительных реакций ФВД. Чаще всего это выражается в снижении проходимости мелких бронхов за счет увеличения сопротивления бронхиального дерева [21].
По нашим данным, улучшение легочной перфузии после ТЭЭ способствовало уменьшению напряжения механизмов адаптации к гипоксии в виде снижения МОД. Снижение гипервентиляции с сохраняющимся увеличенным потреблением кислорода сопровождалось повышением КИО2 по сравнению с дооперационными данными на 26%. При этом следует отметить, что гипервентиляция после операции все еще сохранялась, и КИО2 оставался ниже нормальных значений. Таким образом, в отдаленный период после операции эффективность легочной вентиляции у данных пациентов сохранялась ниже нормы, но имела положительную динамику.
Заключение
У больных с хронической тромбоэмболией легочной артерии и увеличением длительности основного заболевания, нарастанием хронической постэмболической легочной гипертензии и недостаточности правого желудочка происходит снижение исходных резервных возможностей респираторной системы в виде снижения жизненной емкости легких и проходимости бронхов.
Механизмом адаптации к гипоксии у пациентов с хронической тромбоэмболией легочной артерии и хронической постэмболической легочной гипертензией служат возрастание минутного объема дыхания (за счет дыхательного объема) и увеличение потребления кислорода, что является наиболее физиологичным для поддержания оптимального газообмена в альвеолах с сохраненной перфузией. При этом напряжение адаптационного механизма в виде значительного возрастания гипервентиляции по мере прогрессирования недостаточности правого желудочка у данных больных приводит к снижению эффективности легочной вентиляции.
В отдаленный период после тромбэндартерэктомии у больных с хронической тромбоэмболией легочной артерии происходит увеличение жизненной емкости легких и объема форсированного выдоха за 1-ю минуту, при этом проходимость бронхов остается сниженной.
Эффективность легочной вентиляции в отдаленный послеоперационный период у данных пациентов увеличивается на 26% от исходной (за счет снижения гипервентиляции), но остается ниже нормы.
У больных с хронической тромбоэмболией легочной артерии необходимо учитывать возрастной фактор и длительность заболевания, оказывающие непосредственное влияние на исходную проходимость бронхов, а также на восстановление резервных возможностей респираторной системы в отдаленный период после хирургического лечения.



