Атеросклеротическое поражение сосудов, являющееся осложнением ревматоидного артрита (РА) [1], с высокой частотой выявляется при данном заболевании и во многом определяет его прогноз [1—5]. Кальцификация коронарных артерий (КА) коррелирует с выраженностью атеросклеротического поражения [6—8]. Однако до последнего времени отсутствуют данные о взаимосвязи коронарного кальциноза с показателями липидного состава крови при РА.
Цель настоящего исследования: выявить особенности показателей липидного состава крови у женщин с РА в зависимости от кальцификации КА.
Материал и методы
В исследование включены 62 женщины: 40 с диагнозом РА, установленным в соответствии с критериями Американской коллегии ревматологов (1987) и Европейской лиги ревматологов (2010) [1], и 22 здоровые женщины (контрольная группа).
 Критериями включения больных в исследование являлись женский пол, возраст 35—70 лет, согласие на участие в исследовании, отсутствие психических заболеваний и ментальных расстройств, затрудняющих контакт. Критерии исключения: наличие других хронических заболеваний с функциональной недостаточностью суставов II—III степени, аллергическая реакция на препараты йода, постоянная форма фибрилляции предсердий и другие нарушения ритма, препятствующие качественной синхронизации с электрокардиограммой при выполнении мультиспиральной компьютерной томографии.
Критериями включения больных в исследование являлись женский пол, возраст 35—70 лет, согласие на участие в исследовании, отсутствие психических заболеваний и ментальных расстройств, затрудняющих контакт. Критерии исключения: наличие других хронических заболеваний с функциональной недостаточностью суставов II—III степени, аллергическая реакция на препараты йода, постоянная форма фибрилляции предсердий и другие нарушения ритма, препятствующие качественной синхронизации с электрокардиограммой при выполнении мультиспиральной компьютерной томографии.
Средний возраст пациенток, страдающих РА, составил 48,6±1,4 года, средняя продолжительность РА — 7,77±1,0 года. Средний возраст лиц контрольной группы — 47,3±1,7 года (р=0,632). Женщины контрольной группы не отличались от пациенток с РА по частоте и длительности менопаузы, антропометрическим характеристикам (р=0,2 и р=0,859 соответственно). В постменопаузе находилась 21 (52,5%) обследованная женщина. У большинства диагностирован серопозитивный вариант РА (n=36; 90%). Преобладала III степень активности РА (n=26; 65%), у 14 (35%) больных установлена II степень. Ранняя клиническая стадия заболевания диагностирована у 6 (15%) пациенток, развернутая — у 26 (65%), поздняя — у 8 (20%). У 18 (45%) больных имелся эрозивный РА. У 13 (32,5%) женщин установлена I рентгенологическая стадия РА, II стадия — у 20 (50%), III стадия — у 5 (12,5%), IV — у 2 (5%). Системные проявления РА выявлены у 14 (35%) больных, в основном в виде ревматоидных узелков, уплотнения листков перикарда, синдрома Шегрена. У 25 (62,5%) пациенток имелась II степень функциональной недостаточности суставов.
Все больные РА (100%) получали метотрексат и нестероидные противовоспалительные препараты.
Общеклиническое обследование включало определение числа болезненных суставов и числа припухших суставов, интенсивности болевого синдрома по визуальной аналоговой шкале. Активность ревматоидного воспаления устанавливали по интегрированному показателю Disease Activity Score (DAS28). Функциональную недостаточность опорно-двигательного аппарата оценивали по классификации РА (2007) [1].
 Всем обследованным проводили комплексное лабораторно-инструментальное обследование согласно протоколам ведения больных с РА. Лабораторное обследование включало определение ревматоидного фактора (РФ) методом иммуноферментного анализа, количественное определение С-реактивного белка. Исследование липидемии проводили ферментативным методом; оно включало определение содержания общего холестерина (ОХС), триглицеридов (ТГ), холестерина (ХС) липопротеинов высокой плотности (ХС ЛВП) в сыворотке крови с использованием реагентов фирмы «Labsystems» А/О 95/419 (Финляндия). Концентрацию холестерина липопротеинов низкой плотности (ХС ЛНП) и очень низкой плотности (ХС ЛОНП) вычисляли по формуле Фридвальда (1972). Индекс атерогенности (ИА) рассчитывали по формуле А.Н. Климова [9]. Уровни ХС липопротеинов невысокой плотности (ХС не-ЛВП) рассчитывали по формуле: ОХС – ХС ЛВП [10]. Липопротеины низкой плотности (β-ЛП) определяли турбидиметрическим методом по Бурштейну и Самай. Показатели липидного обмена оценивали в соответствии с Европейскими кардиологическими рекомендациями [9] и рекомендациями Европейской лиги ревматологов [1, 2].
Всем обследованным проводили комплексное лабораторно-инструментальное обследование согласно протоколам ведения больных с РА. Лабораторное обследование включало определение ревматоидного фактора (РФ) методом иммуноферментного анализа, количественное определение С-реактивного белка. Исследование липидемии проводили ферментативным методом; оно включало определение содержания общего холестерина (ОХС), триглицеридов (ТГ), холестерина (ХС) липопротеинов высокой плотности (ХС ЛВП) в сыворотке крови с использованием реагентов фирмы «Labsystems» А/О 95/419 (Финляндия). Концентрацию холестерина липопротеинов низкой плотности (ХС ЛНП) и очень низкой плотности (ХС ЛОНП) вычисляли по формуле Фридвальда (1972). Индекс атерогенности (ИА) рассчитывали по формуле А.Н. Климова [9]. Уровни ХС липопротеинов невысокой плотности (ХС не-ЛВП) рассчитывали по формуле: ОХС – ХС ЛВП [10]. Липопротеины низкой плотности (β-ЛП) определяли турбидиметрическим методом по Бурштейну и Самай. Показатели липидного обмена оценивали в соответствии с Европейскими кардиологическими рекомендациями [9] и рекомендациями Европейской лиги ревматологов [1, 2].
Исследование КА проводили на 64-спиральном компьютерном томографе LightSpeed VCT. Сканирование зоны от аортального синуса до верхушки сердца выполняли в пошаговом режиме с проспективной кардиосинхронизацией для определения коронарного кальция. Подсчет коронарного кальция проводили автоматическим методом с использованием программы SmartScore и определением кальциевого индекса по шкале Агатстона [11].
Дизайн исследования соответствовал одномоментному поперечному. Работа выполнена в соответствии с Хельсинкской декларацией и одобрена Этическим комитетом ГБОУ ВПО ЧелГМА Минздрава России.
Статистическая обработка данных проведена с использованием лицензионного пакета прикладных компьютерных программ SPSS 17.0. Количественные и порядковые данные представлены в виде средней арифметической величины и ее ошибки (M±m). Межгрупповые различия оценивали с помощью U-критерия Манна—Уитни. Качественные данные представлены абсолютным и относительным числом больных (абс., %). Для оценки межгрупповых различий качественных показателей применяли критерий χ2 Пирсона и точный критерий Фишера. Связи переменных анализировали с помощью расчета коэффициентов корреляции по Спирмену (rs). Рассчитывали отношение шансов (ОШ) и его 95% доверительный интервал (ДИ). Различия считали статистически значимыми при р< 0,05.
Результаты
В группе РА установлена статистически незначимо более высокая частота кальцификации КА, чем в группе здоровых женщин (35 и 18% соответственно; р=0,163). Индекс Агатстона у больных РА варьировал от 1 до 99 ед. (25±7 ед.) и существенно не отличался от степени кальцификации КА в контрольной группе (20,5±12,3 ед.; р=0,734).
В исследуемых группах больных РА с различным состоянием КА не выявлено статистически значимых различий по возрасту (р=0,072), основным классификационным характеристикам РА (р=0,159—1,0), и противоревматической терапии (р=0,387—1,0). В то же время у всех больных с кальцинозом КА имелся серопозитивный по РФ вариант РА. В группе лиц без кальцификации КА частота выявления серопозитивного РА составила 84,6% (р=0,122). Обнаружена тенденция к большей частоте высокой степени активности ревматоидного воспаления у женщин с кальцинозом КА (78,6%), чем у больных без кальциноза (57,7%; р=0,187).
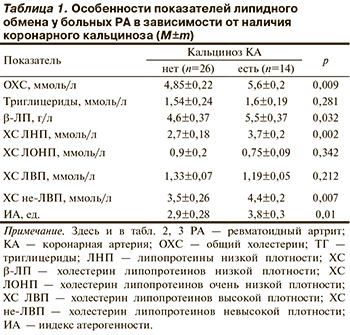
У больных с кальцинозом КА выявлены статистически значимо более высокие уровни ОХС, ХС ЛНП, ХС не-ЛВП, β-ЛП и ИА (табл. 1). Уровень ХС ЛВП у лиц с кальцификацией КА, напротив, имел тенденцию к снижению (р=0,212).

Корреляционный анализ также установил статистически значимую связь уровня ОХС и его атерогенных фракций с наличием и степенью кальциноза КА (табл. 2).
Значение атерогенных изменений липидного состава крови в процессах кальцификации КА артерий при РА подтверждает более высокая частота отклонений параметров липидного состава крови при коронарном кальцинозе (табл. 3). Ключевую роль при этом играют отрезные значения уровней липидемии, установленные для пациентов с РА. У женщин с кальцинозом КА в 100% случаев выявлено повышение уровня ХС ЛНП >2,5 ммоль/л, являющегося пограничным для больных РА.
У пациентов с кальцинозом КА статистически значимо чаще имелось повышение уровня ХС не-ЛВП>3,8 ммоль/л. Число таких пациентов в нашей когорте совпадало с числом лиц с повышением уровня ХС не-ЛВП >3,6 ммоль/л, рассчитанного для женщин с РА. При этом риск кальцификации КА был выше у лиц с повышенным уровнем ХС не-ЛВП (ОШ 5,9 при 95% ДИ от 1,3 до 26).
В проведенных ранее исследованиях продемонстрирована роль липидемических нарушений в атерогенезе при РА [12, 13]. В представленной же нами работе показано также наличие взаимосвязи между атерогенными дислипидемическими нарушениями и кальцификацией КА у женщин с РА. Обращает внимание, что роль дислипидемии в развитии коронарного кальциноза показана при более строгих уровнях липопротеинов, установленных для больных РА; это подчеркивает необходимость оценки их значений в соответствии с рекомендациями Европейской лиги ревматологов и ассоциации ревматологов России [1, 2].
Выводы
Все женщины с ревматоидным артритом, осложненным коронарным кальцинозом, имели дислипидемические нарушения, проявляющиеся более высокими уровнями общего холестерина, его атерогенных фракций, β-липопротеинов в сравнении с группой без кальцификации КА.
У всех больных с кальцификацией КА имелось повышение уровня холестерина липопротеинов низкой плотности более 2,5 ммоль/л.



