Качество управления сахарным диабетом 2-го типа (СД 2-го типа) не ограничивается только достижением хорошего гликемического контроля, но и зависит от успешной терапии фоновых заболеваний — висцерального ожирения и сердечно-сосудистых заболеваний (ССЗ). Фатальные сердечно-сосудистые осложнения являются основной причиной смерти пациентов с СД 2-го типа [1]. В настоящее время выявлена патогенетическая связь между ожирением, ССЗ, нарушением углеводного обмена. Установлен вклад измененной секреции глюкагоноподобного пептида-1 (ГПП-1) в развитие каскада опасных метаболических нарушений. Включение в схему сахароснижающей терапии агонистов рецепторов ГПП-1 позволяет повысить концентрацию ГПП-1 до надфизиологической, обусловливая тем самым наряду с гликемическим эффектом положительное влияние на динамику негликемических параметров и снижение риска развития ССЗ.
Инкретиновый гормон ГПП-1 усиливает физиологический глюкозозависимый инкретиновый эффект, заключающийся в повышении секреции инсулина β-клетками поджелудочной железы в ответ на пероральную углеводную нагрузку, и восстанавливает двухфазную секрецию инсулина. У здоровых лиц инкретиновый эффект обеспечивает 70% секретируемого инсулина. Кроме того, ГПП-1 является метаболическим сигналом для глюкозозависимой супрессии глюкагона α-клетками, замедления опорожнения желудка, подавления аппетита (обеспечивая по механизму центральной связи чувство насыщения), улучшения энергетического обмена. Большинство метаболических эффектов агонистов ГПП-1 способствует снижению массы тела. Следует отметить, что уменьшение риска развития ССЗ при использовании агонистов ГПП-1 превышает опосредованное лишь снижением массы тела.
Установлено, что рецепторы ГПП-1 расположены не только в β- и α-клетках поджелудочной железы, но также в печени, сердце, головном мозге, почках. В сердце рецепторы ГПП-1 имеются в кардиомиоцитах, миоцитах коронарных сосудов, эндокарде, эндотелии микрососудов, что и определяет кардиопротективный эффект агонистов ГПП-1 [2].
Показано, что агонисты ГПП-1 проявляют эффект как при связывании с соответствующими рецепторами (прямое действие), так и посредством нерецепторных путей (непрямое действие). Установлено, что агонисты ГПП-1 одновременно могут влиять на несколько факторов риска (ФР) развития ССЗ (коррекцию массы тела и липидного состава крови, уменьшение депо висцерального жира, снижение уровня артериального давления (АД) и концентрации биомаркеров повреждения миокарда — провоспалительных цитокинов и адипокинов). Кроме того, отмечено положительное влияние на миокард не только активной формы ГПП-1(7—39), но и его неактивной формы ГПП-1(9—31), которая образуется при гидролитическом расщеплении под действием фермента дипептидилпептидазы-4. Таким образом, действие агонистов ГПП-1 характеризуется плейотропными эффектами.
 Наиболее широко используемыми в клинической практике представителями класса агонистов ГПП-1 являются инкретиномиметик эксенатид и аналог ГПП-1 человека лираглутид. Способ введения препаратов — подкожный. В первых рандомизированных клинических исследованиях (РКИ) наряду с качеством гликемического контроля оценивались в рамках статистики нежелательных явлений и сердечно-сосудистые исходы. Однако в последующих РКИ пациенты с различными ССЗ составляли уже интервенционную группу.
Наиболее широко используемыми в клинической практике представителями класса агонистов ГПП-1 являются инкретиномиметик эксенатид и аналог ГПП-1 человека лираглутид. Способ введения препаратов — подкожный. В первых рандомизированных клинических исследованиях (РКИ) наряду с качеством гликемического контроля оценивались в рамках статистики нежелательных явлений и сердечно-сосудистые исходы. Однако в последующих РКИ пациенты с различными ССЗ составляли уже интервенционную группу.
Основным негликемическим эффектом агонистов ГПП-1 является долгосрочное снижение массы тела, выраженное настолько, что позволяет успешно использовать данные препараты в терапии ожирения без нарушения углеводного обмена. Установлено, что снижение массы тела закономерно определяет и снижение уровня ФР развития ССЗ — АД, биомаркеров воспаления и проагрегантной системы, улучшение липидного состава крови [3]. Так, в наблюдательном исследовании, проведенном в первичном звене эндокринологической помощи Великобритании, отмечено снижение массы тела на 4,5 кг за 12-месячный период у лиц, использующих агонисты ГПП-1 [4].
Необходимо отметить, что введение агонистов ГПП-1 способствует снижению объема депо висцерального жира. Согласно исследованию LEAD-2 снижение массы тела на фоне введения лираглутида сопровождается уменьшением количества как общего жира, так и его абдоминального депо, уменьшением окружности талии и процентного содержания висцерального жира (данные DEXA — двухэнергетической рентгеновской абсорбциометрии) [5].
Положительное влияние на дислипидемию опосредовано комплексным влиянием ГПП-1 на несколько звеньев патогенеза и устранением постпрандиальной дислипидемии. Так, через год от начала терапии эксенатидом постпрандиальный уровень триглицеридов, аполипопротеина-В48 и холестерина в составе липопротеинов очень низкой плотности снижается в большей степени, чем при альтернативном применении инсулина гларгин [6]. В исследовании LEAD-1 продемонстрировано снижение триглицеридемии при использовании комбинированной терапии лираглутидом (1,2 и 1,8 мг/сут) и глимепиридом и ее повышение в группе пациентов, получавших росиглитазон (4 мг/сут). В двойном слепом плацебо-контролируемом исследовании с перекрестным дизайном показано, что введение лираглутида устраняет основной фактор развития ССЗ у пациентов с СД 2-го типа — постпрандиальную гипергликемию и способствует улучшению постпрандиального липидного состава крови [7]. Предполагается, что эффект лираглутида на постпрандиальную липидемию опосредован сигнальными путями рецептора ГПП-1 [8].
В эпидемиологических исследованиях установлено, что лечение артериальной гипертонии (АГ) у больных СД 2-го типа сопровождается достоверным снижением сердечно-сосудистой смертности. Так, согласно данным классического исследования UCPDS, снижение систолического АД (САД) на 10 мм рт. ст. (6,5%) ассоциируется со снижением риска развития инсульта на 18% и инфаркта миокарда (ИМ) — на 11% [9]. При этом снижение уровня САД более выражено при его более высоком исходном уровне. Монотерапия эксенатидом в продолжение первых 24 нед способствовала снижению САД на 9,4±1,4 мм рт.ст. (р<0,001) и диастолического АД (ДАД) на 2,2±1,0 мм рт.ст. (р=0,04) по сравнению с группой плацебо [10]. В другом двойном слепом плацебо-контролируемом рандомизированном исследовании по данным суточного мониторирования АД у пациентов с СД 2-го типа и АГ продемонстрировано снижение как среднесуточного, так и ночного ДАД и САД. При этом эксенатид был назначен в дополнение к применявшейся терапии метформином, тиазолидиндионами или их комбинации [11]. В исследованиях программы LEAD подтверждено достоверно значимое снижение САД на фоне введения лираглутида [12].
Механизм снижения САД на фоне введения инкретиномиметиков полностью еще не изучен, однако установлено, что его основными патогенетическими звеньями являются прямая стимуляция рецептора ГПП-1, сигнальный путь NO/цГМФ, активация β2-адренорецепторов сосудов и ингибирование ренин-ангиотензин-альдостероновой системы [13].
Увеличение частоты сердечных сокращений на фоне терапии агонистами ГПП-1 характеризуется дозозависимым центральным эффектом и не является клинически значимым [11, 14]. Удлинение интервала QTc отражает нарушение процесса реполяризации миокарда, столь часто отмечаемое при развитии гипогликемии. Соответственно введение агонистов ГПП-1, характеризующихся глюкозозависимым действием, способствует минимизации эпизодов гипогликемии, нормальному протеканию процесса реполяризации, устранению дисфункции миокарда левого желудочка (ЛЖ). При проведении холтеровского мониторирования электрокардио-граммы подтверждена кардиальная безопасность (отсутствие атриовентрикулярной блокады, удлинения интервала QTc) терапевтических доз эксенатида у здоровых лиц [15]. Аналогично в двойном слепом исследовании TQT-Study, дизайн которого предусматривал введение лираглутида, плацебо или прием положительного контроля (препарат моксифлоксацин), продемонстрировано отсутствие удлинения интервала QTc при терапии лираглутидом в дозах 1,2 и 1,8 мг [16].
ГПП-1 положительно воздействует на миокард, устраняет дисфункцию эндотелия после его ишемического повреждения, предотвращая апоптоз кардиомиоцитов и способствуя пролиферации эндотелиальных клеток-предшественниц. Назначение эксенатида пациентам, ранее получавшим монотерапию метформином, уже через год комбинированной терапии приводит к повышению уровня адипонектина на 12% и снижению концентрации высокочувствительного С-реактивного белка — на 61%. Подтверждено снижение интенсивности перекисного окисления липидов. Установлено, что эксенатид способствует постпрандиальному снижению уровня холестерина в составе липопротеинов низкой плотности (ЛНП), не оказывая воздействия на apo-A1 [17]. Введение эксенатида мышам с СД 2-го типа предотвращает развитие гомоцистеин-индуцированной дисфункции эндотелия. Результаты исследования, в котором приняли участие 165 пациентов с СД 2-го типа (индекс массы тела 28,9—31,2 кг/м2, гликированный гемоглобин — HbA1c 8,1—8,5%), получавших лираглутид (0,65, 1,25 и 1,9 мг/сут) или плацебо в течение 24 нед, подтвердили значительное снижение уровня ингибитора активатора плазминогена-1 и мозгового натрийуретического пептида.
 Антиатеросклеротический эффект агонистов ГПП-1 обусловлен ингибированием макрофагальной инфильтрации стенки сосудов на начальной стадии образования атеросклеротической бляшки и прямым действием на стенку сосудов, сопровождающимся высвобождением NO [18, 19]. Установлено, что ГПП-1 способствует снижению интенсивности воспалительного процесса в стенке сосудов, в том числе в атеросклеротических бляшках, замедляя прогрессирование атеросклероза и снижая риск разрыва бляшек.
Антиатеросклеротический эффект агонистов ГПП-1 обусловлен ингибированием макрофагальной инфильтрации стенки сосудов на начальной стадии образования атеросклеротической бляшки и прямым действием на стенку сосудов, сопровождающимся высвобождением NO [18, 19]. Установлено, что ГПП-1 способствует снижению интенсивности воспалительного процесса в стенке сосудов, в том числе в атеросклеротических бляшках, замедляя прогрессирование атеросклероза и снижая риск разрыва бляшек.
Показано, что введение эксенатида и лираглутида в течение 14—28 нед способствует также снижению уровня натрийуретического пептида — маркера гемодинамического стресса. Кардиопротективный эффект эксенатида обусловлен повышением уровня антиоксиданта гемсинтетазы-1, ингибитора апоптоза Bcl-2, фосфорилированной серинтреониновой киназы Akt (активация которой способствует восстановлению толщины сердечной стенки после перенесенной ишемии и улучшению функции выживших кардиомиоцитов) и снижением уровня каспазы-3 (вызывающей апоптоз кардиомиоцитов) [20]. Лираглутид дозозависимо увеличивает продукцию NO в культуре эндотелиальных клеток пупочной вены (HUVEC), потенцируя активность эндотелиальной NO-синтетазы, а также проявляет супрессивный эффект в направлении активации ядерного фактора NF-kB и NF-kB-зависимой экспрессии различных генов, ответственных за воспалительный ответ, молекул адгезии клеток (VCAM-1, E-селектина, ICAM-1 и белка 1-го типа — хемоаттрактанта моноцитов). Указанными эффектами объясняются вазопротективные и противовоспалительные свойства лираглутида, наблюдаемые у пациентов с СД 2-го типа [21].
Мета-анализ, выполненный группой под руководством M. Monami [22], обобщил результаты 36 РКИ с участием 6490 пациентов, в которых оценивалось, по крайней мере, одно кардиальное осложнение в дополнение к параметрам гликемического контроля. При этом все сердечно-сосудистые исходы были рассмотрены лишь в 20 исследованиях, в которые были включены 3995 лиц. Данный мета-анализ подтвердил, что отношение шансов, рассчитанное с применением метода Мантеля—Ханзеля, для тяжелых сердечно-сосудистых осложнений (смерть от ССЗ, нефатальный ИМ и инсульт, госпитализация по поводу острого коронарного синдрома или сердечной недостаточности — СН) составило 0,737 в общей группе, 0,459 — в группе плацебо.
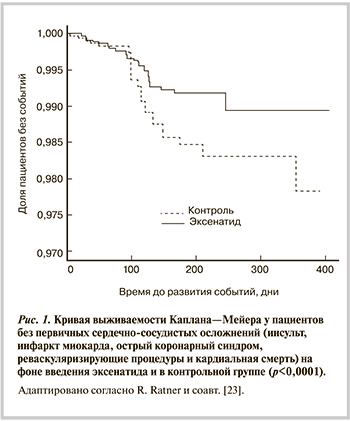
Снижение частоты фатальных и нефатальных сердечно-сосудистых осложнений на фоне введения агонистов ГПП-1 обусловлено улучшением гликемического контроля, снижением массы тела и уровня САД, а также уменьшением риска развития гипогликемии, вызывающих удлинение интервала QT и увеличивающих риск развития аритмий (рис. 1).
Анализ 3 плацебо-контролируемых РКИ с участием длительно действующего эксенатида ЛАР (LAR – long-acting release, – это относится к длительно действующему эксенатиту, вводимому 1 раз в неделю) с позиций оценки риска развития кардиальных осложнений продемонстрировал предпочтение агонистов ГПП-1 в сравнении с другими препаратами. Так, достижение таких комбинированных критериев, как HbA1c <6,5%, отсутствие увеличения массы тела и эпизодов гипогликемии, а также HbA1c <6,5%, САД <130 мм рт.ст. и ЛНП <100 мг/дл чаще отмечалось именно на фоне терапии эксенатидом ЛАР [24].
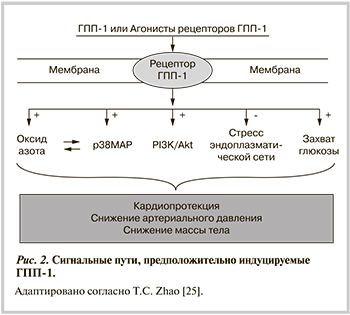
ИМ и СН характеризуются инсулинрезистентным состоянием. Предпочтительным энергетическим субстратом для поврежденного миокарда с точки зрения кардиопротекции является глюкоза, так как позволяет восстановить адекватное поступление энергии и миокардиальный кровоток. При остром ИМ использование глюкозо-калиево-инсулиновой смеси является адъювантной терапией, однако требует проведения постоянной инфузии и сопряжено с риском развития гипогликемии. В настоящее время получены данные экспериментальных и клинических исследований, подтверждающие возможность использования агонистов ГПП-1 в качестве кардиопротективного препарата. Установлено, что ГПП-1 оказывает сопоставимое с инсулином улучшение захвата глюкозы, но использует иные клеточные пути — р38-митоген-активируемой протеинкиназы, фосфоинозитол-3-киназы и NO (рис. 2). На фоне введения агонистов ГПП-1 у пациентов, перенесших острый ИМ и чрескожную коронарную ангиопластику, подтверждено улучшение функции миокарда.
В экспериментальной животной модели использование лираглутида обусловливает достоверно значимое сокращение зоны некроза по сравнению с таковой в группе контроля. Зона некроза, измеренная в процентном отношении от окружности ЛЖ, составила 20,9±1,7 и 28,8±3,3% при введении лираглутида и в контрольной группе (p=0,02) соответственно. Кроме того, при введении лираглутида также была менее выражена гипертрофия миокарда, количественно выражаемая отношением массы сердца к массе тела. Показано улучшение систолической функции ЛЖ. При этом полагают, что лираглутид ингибирует каспазный путь, вызывающий апоптоз [26].
Диабетическая кардиомиопатия (КМП) развивается у пациентов с СД 2-го типа вследствие метаболических нарушений в миокарде, накопления конечных продуктов гликирования, дисфункции митохондрий, последствий окислительного стресса и дисфункции микрососудов. Вследствие этого ГПП-1, устраняющий подобные нарушения, может успешно использоваться у пациентов с СД 2-го типа для профилактики или лечения диабетической КМП. В экспериментальной животной модели продемонстрировано, что лираглутид предотвращает диабетическую КМП посредством ингибирования стресса в эндоплазматической сети кардиомиоцитов, включающего пути активирующих апоптоз белка CHOP, каспазы-12 и JNK-киназы. Важно отметить, что данный эффект подтвержден гистологически [27].
Хроническая сердечная недостаточность (ХСН). У пациентов с СД 2-го типа, даже в отсутствие ишемической болезни сердца и АГ, вследствие диабетической КМП развивается диастолическая дисфункция ЛЖ, способствующая развитию ХСН с сохраненной фракцией выброса. Кроме того, у пациентов с СД 2-го типа часто отмечается систолическая дисфункция ЛЖ [28]. У пациентов с ХСН III—IV (по классификации NYHA) и ожирением инфузия ГПП-1 в течение 4 нед способствовала увеличению фракции выброса ЛЖ. Показано, что периоперационная инфузия ГПП-1 в течение первых 2 сут после проведения аортокоронарного шунтирования снижает необходимость в инотропной поддержке [29].
Перспективы использования агонистов рецепторов ГПП-1 связаны с результатами продолжающихся в настоящее время плацебо-контролируемых РКИ III фазы (EXSCEL, LEADER, ELIXA, REWIND), оценивающих отдаленные сердечно-сосудистые исходы. Исследуются и длительно действующие агонисты ГПП-1, вводимые 1 раз в неделю. Мощные негликемические эффекты, свойственные классу агонистов ГПП-1, позиционируют их использование у пациентов с ожирением без нарушения углеводного обмена, а также в кардиологической практике.
Заключение
Агонисты рецепторов глюкагоноподобного пептида-1 оказывают не только мощное сахароснижающее действие, но и уменьшают риск развития сердечно-сосудистых заболеваний, способствуя снижению массы тела, устранению дислипидемии, снижению уровня артериального давления и концентрации в плазме крови маркеров риска развития сердечно-сосудистых осложнений.
В настоящее время изучены различные механизмы, обусловливающие снижение риска развития сердечно-сосудистых осложнений при введении агонистов рецепторов глюкагоноподобного пептида-1, опосредованные прямым и непрямым действием глюкагоноподобного пептида-1 (7—39) и его метаболита глюкагоноподобного пептида-1 (9—39). Агонисты рецепторов глюкагоноподобного пептида-1 могут быть успешно использованы у пациентов, перенесших инфаркт миокарда, страдающих хронической сердечной недостаточностью, диабетической кардиомиопатией.
В крупных рандомизированных клинических исследованиях подтвержден благоприятный кардиальный профиль агонистов глюкагоноподобного пептида-1. Эффективность их длительного использования будет всесторонне оценена после получения результатов исследований EXSCEL, LEADER, ELIXA и REWIND, дизайн которых предусматривает целенаправленную оценку влияния агонистов рецепторов глюкагоноподобного пептида-1 на риск развития сердечно-сосудистых осложнений.



