По данным коронарографии, гемодинамически значимое поражение ствола левой коронарной артерии (ЛКА) встречается в 3—7% случаев [1—3]. Показано, что при консервативной терапии 5-летняя выживаемость этих пациентов составляет менее 50% [4]. В настоящее время рекомендованным методом реваскуляризации у пациентов с поражением ствола ЛКА является коронарное шунтирование (КШ) [5, 6]. В последние годы все больше внимания уделяется возможностям чрескожных коронарных вмешательств (ЧКВ) при лечении этих больных [7]. Современные рекомендации требуют обязательного проведения коронарной реваскуляризации, однако в реальной клинической практике некоторые пациенты с поражением ствола ЛКА получают консервативное лечение. В литературе практически отсутствуют публикации, сравнивающие такой подход с современными методами реваскуляризации. Поэтому целью настоящего исследования явилась оценка клинико-функционального статуса и результатов лечения ишемической болезни сердца (ИБС) у пациентов с поражением ствола ЛКА в реальной клинической практике.
Материал и методы
Из 3720 пациентов, включенных в «Регистр проведенных операций коронарной ангиографии» [3], которым в период с января 2006 г. по июнь 2011 г. выполнялась диагностическая коронарография, было выявлено 225 (6%) с гемодинамически значимым (более 50%) поражением ствола ЛКА. У всех пациентов была стабильная форма ИБС.
У всех пациентов были собраны демографические данные, оценивались наличие факторов риска (артериальная гипертония, сахарный диабет, ожирение, курение) и анамнез ИБС (стенокардия, инфаркт миокарда — ИМ).
Всем пациентам проводилось общеклиническое обследование, включающее оценку клинической картины, электрокардиографию (ЭКГ), эхокардиографию с определением фракции выброса (ФВ) левого желудочка (ЛЖ), суточного мониторирования ЭКГ и нагрузочных тестов (велоэргометрия, тредмил).
Селективную коронарографию проводили по методу Judkins (1967 г.) с помощью ангиографического комплекса «Phillips Integris Allura» (Голландия).
Для оценки степени риска операции КШ использовали шкалу EuroSCORE (www.euroscore.org/calculators.htm). Степень тяжести поражения коронарного русла оценивали по шкале SYNTAX (http://www.syntaxscore.com/calc/start.htm).
Методы лечения после определения гемодинамически значимого поражения ствола ЛКА были оценены у 218 (96,8%) пациентов. В зависимости от метода лечения пациенты были разделены на 3 основные группы.
В 1-ю группу вошли больные, находящиеся на консервативной терапии. Их лечение включало прием нитроглицерина, ацетилсалициловой кислоты, β-адреноблокаторов, блокаторов кальциевых каналов, ингибиторов ангиотензинпревращающего фермента, статинов.
Во 2-ю группу были включены пациенты, которым выполнялось КШ. Всем больным выполнялось аутовенозное и аутоартериальное шунтирование к ветвям ЛКА и правой коронарной артерии. Большинство операций выполнено в условиях искусственного кровообращения.
В 3-ю группу объединили пациентов, которым выполняли ЧКВ. Всем пациентам были имплантированы коронарные стенты. Техника стентирования для достижения оптимального ангиографического результата определялась оперирующим хирургом. Стандартные металлические стенты – Multilink Zeta (Guidant), Multilink Vision (Guidant), Liberty (Boston Scientific) – применяли не более чем в 5% случаев. В основном стентирование выполняли стентами с антипролиферативным покрытием: Cypher, Taxus Liberte monorail, Endeavor Sprint, Endeavor Resolute RX, Promus, Promus Element, Taxus Element.
Отдаленные результаты оценены у 213 (97,7%) пациентов, медиана наблюдения составила 49 (33,0; 61,5) мес.
Статистическую обработку данных проводили с использованием пакета статистических прикладных программ (SPSS Inc., версия 17.0). Результаты представлены в виде М±SD при нормальном распределении; при асимметричном распределении значения представлены медианой (Ме) с интерквартильным размахом в виде 25-го и 75-го процентилей. Распределение количественных переменных определяли с помощью критерия Колмогорова—Смирнова. В зависимости от распределения количественных данных для сравнения групп использовали дисперсионный анализ (ANOVA) или критерий Крускала—Уоллиса. При парном сравнении применяли поправку Бонферрони. Для сопоставления качественных переменных использовали критерий c2, точный критерий Фишера, применяя поправку Бонферрони. Выживаемость оценивали по методу Каплана—Мейера с использованием F-критерия Кокса. Для определения факторов, ассоциирующихся с выживаемостью, использовали регрессионный анализ Кокса с пошаговым включением переменных.
Результаты
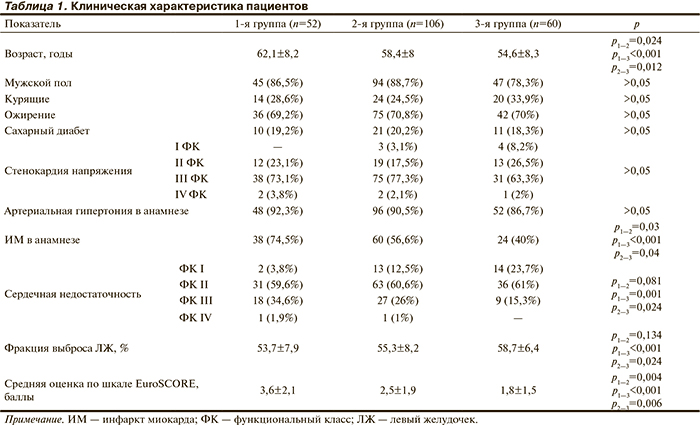
Выявлено, что 52 (23,9%) пациентам (1-я группа) реваскуляризация не была выполнена, у 106 (48,6%) больных (2-я группа) выполнено КШ, у 60 (27,5%; 3-я группа) — ЧКВ. Клиническая характеристика пациентов представлена в табл. 1.
Пациенты в группе ЧКВ были моложе, чем в группах КШ (р=0,012) и без реваскуляризации (р<0,001). Однако между группой без реваскуляризации и группой КШ не выявлено статистически значимых различий по возрасту. ИМ в анамнезе в группе без реваскуляризации встречался чаще, чем в группе ЧКВ (р<0,001). Недостаточность кровообращения у пациентов группы без реваскуляризации была более тяжелой, чем у пациентов группы ЧКВ (р=0,001). Однако между группами без реваскуляризации и КШ и между группами ЧКВ и КШ не выявлено статистически значимых различий. ФВ ЛЖ в группе без реваскуляризации была ниже, чем в группе ЧКВ (р<0,001). Однако не было выявлено статистически значимых различий по ФВ ЛЖ между группами пациентов без реваскуляризации и КШ, а также между группами КШ и ЧКВ. Средняя оценка по шкале EuroSCORE свидетельствовала, что состояние пациентов группы без реваскуляризации было тяжелее, чем в группах КШ (р=0,004) и ЧКВ (р<0,001). В свою очередь оценка по шкале EuroSCORE у пациентов группы КШ была выше, чем в группе пациентов, которым выполнялись ЧКВ (р=0,006).
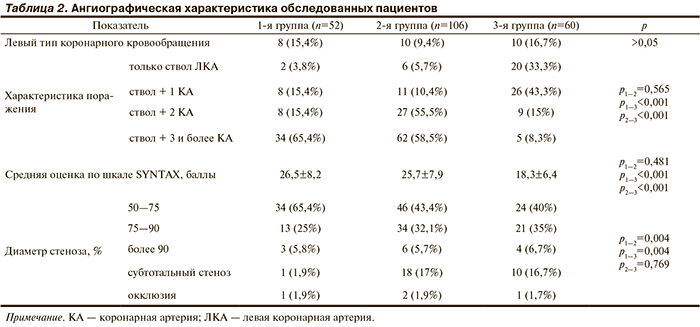
 При анализе ангиографической характеристики (табл. 2) выявлено, что в группах пациентов без реваскуляризации и КШ поражение ствола ЛКА в сочетании с поражением нескольких коронарных артерий встречалось чаще, чем в группе ЧКВ (p<0,001). Средняя оценка по шкале SYNTAX была одинаковой в группе без реваскуляризации и группе КШ. В то же время в группах без реваскуляризации и КШ средняя оценка по шкале SYNTAX была выше, чем в группе ЧКВ (p<0,001).
При анализе ангиографической характеристики (табл. 2) выявлено, что в группах пациентов без реваскуляризации и КШ поражение ствола ЛКА в сочетании с поражением нескольких коронарных артерий встречалось чаще, чем в группе ЧКВ (p<0,001). Средняя оценка по шкале SYNTAX была одинаковой в группе без реваскуляризации и группе КШ. В то же время в группах без реваскуляризации и КШ средняя оценка по шкале SYNTAX была выше, чем в группе ЧКВ (p<0,001).
При анализе причин невыполнения реваскуляризации у пациентов с поражением ствола ЛКА выявлено, что у 17 (32,7%) имелись клинические противопоказания (высокий хирургический риск, наличие тяжелого сопутствующего заболевания) или отсутствовала техническая возможность проведения операции, 28 (53,8%) пациентов отказались от операции. У 7 (13,5%) пациентов не удалось выявить объективных причин, по которым реваскуляризация не была выполнена.
У пациентов, которым выполнялась коронарная реваскуляризация, медиана срока выполнения КШ после выявления гемодинамически значимого стеноза ствола ЛКА составила 68 (22,5; 156) дней, в то время как для ЧКВ — 4 (2; 6) дня (р<0,001).
На госпитальном этапе у 2 (3,4%) пациентов группы ЧКВ отмечалось развитие мелкоочагового ИМ (без зубца Q). В группе КШ в 1 (0,9%) случае отмечалось развитие крупноочагового интраоперационного ИМ. У 4 (3,7%) пациентов группы КШ течение послеоперационного периода осложнилось развитием медиастинита, в 1 (0,9%) случае — перикардита.
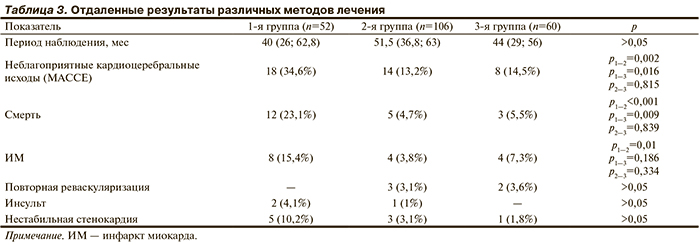
За период наблюдения (табл. 3) неблагоприятные кардиоцеребральные осложнения в группе пациентов без реваскуляризации встречались чаще, чем в группах КШ (р=0,002) и ЧКВ (р=0,016). При этом между группой КШ и группой ЧКВ не выявлено статистически значимых различий по этому комбинированному показателю, включающему смерть, ИМ повторную реваскуляризацию и инсульт.
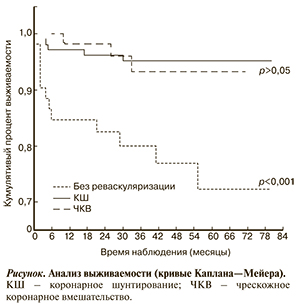
Высокая частота неблагоприятных кардиоцеребральных исходов в группе пациентов, не получавших реваскуляризацию, во многом складывается за счет более высокой смертности среди этих больных по сравнению с группами КШ (р<0,001) и ЧКВ (р=0,009). Следует отметить, что среди пациентов 2-й и 3-й групп за период наблюдения не было выявлено различий по смертности. Кривые Каплана—Мейера, характеризующие выживаемость пациентов, представлены на рисунке. В конце периода наблюдения общая выживаемость больных в группе консервативной терапии составила 76,9%, у пациентов группы КШ — 95,3%, среди пациентов группы ЧКВ — 94,5%. Анализ характера кривых Каплана—Мейера показал, что позитивное влияние реваскуляризации было реализовано уже в ранние сроки наблюдения (до 6 мес). В дальнейшем наблюдалось увеличение различий по выживаемости пациентов 2-й и 3-й группы по сравнению с пациентами группы консервативной терапии.
Для оценки факторов, ассоциирующихся с выживаемостью, в модель пошаговой регрессии Кокса были включены все факторы, по которым имелись межгрупповые различия. Основным фактором, ассоциирующимся с выживаемостью в отдаленном периоде, являлась коронарная реваскуляризация (относительный риск — ОР — 3,49 при 95% доверительном интервале — ДИ — от 1,39 до 8,75). Кроме того, была выявлена взаимосвязь выживаемости и таких факторов, как возраст (ОР 1,1 при 95% ДИ от 1,03 до 1,17) и ФВ ЛЖ (ОР 0,95 при 95% ДИ от 0,90 до 0,99). Несмотря на наличие случаев ИМ в госпитальном периоде у пациентов после реваскуляризации, общая частота развития ИМ у пациентов без реваскуляризации была выше. Однако по сравнению с группой ЧКВ эти различия была статистически незначимыми. Не было статистически значимых различий по частоте развития инсультов и нестабильной стенокардии в сравниваемых группах, а также в необходимости повторной реваскуляризации в группах КШ и ЧКВ.
Обсуждение
В настоящее время наличие гемодинамически значимого стеноза ствола ЛКА является абсолютным показанием к реваскуляризации [5, 6]. Эти рекомендации основаны на результатах мета-анализа [8], который суммировал данные 7 рандомизированных исследований, проводимых в 70-е годы XX века среди пациентов со стабильной стенокардией и поражением ствола ЛКА. Было продемонстрировано, что выполнение КШ по сравнению с медикаментозной терапией у этих больных привело к снижению смертности за 5 лет на 68%. В другом крупном исследовании (1484 пациента) [9] показано, что средняя выживаемость больных с поражением ствола ЛКА после КШ составила 13,3 года, а это в 2 раза превышало аналогичный показатель для пациентов группы консервативной терапии.
Несмотря на очевидное преимущество реваскуляризации, в реальной клинической практике некоторые пациенты с поражением ствола ЛКА лечатся консервативно. Отказ пациента и высокий риск операции являются главными причинами отказа от выполнения реваскуляризации у этих больных [10]. По нашим данным, отказ пациента служил причиной невыполнения реваскуляризации более чем в 50% случаев. Учитывая положительное влияние реваскуляризации на выживаемость, такой фактор, как отказ от операции, необходимо минимизировать, обстоятельно объясняя пациенту преимущества реваскуляризации. У 7 (13,5%) пациентов мы не смогли выявить объективных причин невыполнения реваскуляризации. Этим пациентам было показано КШ, не имелось противопоказаний к выполнению операции, все больные были согласны на проведение реваскуляризации. Учитывая, что 4 пациентов этой группы умерли (медиана периода от выявления стеноза ствола ЛКА до смерти составила 114 (46,8; 713,8) дней), очевидна необходимость обеспечения контроля всех этапов дополнительных обследований и проведения реваскуляризации в максимально короткие сроки.
В настоящее время спорным остается вопрос о преимуществе различных методов реваскуляризации при поражении ствола ЛКА. В нескольких недавних исследованиях показаны эффективность и безопасность ЧКВ в лечении этих пациентов [11—13]. В большинстве исследований при сравнении ЧКВ и КШ не получено статистически значимых различий по частоте развития основных неблагоприятных кардиальных исходов, таких как смерть, ИМ и инсульт, что подтверждает полученные нами данные. В регистре MAIN-COMPARE, который являлся первым крупным (2240 пациентов) многоцентровым нерандомизированным исследованием, сравнивающим отдаленные результаты ЧКВ и КШ, по данным пятилетнего наблюдения в сравниваемых группах не было получено статистически значимых различий по частоте достижения комбинированной «конечной точки» (ОР 1,07 при 95% ДИ от 0,84 до 1,37; р=0,59), однако частота повторной реваскуляризации была выше в группе ЧКВ (ОР 5,11 при 95% ДИ от 3,52 до 7,42; р<0,001) [14]. Увеличение частоты повторной реваскуляризации после ЧКВ в сравнении с КШ отмечалось в ряде исследований [15, 16]. Так, по данным четырехлетнего наблюдения в исследовании SYNTAX, частота повторной реваскуляризации была выше в группе ЧКВ (23,5% против 14,6%; р=0,003). Однако по частоте достижения комбинированной «конечной точки» (MACCE), включающей смерть, ИМ, инсульт и повторную реваскуляризацию, не получено статистически значимых различий (33,2% против 27,8%; р=0,14). Предложенная в данном исследовании шкала SYNTAX позволила классифицировать пациентов по тяжести поражения коронарного русла. Ранее нами показано, что многососудистое поражение коронарного русла ассоциировалось с увеличением неблагоприятных кардиальных исходов у пациентов с поражением ствола ЛКА после ЧКВ [17]. Данные, полученные в настоящем исследовании, продемонстрировали, что в реальной клинической практике ЧКВ чаще выполняется пациентам с более низкой оценкой по шкале SYNTAX. Возможно, это явилось причиной отсутствия различий по частоте повторной реваскуляризации в отдаленном периоде среди групп ЧКВ и КШ.
Несмотря на то что пациенты в нашем исследовании имели исходные межгрупповые различия по клиническому статусу, риску коронарного шунтирования, характеру и степени поражения коронарного русла, независимая взаимосвязь этих факторов и выживаемости в отдаленном периоде не была установлена. Метод пошаговой регрессионной модели пропорциональных рисков Кокса продемонстрировал, что основным фактором, ассоциирующимся с более высокой выживаемостью больных в отдаленном периоде, была коронарная реваскуляризация (ЧКВ или КШ) по сравнению с консервативной терапией.
В рамках настоящего исследования мы не проводили оценку медикаментозной терапии в изучаемых группах. Можно предполагать, что правильно подобранные лекарственные препараты и уровень приверженности пациентов к терапии влияют на общую эффективность лечения, однако для нас было важным оценить значение реваскуляризации миокарда в целом по сравнению с консервативной терапией ИБС у больных со стенозом ствола ЛКА в реальной клинической практике.
Выводы
Пациенты группы без реваскуляризации характеризовались более тяжелым клиническим течением ишемической болезни сердца по сравнению с группой чрескожного коронарного вмешательства. Однако между группами без реваскуляризации и коронарного шунтирования, как и между группами коронарного шунтирования и чрескожного коронарного вмешательства, не было выявлено различий по большинству параметров, характеризующих клинический статус больных.
Выполнение коронарной реваскуляризации у пациентов с поражением ствола левой коронарной артерии (чрескожное коронарное вмешательство или коронарное шунтирование) в реальной клинической практике снижало частоту неблагоприятных кардиоцеребральных исходов в отдаленном периоде по сравнению с таковой у пациентов, получавших только консервативную терапию.
Среди пациентов групп коронарного шунтирования и чрескожного коронарного вмешательства не выявлено различий по частоте неблагоприятных кардиоцеребральных исходов и смертности в отдаленном периоде.
Выживаемость пациентов, которым проводилось коронарное шунтирование или выполнялись чрескожные коронарные вмешательства, была выше, чем у пациентов группы консервативной терапии. Позитивный эффект реваскуляризации реализовывался уже в ранние сроки (до 6 мес) и прогрессивно увеличивался до конца периода наблюдения (более 60 мес).
Проведение реваскуляризации являлось независимым фактором, влияющим на выживаемость пациентов с поражением ствола левой коронарной артерии.
После выявления гемодинамически значимого стеноза ствола левой коронарной артерии чрескожные коронарные вмешательства выполнялись в более короткие сроки в сравнении с коронарным шунтированием.
Изложенное диктует необходимость максимально быстрого проведения доступной реваскуляризации миокарда у больных со стенозом ствола левой коронарной артерии.



