Совершенствование технологии чрескожных коронарных вмешательств (ЧКВ) определяет постоянный
рост числа этих процедур во всем мире. С 1994 г. в Европе количество коронарных ангиопластик с имплантацией стента уже значительно превышает число операций коронарного шунтирования (КШ), а по данным European Medical Association, к 2006 г. на одно КШ выполнялось в среднем 3 ЧКВ [1—3].
Одновременно с этой тенденцией в течение последнего десятилетия наблюдается неуклонный рост числа пациентов, у которых в ближайшее время после вмешательства развился рецидив ишемической болезни сердца (ИБС) и возникли показания к новой реваскуляризации — повторной ангиопластике или КШ. Как показывают рандомизированные клинические исследования [от GABI (1994) до ARTS II (2010)], основной причиной рецидива ИБС у таких пациентов является формирование рестенозов в области стентов и новых стенозов в коронарных артериях (КА). Несмотря на использование новых технологий, улучшение подготовки специалистов и, как следствие, меньшую травматичность и большую эффективность стентирования, 20—25% больных становятся в ближайшие годы после ангиопластики кандидатами на хирургическое лечение [4—11].
В последние годы в литературе стали появляться данные, свидетельствующие о возникновении стеноза
ствола левой коронарной артерии (ЛКА) как следствия повреждения интимы после эндоваскулярных вмешательств [12—17].
Цель настоящего исследования — анализ особенностей развития коронарного атеросклероза у больных, которым выполнены операции КШ в связи с рецидивом стенокардии после ангиопластики и стентирования КА.
Материал и методы
Проанализированы коронарные ангиограммы больных, подвергшихся эндоваскулярному лечению и ставших в последующем кандидатами на КШ. Нас интересовал «ангиоморфологический» субстрат
рецидива коронарного синдрома, особенно случаи, когда он сформировался в бассейне выполненной
ранее катетеризации и пластики. Такими ситуациями считали следующие:
— формирование нового или быстрое и выраженное прогрессирование имевшегося стеноза ствола
ЛКА после ЧКВ передней нисходящей (ПНА), огибающей (ОА) артерий или их ветвей;
— прогрессирование поражения в проксимальном отделе ПНА после выполненного ЧКВ ПНА или
диагональной артерии (ДА), в проксимальной части ОА — после выполненного ЧКВ ОА или артерии
тупого края (АТК), в проксимальном отделе правой коронарной артерии (ПКА) после ЧКВ ПКА и задней
нисходящей артерии (включая немногочисленные случаи изолированного стентирования ПКА как симптом-связанной артерии в остром периоде инфаркта миокарда при наличии поражения ветвей ЛКА).
Кроме того, учитывали случаи прогрессирования поражения в участках дистальнее стентов, равно как
и случаи внутристентовых рестенозов, во всех КА, подвергшихся пластике.
Проведен ретроспективный анализ базы данных пациентов, оперированных в отделе сердечно-сосудистой хирургии в период с января 2004 г. по октябрь 2010 г. по поводу рецидивов стенокардии III—IV функционального класса (ФК) по Канадской классификации после ЧКВ. Критериями исключения явились гемодинамически значимое поражение ствола ЛКА до ангиопластики и стентирования, стентирование ствола ЛКА, экстренная операция КШ после неудачного ЧКВ, осложненные или неэффективные интервенционные вмешательства, сочетанное поражение клапанного аппарата. Пациенты, направленные из других центров и не имеющие на руках медицинской документации с детальным описанием интервенционных вмешательств, также были исключены из исследования.
По результатам отбора в анализ включены 150 пациентов в возрасте от 34 до 82 лет (средний возраст
58,6±9,1 года), из них 136 (90%) мужчин. Клиническая характеристика больных приведена в табл. 1.
Таблица 1. Клиническая характеристика больных с рецидивом ИБС после ЧКВ, ставших кандидатами на КШ (n=150).
Таблица 2. Динамика поражения КА после ЧКВ, формирующая показания к КШ.
При анализе исходных и повторных ангиограмм учитывали частоту рестенозов или окклюзий стентированных сегментов; число случаев прогрессирования атеросклероза с детализацией типа поражения в других сегментах восстановленной артерии (проксимальнее и дистальнее стента), тот и другой показатель в процентах от общего числа пациентов и от общего числа артерий, подвергшихся пластике; число случаев прогрессирования атеросклероза в ранее интактных артериях или артериях с незначимым поражением, не подвергшихся пластике, в процентах от общего числа пациентов.
Характер атеросклеротического поражения КА оценивали по классификации ACC/AHA, согласно
которой оно разделено на 3 основные морфологические типа: А — концентрические стенозы протяженностью менее 10 мм с ровными контурами; В — эксцентрические стенозы протяженностью менее 20 мм либо стенозы с умеренным кальцинозом, неровными контурами или признаками пристеночного тромбоза; С — стенозы протяженностью более 20 мм с изъязвленной поверхностью, выраженным кальцинозом, диффузным поражением артерии.
Помимо изучения характера атеросклеротической бляшки проводили анализ времени, прошедшего
с момента ангиопластики до рецидива стенокардии; этот временной промежуток правомерно считать
периодом, за который развилось ухудшение ангиографической картины.
Статистическую обработку данных выполняли с помощью непараметрических методов Манна—
Уитни и Фишера и программы Statistic 6.
Результаты
У всех без исключения пациентов при анализе состояния коронарного русла к моменту развития рецидива стенокардии определялось более тяжелое, чем на момент проведения ЧКВ, поражение КА; в большинстве случаев оно было многососудистым.
На рис. 1 и 2 представлено распределение больных по длительности периода сохранения клинического эффекта пластики. Интервал времени с момента проведения ЧКВ до возобновления тяжелой стенокардии составил от 1 мес до 6 лет. Обращает внимание, что большинство кандидатов на КШ составили больные с коронарным синдромом, возобновившимся в течение первого года после катетеризации.
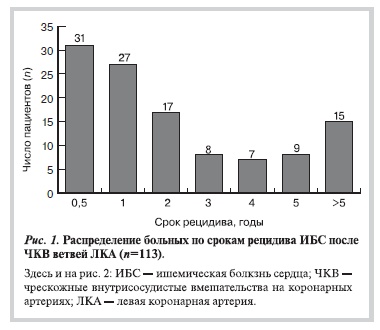
Результаты анализа динамики ангиографической картины представлены в табл. 2. Фактически эти данные отражают структуру поражения коронарного русла у больных, направленных на КШ после коронарной ангиопластики.
Приняв все поражения в КА, возникшие в период после пластики («новые» стенозы в восстановленных артериях), за 100%, мы обнаружили, что доля внутристентовых рестенозов в структуре поражения составляет всего 7%, тогда как формирование стеноза за счет прогрессирования атеросклероза в других сегментах — проксимальнее или дистальнее стента — 93%.
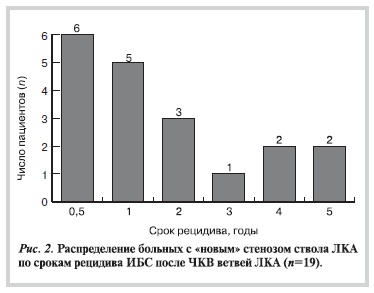
Особое внимание мы уделили группе больных, у которых новой находкой при повторной, предоперационной ангиографии явился гемодинамически значимый стеноз ствола ЛКА. Общее число пациентов со стенозом ствола ЛКА на момент КШ составило 29, но только у 19 из них стеноз отсутствовал до эндоваскулярного лечения.
На рис. 2 графически представлено распределение больных этой группы по времени развития рецидива коронарного синдрома после ЧКВ. При этом в ходе изучения анамнеза мы убедились, что практически во всех случаях ангиография была выполнена в короткие сроки от момента ухудшения течения заболевания. Поэтому фактически график отображает сроки формирования нового стеноза ствола ЛКА после катетеризации и пластики ветвей ЛКА. Видно, что в большинстве случаев «новый» стеноз ствола ЛКА развился в течение первых 6 мес после эндоваскулярного вмешательства на ветвях ЛКА.
Для того чтобы понять, каковы отличия этой категории больных от общей группы в клиническом
отношении и можно ли выявить факторы риска быстрого развития стеноза ствола ЛКА после катетеризации, мы провели анализ клинических, ангиоморфологических характеристик, а также деталей ЧКВ у больных с наличием признаков значимого стенотического прогрессирования в стволе ЛКА и без таковых. Результаты сравнения приведены в табл. 3 и 4. Группа пациентов без стеноза
ствола была сформирована из числа 150 исследуемых пациентов за исключением 19 пациентов с «новым» стенозом ствола ЛКА и 18 пациентов, которым не проводилось вмешательство на ветвях ЛКА.
Анализ показал, что среди 19 больных с вновь развившимся стенозом ствола ЛКА у 11 (58%) диаметр
ствола ЛКА был менее 3,5 мм и 7 (37%) страдали сахарным диабетом. Однако в большей степени отличия этих больных от основной группы касались технических характеристик выполненного эндоваскулярного вмешательства: у 9 (47%) использовались катетеры с дополнительной поддержкой back-up XB, AL; у 6 (32%) вмешательства проводились повторно; у 5 (26%) отмечено вмешательство более чем на 2 сегментах; у 3 (16%) стентирование было бифуркационным с использованием двух стентов и kissing-дилатации.
Таблица 3. Сравнительный анализ клинических и ангиоморфологических характеристик у пациентов с «новым» стенозом ствола ЛКА и без него.
Таблица 4. Сравнительный анализ объема ЧКВ у больных с «новым» стенозом ствола ЛКА и без него.
При изучении показателей в группах сравнения статистически значимые различия получены по следующим признакам: число случаев сопут ствующего сахарного диабета, диаметра ствола менее 3,5 мм, вмешательств более чем на 2 сегментах, повторных эндоваскулярных вмешательств на ветвях ЛКА, сложное бифуркационное стентирование с использованием 2 стентов и kissing-дилатации, частота использования дополнительных проводников.
Всем больным, включенным в данное исследование, была выполнена хирургическая реваскуляризация:
в 80% случаев — плановая, в 20% — срочная. Большинство срочных операций выполнены у пациентов с вновь возникшим стенозом ствола ЛКА. Хирургические вмешательства проводили по стандартной методике в условиях искусственного кровообращения и умеренной гипотермии с применением холодовой и медикаментозной кардиоплегии, с обязательным использованием левой внутренней грудной артерии в качестве шунта к ПНА [18] и средним количеством дистальных анастомозов 3,5±0,5 на пациента. Результаты операций в исследуемой группе сопоставимы с результатами первых операций коронарного шунтирования. Частота развития периоперационного ИМ составила 2,6%,
летальных исходов не отмечено. При диффузном атеросклеротическом поражении с кальцинозом
выполняли коронарную эндартерэктомию, причем в ряде наблюдений с атеросклеротическими бляшками извлекали окклюзированные стенты.
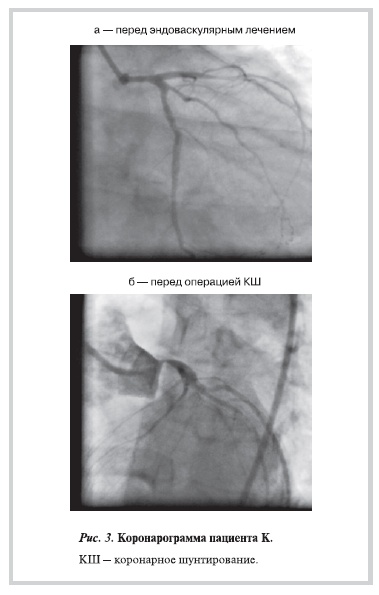
Приводим клинический пример. Пациент К. с диагнозом: ИБС: стенокардия напряжения III ФК,
атеросклероз КА (многососудистое поражение), постинфарктный кардиосклероз (ИМ передней
локализации от 02.06.09), артериальная гипертония. При коронарографии выявлены стенозы ПНА 85%,
АТК 75% и ПКА до 80%. Ангиограмма ПНА и АТК до эндоваскулярного вмешательства представлена на рис. 3, а. 03.07.09 выполнено ЧКВ со стентированием ПНА, АТК, ПКА, установлено 3 стента с лекарственным покрытием. С января 2010 г. возобновились приступы стенокардии, нагрузочный тест — положительный, при повторной коронарографии (рис. 3, б) — стеноз ствола ЛКА 90%, стеноз ПНА в устье 70% (проксимальнее места имплантации стентов).
Критическое поражение коронарного русла, стеноз ствола ЛКА, угроза развития фатального ИМ явились показанием к хирургическому лечению — КШ, которое выполнено 16.03.10 г.: аутовенозное шунтирование ОА + АТК с формированием искусственной Y-образной конструкции, аутовенозное шунтирование ДА, ПКА (после эндартерэктомии), маммарокоронарное шунтирование ПНА (после эндартерэктомии).
Интраоперационно: выраженное протяженное атеросклеротическое поражение всей ПНА и стенозы
проксимальнее места установки стента в ПКА; принято решение о необходимости выполнения
эндартерэктомии. При эндартерэктомии из ПНА удалена атеросклеротическая бляшка длиной 10 см, которая включала тромбированный стент (рис. 4).

Послеоперационный период протекал без осложнений. Больной наблюдается в течение года, рецидива стенокардии нет.
Обсуждение
Рецидив стенокардии после любого вида инвазивного лечения ИБС остается ведущей проблемой современной кардиологии и кардиохирургии. В нашем исследовании речь идет о клинически значимом, достаточно тяжелом рецидиве коронарного синдрома и его субстрате у больных, которые перенесли успешное эндоваскулярное лечение, но в последующем стали кандидатами на КШ.
Широко обсуждаются в литературе вопросы, касающиеся причин и факторов риска развития
рестеноза стента. Рестеноз — результат избыточной и неконтролируемой пролиферативной реакции
клеточных элементов в ответ на травму и инородное тело [19]. Развитие этого осложнения связывается также с применением баллонной ангиопластики и непокрытых стентов. Факторами риска рестеноза являются сахарный диабет, протяженные стенозы, хронические окклюзии, малый (<2,5 мм) диаметр сосуда. Известно, что с помощью технологии лекарственного покрытия стентов удалось добиться впечатляющих результатов в подавлении развития рестеноза; по разным источникам,
частота развития рестеноза после применения стентов с покрытием составляет от 5 до 9% в течение первого года [20—23].
Однако рестеноз — не единственная причина развития болезни после успешной пластики. Прогрессирование атеросклероза в других сегментах пораженной КА — проксимальнее или дистальнее места пластики — такая же серьезная проблема, как рестеноз. Какова доля этого вида поражения в структуре всех коронарных проблем у больных с рецидивом коронарного синдрома? Какова роль самого эндоваскулярного вмешательства в формировании этого поражения, особенно в тех случаях,
когда клинический эффект непродолжителен? Учитывая количество проводимых в наши дни процедур ЧКВ, в том числе сложных и повторных, мы посчитали актуальным такой анализ у категории больных, направленных по поводу тяжелого рецидива болезни на хирургическую реваскуляризацию.
Наши результаты свидетельствуют о том, что 7% рецидивов было обусловлено рестенозом или окклюзией сегмента, на котором проводили вмешательство, а значительно бо`льшая часть поражений локализовалась в других сегментах восстановленной артерии. Развитие эндоваскулярных технологий привело к существенному расширению как клинических, так и морфологических показаний к интервенционному вмешательству [24]. Коронарное стентирование в настоящее время выполняется
при различных, в том числе осложненных, поражениях коронарного русла (бифуркационные стенозы, извитость проксимальных сегментов, хронические окклюзии, малый диаметр сосуда и т.д.) [1, 12, 15, 23]. При таких особенностях поражения обычно требуются технически сложные приемы: проведение одновременно двух коронарных баллонов либо стентов, использование инструментов большего
диаметра, имплантация одновременно двух стентов и др. В подобных случаях современные эндоваскулярные технологии обеспечивают отличный непосредственный результат, однако могут оказывать травмирующее действие на интиму непораженных сегментов. К таким технологиям
относят применение крупных проводниковых катетеров с максимальной поддержкой (back-up) и суперселективной катетеризацией артерий, использование второго проводника при извитости сегмента, kissing-дилатация при бифуркационном стентировании и др. [12]. Подобные эндоваскулярные вмешательства в определенных участках сосуда (поворот, изгиб, плоская бляшка) приводят к микротравмам интимы, неразличимым при ангиографии. Такая поврежденная интима может стимулировать пролиферативные клеточные реакции, аналогичные механизму образования рестеноза [25—28], и формировать новые значимые стенозы в проксимальных участках крупных сосудов и стволе ЛКА.
В нашей работе у 19 (17%) больных наблюдалось быстрое развитие стеноза ствола ЛКА, отсутствовавшего до эндоваскулярного лечения. На связь с проведенной ранее эндоваскулярной процедурой косвенно указывает временной фактор: у большинства больных период, за который развился тяжелый рецидив болезни, составлял несколько месяцев. Преимущественное развитие этого осложнения было отмечено у больных с малым диаметром ствола ЛКА, использованием back-up
катетеров и применением технологии бифуркационного стентирования, а также с извитостью проксимального сегмента и малым диаметром сосуда. Это указывает на высокую вероятность травматического компонента как причины прогрессирования атеросклероза после эндоваскулярных вмешательств. Обращает внимание также большая доля больных, страдающих сахарным
диабетом, в этой группе.
Несмотря на то что наша работа ограничена небольшим количеством клинических наблюдений,
выявлена тенденция к агрессивному течению атеросклероза после эндоваскулярных вмешательств.
Мы убеждены, что необходимы крупные исследования, в том числе морфологические, позволяющие детально проанализировать механизмы прогрессирования атеросклероза у больных с рецидивом стенокардии после эндоваскулярного вмешательства.
Выводы
1. Среди больных, направленных на операцию коронарного шунтирования в связи с развитием рецидива коронарного синдрома после чрескожных коронарных вмешательств, бо`льшую часть составляют больные с прогрессированием стенотического процесса в нестентированных сегментах артерий, рестеноз в области стента составил 7% поражений.
2. Выявлена возможность быстрого прогрессирования коронарного атеросклероза в проксимальных
участках крупных артерий и развития «нового» стеноза ствола левой коронарной артерии, особенно у больных с диаметром ствола ее менее 3,5 мм, а также при повторных пластиках, использовании back-up катетеров и технологий с крупным диаметром эндоваскулярных инструментов.
3. Вероятность развития осложнений чрескожных коронарных вмешательств необходимо учитывать при первичном выборе тактики лечения больных с множественным и осложненным поражением коронарного русла, а также при показаниях к повторной реваскуляризации.



