В ряде исследований были получены свидетельства того, что рестеноз у пациентов, подвергшихся стентированию коронарных артерий (КА), связан с уровнем в крови конечных продуктов гликирования (КПГ), накопление которых в организме человека отмечается с возрастом и у больных сахарным диабетом – СД [1, 2]. Одним из объяснений существования подобной связи является то, что образование КПГ сопровождается изменением структуры белков, входящих в состав сосудистой стенки и приводящих к нарушению их функции [3]. Наряду с этим появилось множество свидетельств того, что взаимодействие КПГ с рецепторами к ним на поверхности клеточных мембран может приводить к нарушению функции клеток и способствовать возникновению разнообразных патологических процессов, включая рестеноз [4].
Данные, подтверждающие участие рецепторов к КПГ в возникновении рестеноза, были получены в экспериментах на животных, у которых развитие рестеноза предотвращалось блокадой взаимодействия рецепторов к КПГ с их лигандами с помощью растворимого рецептора к КПГ [5—7].
 Существует несколько изоформ рецептора к КПГ, которые могут быть продуктами альтернативного сплайсинга мРНК, кодирующих синтез полноценных рецепторов к КПГ, а также получаться в результате протеолитического отщепления внеклеточной части рецепторов к КПГ под действием ADAM-протеаз — семейства белковых пептидаз, отщепляющих внеклеточный фрагмент мембранных белков [8—12]. Одна из изоформ (esRAGE), образующаяся в результате альтернативного сплайсинга, а также другая изоформа (cRAGE), образующаяся в результате протеолитического отщепления внеклеточной части рецепторов к КПГ, являются растворимыми изоформами и обозначаются термином «растворимый рецептор к КПГ» (sRAGE). У обеих изоформ в отличие от полноценного рецептора к КПГ отсутствует трансмембранный и цитоплазматический домены. Растворимый рецептор к КПГ может выступать в качестве рецептора-ловушки для лигандов к рецептору к КПГ, тем самым блокируя взаимодействие лигандов с рецепторами к КПГ [13]. Результатом этого блокирования является предотвращение нежелательных последствий взаимодействия лигандов с рецепторами к КПГ.
Существует несколько изоформ рецептора к КПГ, которые могут быть продуктами альтернативного сплайсинга мРНК, кодирующих синтез полноценных рецепторов к КПГ, а также получаться в результате протеолитического отщепления внеклеточной части рецепторов к КПГ под действием ADAM-протеаз — семейства белковых пептидаз, отщепляющих внеклеточный фрагмент мембранных белков [8—12]. Одна из изоформ (esRAGE), образующаяся в результате альтернативного сплайсинга, а также другая изоформа (cRAGE), образующаяся в результате протеолитического отщепления внеклеточной части рецепторов к КПГ, являются растворимыми изоформами и обозначаются термином «растворимый рецептор к КПГ» (sRAGE). У обеих изоформ в отличие от полноценного рецептора к КПГ отсутствует трансмембранный и цитоплазматический домены. Растворимый рецептор к КПГ может выступать в качестве рецептора-ловушки для лигандов к рецептору к КПГ, тем самым блокируя взаимодействие лигандов с рецепторами к КПГ [13]. Результатом этого блокирования является предотвращение нежелательных последствий взаимодействия лигандов с рецепторами к КПГ.
Результаты ряда исследований позволили предложить определение уровня растворимого рецептора к КПГ для оценки риска развития сердечно-сосудистых осложнений, в том числе рестеноза после стентирования КА [14]. Однако эти исследования немногочисленны, а их результаты носят противоречивый характер.
Целью настоящего исследования была оценка связи между уровнем растворимого рецептора к КПГ и возникновением рестеноза у больных стенокардией, подвергшихся стентированию КА с помощью стентов с лекарственным покрытием.
Материал и методы
Под наблюдением находились 126 мужчин и женщин с хроническими формами ИБС в возрасте от 40 до 75 лет, которым в течение первого года после имплантации коронарных стентов с лекарственным покрытием была проведена коронарография (КГ).
В исследование не включали пациентов с нестабильной стенокардией, в первые 2 мес после перенесенного инфаркта миокарда, с острым нарушением мозгового кровообращения, операцией коронарного шунтирования в анамнезе, ангиопластикой по поводу рестеноза в анамнезе, снижением фракции выброса левого желудочка менее 40%, застойной сердечной недостаточностью, повышением уровня креатинина в крови более 150 мкмоль/л, системными заболеваниями (ревматизм, ревматоидный артрит и др.), клиническими и лабораторными признаками острого инфекционного заболевания, тяжелыми хроническими заболеваниями (онкологические, гематологические и др.).
По результатам КГ, пациенты были разделены на 2 группы. В 1-ю группу вошли 53 больных, у которых возник рестеноз, во 2-ю группу — 73 пациента без рестеноза. У пациентов обеих групп было проведено сравнение клинической и ангиографической характеристик (число пораженных магистральных артерий, окклюзий, бифуркационных стенозов, протяженных стенозов, артерий малого диаметра).
гемоглобинассоциированные макрофаги Всем пациентам было проведено измерение уровня растворимого рецептора к КПГ, а также сопоставление его уровня у пациентов с рестенозом и без рестеноза.
При определении уровня растворимого рецептора к КПГ кровь для исследования брали перед КГ из локтевой вены утром натощак после 12-часового голодания в пробирку S-Monovette EDTA KE, SARSTEDT. Для получения плазмы образец крови, стабилизированный ЭДТА, центрифугировали в течение 15 мин при температуре 4 °C при 2500 оборотах. Плазму отбирали в отдельные микропробирки и хранили при температуре -70 °С. Определение уровня растворимого рецептора к КПГ в плазме крови проводили методом иммуноферментного анализа (ELISA) с использованием наборов для растворимого рецептора к КПГ («R&D Systems», США). Измерение проводили на микропланшетном фотометре Sunrise («Tecan», Австрия). Чувствительность метода при измерении уровня растворимого рецептора к КПГ составляла 16,14 пг/мл, а диапазон измерений – 78—5000 пг/мл.
 Статистический анализ проведен с помощью программного пакета Statistica 6. Собранные в ходе исследования количественные данные при нормальном распределении представлены в виде среднего значения и стандартного отклонения, при распределении, отличном от нормального, в виде медианы, 25-го и 75-го процентилей. Для проверки статистических гипотез о виде распределения использовали W-тест Шапиро—Уилка. Для сравнительного анализа данных, полученных в двух группах, использовали точный критерий Фишера и U-критерий Манна—Уитни. Связь изучаемых показателей с возникновением рестеноза оценивали методом бинарной логистической регрессии. Различия считали статистически значимыми при p<0,05. Для оценки клинической значимости исследуемых показателей в прогнозировании развития рестеноза использовали показатель AUC (площадь под ROC-кривой).
Статистический анализ проведен с помощью программного пакета Statistica 6. Собранные в ходе исследования количественные данные при нормальном распределении представлены в виде среднего значения и стандартного отклонения, при распределении, отличном от нормального, в виде медианы, 25-го и 75-го процентилей. Для проверки статистических гипотез о виде распределения использовали W-тест Шапиро—Уилка. Для сравнительного анализа данных, полученных в двух группах, использовали точный критерий Фишера и U-критерий Манна—Уитни. Связь изучаемых показателей с возникновением рестеноза оценивали методом бинарной логистической регрессии. Различия считали статистически значимыми при p<0,05. Для оценки клинической значимости исследуемых показателей в прогнозировании развития рестеноза использовали показатель AUC (площадь под ROC-кривой).
Результаты
В исследование вошли 126 больных хроническими формами ИБС, которым было имплантировано 217 стентов, покрытых лекарственным препаратом. По результатам ангиографического исследования, проведенного через 6—12 мес после стентирования КА, пациенты были разделены на две группы. В 1-ю группу вошли 53 больных, у которых в течение первого года после стентирования был отмечен рестеноз в месте установки, по крайней мере, одного стента, 2-ю группу составили 73 пациента, у которых рестеноз не возник.Пациенты с рестенозом и больные без рестеноза на момент осуществления коронарного стентирования не отличались по возрасту, соотношению мужчин и женщин, курящих и некурящих, а также наличию гиперлипидемии (табл. 1). Число больных стенокардией I—IV функционального класса (ФК) было сопоставимым в обеих группах. Одинаковое число пациентов имели постинфарктный кардиосклероз и артериальную гипертонию. Пациенты с рестенозом по сравнению с пациентами без рестеноза чаще страдали СД 2-го типа — соответственно в 57 и 34% случаев (р=0,01).
Ангиографическая характеристика больных представлена в табл. 2. Число стентов, которое в среднем было имплантировано одному пациенту с рестенозом, составило 2,0±0,8, что было больше, чем у пациентов без рестеноза, которым в среднем было имплантировано 1,5±0,8 стента одному пациенту (р=0,001). У больных обеих групп одинаково часто осуществляли стентирование передней нисходящей (ПНА), огибающей (ОА) и правой коронарной артерии (ПКА), а также окклюзий и протяженных (>20 мм) стенозов. У пациентов с рестенозом по сравнению с пациентами без рестеноза чаще осуществляли стентирование артерий малого (≤2,75 мм) диаметра — соответственно в 55 и 29% случаев (р=0,003).
Уровень растворимого рецептора к КПГ в крови больных, у которых развился рестеноз после имплантации стентов, покрытых лекарственным препаратом, оказался значительно ниже, чем в крови пациентов без рестеноза (рис. 1).
У пациентов с рестенозом медиана (25-й процентиль; 75-й процентиль) уровня растворимого рецептора к КПГ в плазме крови составила 1149 (925; 1443) пг/мл, в то время как в крови пациентов без рестеноза — 1458 (1121; 1727) пг/мл (p<0,001). Однако различие по уровню растворимого рецептора к КПГ в крови больных с рестенозом и у пациентов без рестеноза было обусловлено различием уровня растворимого рецептора к КПГ у больных СД с рестенозом и у пациентов с СД без рестеноза (рис. 2). У больных СД с рестенозом медиана уровня растворимого рецептора к КПГ в плазме крови составила 1083 (914; 1194) пг/мл, в крови пациентов с СД без рестеноза — 1268 (993; 1581) пг/мл (p=0,04). Различия по уровню растворимого рецептора к КПГ в крови пациентов с рестенозом и без рестеноза, не имевших СД, не были выявлены. Медиана (25-й процентиль; 75-й процентиль) уровня растворимого рецептора к КПГ в крови пациентов без СД с рестенозом и у пациентов без СД и без рестеноза составила соответственно 1432 (948; 1748) и 1485 (1290; 1735) пг/мл (р>0,05).
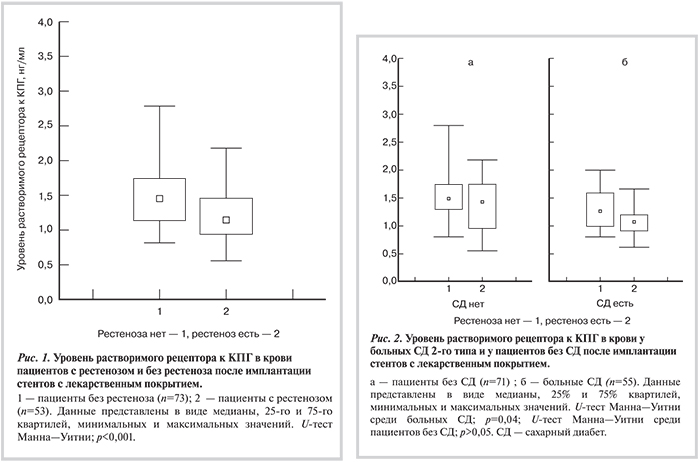
Согласно результатам ROC-анализа, при равной точке отсечения уровня растворимого рецептора к КПГ 1205 пг/мл у больных СД достигается оптимальное сочетание чувствительности и специфичности: 56 и 77% соответственно (рис. 3, а). ROC-анализ не подтвердил диагностическую ценность уровня растворимого рецептора к КПГ как фактора риска рестеноза у пациентов без СД (рис. 3, б). Площадь под ROC-кривой 0,59±0,08 (при 95% доверительном интервале — ДИ от 0,44 до 0,75; р=0,21).
 Факторами риска рестеноза, согласно результатам логистического регрессионного анализа, являлись в порядке убывания: стентирование артерий малого (≤2,75 мм) диаметра (отношение шансов — ОШ 3 при 95% ДИ от 1,43 до 6,29; р=0,004), СД (ОШ 2,54 при 95% ДИ от 1,21 до 5,18; р=0,013), число одномоментно имплантированных одному больному стентов (ОШ 1,63 при 95% ДИ от 1,19 до 2,23; р=0,002) и уровень растворимого рецептора к КПГ в крови (ОШ 0,2 при 95% ДИ от 0,07 до 0,54; р=0,002) (табл. 3).
Факторами риска рестеноза, согласно результатам логистического регрессионного анализа, являлись в порядке убывания: стентирование артерий малого (≤2,75 мм) диаметра (отношение шансов — ОШ 3 при 95% ДИ от 1,43 до 6,29; р=0,004), СД (ОШ 2,54 при 95% ДИ от 1,21 до 5,18; р=0,013), число одномоментно имплантированных одному больному стентов (ОШ 1,63 при 95% ДИ от 1,19 до 2,23; р=0,002) и уровень растворимого рецептора к КПГ в крови (ОШ 0,2 при 95% ДИ от 0,07 до 0,54; р=0,002) (табл. 3).
Обсуждение
Рестеноз остается одной из основных проблем у больных, подвергшихся ангиопластике КА. В связи с этим выявление клеточных механизмов рестеноза является важной задачей, так как их понимание способствует разработке способов предотвращения этого неблагоприятного явления. В последние годы были получены свидетельства того, что рестеноз может быть связан с избыточным образованием в организме КПГ [1, 2].
В экспериментах на животных было показано, что рестеноз может быть предотвращен блокадой рецепторов к КПГ с помощью растворимого рецептора к КПГ [5—7]. Кроме того, результаты ряда исследований позволили предложить определение уровня растворимого рецептора к КПГ для прогнозирования рестеноза после стентирования КА [14]. Согласно результатам настоящего исследования, более низкий уровень растворимого рецептора к КПГ в плазме крови у больных ИБС сопровождается более частым развитием рестеноза после имплантации стентов с лекарственным покрытием. Однако различие по уровню растворимого рецептора к КПГ в крови пациентов с рестенозом и без рестеноза было обусловлено различием уровней растворимого рецептора к КПГ у больных обеих групп, имевших СД. У пациентов без СД подобного различия по уровню растворимого рецептора к КПГ обнаружено не было.
Результаты исследований, касающиеся как связи между уровнем растворимого рецептора к КПГ и развитием рестеноза после стентирования КА, так и уровня растворимого рецептора к КПГ у больных СД 2-го типа по сравнению с пациентами без СД, носят противоречивый характер. Сообщается как о более высоком [15], так и о более низком уровне [16] растворимого рецептора к КПГ у больных СД по сравнению с пациентами без СД. Согласно результатам исследования Y. Shen и соавт., более низкий уровень растворимого рецептора к КПГ связан с менее благоприятными клиническими результатами коронарного стентирования у пациентов с СД 2-го типа [17]. Аналогичные данные были получены в другом исследовании [18]. Однако в исследовании H.J. Park и соавт. была выявлена прямая связь между уровнем растворимого рецептора к КПГ и возникновением рестеноза у больных СД 2-го типа [19].
В отличие от настоящего исследования E.D. McNair и соавт. в исследовании, в которое не были включены пациенты с СД, обнаружили различие по уровню растворимого рецептора к КПГ в крови у пациентов с рестенозом и у пациентов без рестеноза [14]. В это проспективное исследование вошли больные инфарктом миокарда без подъема сегмента ST.
Пациенты подверглись стентированию КА с помощью стентов без лекарственного покрытия. Больные, у которых возник рестеноз, имели более низкий уровень растворимого рецептора к КПГ в крови по сравнению с пациентами, у которых рестеноз не развился.
Полученные в настоящем исследовании данные свидетельствуют об участии растворимого рецептора к КПГ в формировании рестеноза у больных СД 2-го типа. Однако определение его уровня в крови больных для прогнозирования риска рестеноза не представляется целесообразным в связи с недостаточно высокой чувствительностью и специфичностью точки отсечения уровня растворимого рецептора к КПГ, согласно результатам проведенного ROC-анализа.
По данным логистического регрессионного анализа, более важными, чем низкий уровень растворимого рецептора к КПГ, факторами риска рестеноза являются стентирование артерий малого (≤2,75 мм) диаметра, СД и число одномоментно имплантированных одному больному стентов.
Выводы
Возникновение рестеноза у больных хроническими формами ишемической болезни сердца и сопутствующим сахарным диабетом 2-го типа, подвергшихся стентированию коронарных артерий с помощью стентов с лекарственным покрытием, связано с уровнем растворимого рецептора к конечным продуктам гликирования в крови. Обнаружение подобной связи позволяет предположить участие избыточного образования конечных продуктов гликирования у больных этой категории в патогенезе рестеноза.



