В Российской Федерации, по данным Государственного регистра, зарегистрировано 3 млн 779 тыс. больных сахарным диабетом (СД), из них 325 тыс. — пациенты с СД 1-го типа и 3 млн 453 тыс. — пациенты с СД 2-го типа [1]. Однако исследования показывают, что фактическая распространенность СД больше регистрируемой в 3,1 раза у больных в возрасте 30—39 лет, в 4,1 раза — в возрасте 40—49 лет, в 2,2 раза — у 50—59-летних и в 2,5 раза — у 60—69-летних [1]. По прогнозам, к 2025 г. число больных СД увеличится в 2 раза, а к 2030 г., по расчетам Международной федерации диабета, с этим диагнозом будет 500 млн человек [1].
В индустриально развитых странах СД находится на 4-м месте в рейтинге наиболее частых причин смерти. Каждый год от осложнений СД, прежде всего сердечно-сосудистых, умирают 3,8 млн человек [1]. У больных СД смертность от болезней сердца и инсульта в 2—3 раза выше, чем у пациентов без СД [1]. У больных с СД повышен риск развития хронической почечной недостаточности и ретинопатии [1].
По данным ряда исследователей, до 75% осложнений СД со стороны сердечно-сосудистой системы или почек связаны с артериальной гипертонией (АГ) [2]. АГ наблюдается у лиц, страдающих СД, в 2 раза чаще, чем у других групп людей [3]. Большое значение в развитии обоих заболеваний имеют образ жизни и наследственность. АГ способствует также развитию диабетической ретинопатии — основной причины слепоты [3].
При сочетании у одного больного СД и АГ риск развития ишемической болезни сердца повышается в 2—4 раза, инсульта — в 2—3 раза, полной потери зрения в 10—25 раз, уремии — в 15—20 раз, гангрены нижних конечностей — в 20 раз [4]. Исходя из изложенного, АГ у больных с СД должна быть как можно раньше диагностирована и ее следует активно лечить.
Целевые уровни артериального давления (АД) у больных с СД. Снижение АД сопровождается заметным уменьшением числа сердечно-сосудистых осложнений (ССО), что было установлено: 1) у больных СД, которые входили в ряд исследований [5—9]; 2) в 2 исследованиях, целиком посвященных именно этим больным [10, 11]; 3) в недавно опубликованном мета-анализе [12]. В 2 исследованиях [7, 11] положительный эффект отмечался при снижении диастолического АД (ДАД) до 80—85 мм рт.ст., в то время как ни в одном из исследований систолическое АД (САД) не снижалось менее 130 мм рт.ст. Единственным исследованием у больных СД, в котором в группе интенсивной терапии были достигнуты уровни САД чуть ниже 130 мм рт.ст., было исследование ABCD у больных с нормальным АД — небольшое исследование, в котором не было получено стойкого уменьшения числа ССО (они были лишь вторичной конечной точкой) [13]. В более крупном исследовании ACCORD (хотя его статистическая мощность была недостаточной) не удалось выявить значительного уменьшения частоты развития основных ССО у больных СД при снижении САД до среднего уровня 119 мм рт.ст. в группе интенсивного снижения АД по сравнению с таковой при среднем уровне САД 133 мм рт.ст. (контрольная группа) [14].
В связи с этим в Европейских рекомендациях по диагностике и лечению АГ (2013 г.) постулируется, что больным СД рекомендуется целевой уровень САД менее 140 мм рт.ст. (класс рекомендации и уровень доказанности IА), а целевой уровень ДАД — менее 85 мм рт.ст. (IА) [15].
Медикаментозная антигипертензивная терапия (АГТ) у больных с СД. Доказано, что начинать медикаментозную АГТ необходимо у всех больных АД со средним САД >160 мм рт.ст. (IА) [15]. При этом медикаментозная АГТ также настоятельно рекомендуется больным СД с уровнем САД >140 мм рт.ст. (IА) [15]. Сравнение снижения частоты развития ССО в разных исследованиях указывает на то, что при одинаковой разнице САД польза от более интенсивного снижения САД постепенно уменьшается, если эта разница в САД находится у нижней границы диапазона 139—130 мм рт.ст. [16]. На основании имеющихся данных предполагается отсутствие дальнейшего увеличения пользы при снижении АД ниже 130 мм рт.ст. [17—19].
У больных с СД и нормальным АД прежде всего следует помнить о том, что при СД нередко отмечается маскированная АГ [20]. Поэтому больным СД с кажущейся нормотонией необходимо проведение суточного амбулаторного мониторирования АД. Если мы все-таки имеем дело с больным СД, но без АГ, необходимо знать, что в общей популяции четких доказательств преимуществ от начала АГТ при уровнях САД <140 мм рт.ст. (высокое нормальное АД: 130—139/85—89 мм рт.ст.) не существует [15]. Это обусловлено отсутствием соответствующих исследований, в которых эти вопросы изучались бы надлежащим образом. Остается также неясным, нужно ли начинать лечение раньше и выбирать более низкие целевые уровни АД при диабетических микроангиопатиях (нефропатии, ретинопатии, нейропатии). Установлено, что АГТ может отсрочить развитие или уменьшить выраженность микроальбуминурии (МАУ), но исследования у больных СД и с нормальным АД не смогли убедительно продемонстрировать, что уменьшение протеинурии сопровождается также снижением жестких сердечно-сосудистых конечных точек. [10, 13, 21].
Выбор антигипертензивного препарата (АГП) у больных СД. АГП у больных СД следует выбирать с учетом их эффективности и переносимости. При выборе лекарственного средства для конкретного пациента врач должен учитывать, безусловно, и сопутствующие заболевания, чтобы индивидуализировать терапию [15]. Поскольку пациенты с СД и АГ имеют высокий или очень высокий риск развития осложнений [15], достигнуть целевых уровней АД при СД труднее [22], именно комбинированная АГТ необходима и целесообразна, в том числе в качестве начальной, при лечении больных с СД и АГ [15].
Предпочтительны блокаторы ренин-ангиотензиновой системы (РАС) — ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов к ангиотензину II, особенно при наличии протеинурии или МАУ (IА) [15]. Однако следует избегать назначения двух блокаторов РАС одновременно (включая ингибитор ренина алискирен) больным из группы высокого риска, так как это ухудшает исходы, как показали исследования ALTITUDE и ONTARGET [23, 24]. Можно использовать тиазидные и тиазидоподобные диуретики в комбинации с блокаторами РАС [15]. Доказана польза антагонистов кальция, особенно в комбинации с блокатором РАС [15]. Хотя некоторые β-адреноблокаторы потенциально ухудшают чувствительность к инсулину, они являются полезной составляющей комбинированной терапии для контроля АД, особенно если у больного СД имеется также ишемическая болезнь сердца или сердечная недостаточность [15].
Следовательно, пациенты с СД и АГ нуждаются в назначении комбинированной АГТ ингибитором АПФ или блокаторами рецепторов к ангиотензину II в сочетании либо с тиазидным или тиазидоподобным диуретиком, либо с антагонистом кальция.
Наиболее яркие и клинически значимые результаты были достигнуты в исследовании ADVANCE [10]. Основной целью этого исследования было изучение раздельного и совместного влияния интенсивной АГТ и интенсивной сахароснижающей терапии на риск развития макро- и микрососудистых осложнений СД 2-го типа. Особенностью исследования ADVANCE является то, что в него включали больных СД независимо от наличия АГ. Критериями включения были также диагноз СД, впервые установленный в возрасте 30 лет и старше; возраст >55 лет; повышенный риск развития сердечно-сосудистых заболеваний, определяемый по наличию как минимум одного из перечисленных ниже признаков:
- макрососудистое заболевание в анамнезе,
- микрососудистое заболевание в анамнезе,
- длительность СД >10 лет,
- другие факторы риска развития сосудистых заболеваний (курение, уровень общего холестерина крови >6,0 ммоль/л, уровень холестерина липопротеидов высокой плотности <1,0 ммоль/л или МАУ),
- возраст >65 лет.
Рандомизации предшествовал период плацебо продолжительностью 6 нед, во время которого всем пациентам к назначенной терапии добавляли препарат нолипрел (фиксированная комбинация периндоприла 2 мг и индапамида 0,625 мг). Этот период плацебо был проведен для оценки переносимости данной фиксированной комбинации и приверженности пациентов к лечению. Более 11 тыс. больных, успешно завершивших вводный период, были рандомизированы в группу приема нолипрела или плацебо [10].

В результате исследования, период наблюдения в котором составил в среднем 4,3 года, у пациентов, которые принимали нолипрел, уровень САД и ДАД в среднем был достоверно (p<0,001) ниже соответственно на 5,6 и на 2,2 мм рт.ст. по сравнению с таковым у больных в группе плацебо. Средний уровень АД в группе нолипрела снизился со 145/81 мм рт.ст. исходно до 136/74 мм рт.ст. на последнем визите, а в группе плацебо — со 145/81 мм рт.ст. до 140/75 мм рт.ст. [10].
Главным результатом исследования ADVANCE было то, что лечение нолипрелом больных СД 2-го типа обеспечило достоверное снижение риска смерти от всех причин на 14% (408 случаев, или 7,3% в группе активного лечения; 471 случай, или 8,5% в группе плацебо; р=0,03) и от сердечно-сосудистых причин на 18% (211 случаев, или 3,8% в группе активного лечения; 257 случаев, или 4,6% в группе плацебо; р=0,03). Кроме того, было выявлено, что относительный риск развития главных макро- и микрососудистых ССО (первичная конечная точка) достоверно снизился на 9% (15,5% в группе активного лечения против 16,8%, в группе плацебо; отношение рисков — ОР 0,91 при 95% доверительном интервале — ДИ от 0,83 до 1,00; р=0,04). Кроме того, в группе нолипрела достоверно ниже был риск развития коронарных осложнений (на 14%; р=0,02) и почечных осложнений (на 21%; р<0,0001) в основном за счет снижения риска развития МАУ (на 21%; р<0,0001). При этом эффект лечения не зависел от исходного уровня АД и используемой до включения в исследование терапии. Участники исследования получали современную профилактическую терапию другими (не антигипертензивными) препаратами без достоверных различий между группами нолипрела и плацебо [10]. Все перечисленное свидетельствует, что именно нолипрел оказал специфическое влияние на смертность и риск развития осложнений.
Для оценки долгосрочных эффектов проведенной терапии нолипрелом было инициировано исследование ADVANCE-ON [25]. Из всех участников исследования ADVANCE 8494 пациента продолжили лечение и наблюдение в исследовании ADVANCE-ON. Их средний возраст составил 65,5 года, 43% – женщины. Первый визит наблюдательного исследования ADVANCE-ON состоялся в среднем (медиана) через 3,5 года после завершения рандомизированной «антигипертензивной» части ADVANCE. Исходные характеристики больных, которые приняли участие в исследовании ADVANCE-ON, не отличались от общей когорты участников ADVANCE. Для понимания полученных результатов необходимо уточнить, что во время наблюдения в рамках исследования ADVANCE-ON пациенты вернулись к своим лечащим врачам и могли получать любую АГТ. Никаких попыток влиять на дальнейшую терапию участников не было. Медиана длительности наблюдения в наблюдательном исследовании ADVANCE-ON составила 5,4 года; с учетом медианы длительности наблюдения в «антигипертензивной» части рандомизированного исследования ADVANCE (4,4 года), в целом период наблюдения достигал 9,9 года. После завершения наблюдательной части в живых остались 7279 пациентов; у 5131 из них был выполнен последний визит, во время которого измеряли уровни гликированного гемоглобина, глюкозы в сыворотке натощак и креатинина, АД и отношение альбумин/креатинин в моче [25].
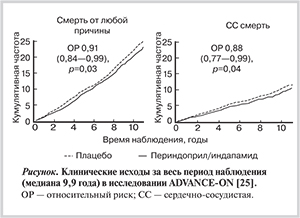
Анализ 10 лет наблюдения ADVANCE-ON показал, что именно в группе пациентов, принимавших с самого начала исследования нолипрел форте, риск смерти от всех причин был достоверно ниже на 9% (ОР 0,91; р=0,03), смерти от ССЗ — на 12% (ОР 0,88; р=0,04) (см. рисунок). Риск развития макрососудистых осложнений в группе, получавшей нолипрел, также был ниже, чем в группе стандартного лечения (р=0,06) [25].
Необходимо напомнить, что в период рандомизированного исследования ADVANCE относительный риск смерти от любой причины снизился в большей степени — на 14% (0,86 при 95% ДИ от 0,75 до 0,98; р=0,03). Риск смерти от сердечно-сосудистой причины был на 18% ниже у пациентов, получавших нолипрел (0,82 при 95% ДИ от 0,68 до 0,98; р=0,03) [10]. Следовательно, благоприятные влияния на прогноз в группе нолипрела сохранились, хотя и были выражены в меньшей степени в течение 6 лет после завершения исследования. Важно обратить внимание, что этот благоприятный эффект отмечался во всех подгруппах, выделенных в соответствии с протоколом, в том числе в зависимости от стратегии контроля гликемии. Если проанализировать отдельно только годы ADVANCE-ON, мы обнаружим, что риск смерти от всех причин на этом временно'м отрезке между группами не различался (см. таблицу), т.е. основной эффект в отношении снижения общей смертности был достигнут в ходе рандомизированной части наблюдения (ADVANCE), но сохранялся и в период наблюдения [10, 25].
Для понимания полученных результатов необходимо вспомнить, что в рандомизированной части (ADVANCE) согласно протоколу (нолипрел по сравнению с плацебо) уровень САД и ДАД в среднем был достоверно (p<0,001) соответственно на 5,6 и на 2,2 мм рт.ст. ниже, чем у больных в группе плацебо. Это во многом объясняет разницу между группами по общей, сердечно-сосудистой смертности, макрососудистым осложнениям и почечным исходам [10]. В течение всех 6 лет дополнительного наблюдения (ADVANCE-ON) в условиях клинической практики пациенты обеих групп — активной терапии и контрольной — сохраняли жесткий контроль АД на уровне 137/75 мм рт.ст., и их уровни АД полностью совпадали [25]. В ситуации равного уровня АД неудивительно отсутствие различий по влиянию на исходы отдельно в период последующего наблюдения. Это еще раз подчеркивает необходимость снижения АД до рекомендуемого целевого уровня — главной задачи АГТ [15]. Удивительно другое — то, что благоприятное влияние на прогноз, полученное в ходе активного антигипертензивного лечения нолипрелом, не исчезло в последующие 6 лет, как было, например, в исследовании UKPDS (United Kingdom Prospective Diabetes Study) [26, 27]. Каким образом удалось этого добиться? К обсуждению этого вопроса вернемся чуть позже. Прежде всего, следует подчеркнуть, что наблюдаемое постепенное уменьшение (потеря) благоприятного влияния терапии нолипрелом свидетельствует в пользу длительного («неопределенного долгого») приема современных АГП с доказанным влиянием на прогноз.
 Итак, попробуем понять, за счет каких уникальных свойств фиксированная комбинация нолипрел обеспечила сохранение благоприятного влияния на прогноз в течение последующих 6 лет при выравнивании уровня АД между группами и при том, что частота приема данной фиксированной комбинации в наблюдательной части исследования составила при первом визите всего 9,4% в группе больных, получавших активную терапию в рандомизированной части, и мало отличалась от таковой в первоначальной группе плацебо (8%). Возможным объяснением полученных долгосрочных преимуществ может быть улучшение структуры микро- и макрососудистого русла, сердца и других органов-мишеней под влиянием терапии нолипрелом форте в той группе, которая принимала данную комбинацию с самого начала исследования ADVANCE.
Итак, попробуем понять, за счет каких уникальных свойств фиксированная комбинация нолипрел обеспечила сохранение благоприятного влияния на прогноз в течение последующих 6 лет при выравнивании уровня АД между группами и при том, что частота приема данной фиксированной комбинации в наблюдательной части исследования составила при первом визите всего 9,4% в группе больных, получавших активную терапию в рандомизированной части, и мало отличалась от таковой в первоначальной группе плацебо (8%). Возможным объяснением полученных долгосрочных преимуществ может быть улучшение структуры микро- и макрососудистого русла, сердца и других органов-мишеней под влиянием терапии нолипрелом форте в той группе, которая принимала данную комбинацию с самого начала исследования ADVANCE.
Можно считать установленным, что у больных АГ как с наличием СД, так и без СД МАУ является предиктором ССО, поскольку эта закономерность была выявлена в целом ряде исследований [28—30]. В нескольких исследованиях описана непрерывная связь между сердечно-сосудистой и несердечно-сосудистой смертностью, с одной стороны, и отношением альбумина к креатинину мочи, с другой [30]. У больных АГ, в том числе при наличии СД, одновременное увеличение экскреции белка с мочой и снижение скорости клубочковой фильтрации указывают на еще больший риск развития ССО и почечных осложнений, чем каждый маркер в отдельности; таким образом, эти факторы риска являются независимыми и кумулятивными [31, 32].
В специальном анализе исследования ADVANCE было выявлено, что у пациентов с СД 2-го типа АГТ фиксированной комбинацией нолипрел позволяет не только снизить темпы прогрессирования поражения почек, но даже вызвать его обратное развитие [33]. Так, на фоне лечения нопипрелом по сравнению с плацебо уменьшение риска прогрессирования МАУ в протеинурию составило 31% (p<0,003), риска прогрессирования альбуминурии на 1 стадию и более — 22% (p<0,0001). Это свидетельствует о способности такого режима терапии тормозить прогрессирование поражения почек у больных с СД. Более того, на фоне лечения нолипрелом отмечено уменьшение альбуминурии на 16% (p<0,002) и восстановление функции почек на 15% (p<0,007) [33]. Данные результаты вселяют оптимизм: сегодня благодаря современным АГП стало реальным добиваться обратного развития поражений органов-мишеней.
Мощные нефропротективные свойства фиксированной комбинации нолипрел, превосходящие таковые у ингибитора АПФ эналаприла, выявлены ранее в исследовании PREMIER [34]. В этом международном многоцентровом рандомизированном двойном слепом исследовании сравнивали влияние комбинированной терапии периндоприлом и индапамидом, а также монотерапии эналаприлом на скорость экскреции альбумина (СЭА) с мочой у больных с СД 2-го типа, альбуминурией и АГ. В нем принял участие 481 больной СД 2-го типа, с САД от 140 до 180 мм рт.ст. и ДАД <110 мм рт.ст., возраст больных составлял 59±9 лет; 77% из них ранее получали гипотензивную терапию. В группе комбинированной терапии периндоприлом и индапамидом максимальные дозы составили соответственно 8 и 2,5 мг, а максимальная доза эналаприла — 40 мг. В группе комбинированной терапии периндоприлом и индапамидом по сравнению с группой монотерапии эналаприлом выявлено статистически значимое снижение АД (различие по уровню САД –3,0 при 95% ДИ от −5,6 до –0,4; p=0,012, а по уровню ДАД — −1,5 при 95% ДИ от –3,0 до –0,1) и СЭА (на 42% при 95% ДИ от 33 до 50% и на 27% при 95% ДИ от 16 до 37% соответственно). Более выраженное снижение СЭА сохраняло статистическую значимость даже после стандартизации с учетом среднего АД. Полученные результаты позволили сделать вывод о том, что начальная комбинированная терапия низкими дозами периндоприла и индапамида снижает выраженность альбуминурии в большей степени, чем монотерапия эналаприлом, и данный эффект отчасти не зависит от снижения АД.
Но возможности нолипрела не исчерпываются больными, у которых есть поражение почек. Даже если у пациента с СД нет МАУ, терапия данной фиксированной комбинацией позволяет снизить риск ее возникновения. Это также было доказано при упоминаемом специальном анализе исследования ADVANCE [33]. На протяжении данного рандомизированного исследования снижение риска развития новых случаев МАУ в группе нолипрела составило –21% (p<0,001), что также оказало влияние на прогноз этих пациентов. Этот результат чрезвычайно важен для реальной клинической практики. Ведь если назначение препаратов с органопротективными свойствами не вызывает никаких сомнений в случае наличия у пациента соответствующего поражения органа-мишени, то у больных без поражений органов-мишеней создавалось впечатление о возможности выбора любого АГП, в том числе и без органопротективных свойств. Данные результаты исследования ADVANCE свидетельствуют о необходимости назначения АГП с органопротективными свойствами всем больным АГ, независимо от наличия или отсутствия у них поражения органов-мишеней.
Наиболее характерным поражением сердца как органа-мишени АГ является гипертрофия миокарда левого желудочка (ГМЛЖ) [15]. Доказано, что ее формирование у пациентов с АГ ассоциируется с увеличением риска развития ССЗ и смертности по сравнению с таковым у больных без ГМЛЖ [35]. Так, ГМЛЖ, особенно концентрическая, сопровождается риском развития ССО более 20% в ближайшие 10 лет (т.е. высоким риском развития ССО) [36].
В рандомизированных сравнительных исследованиях было установлено, что при одинаковом снижении АД ингибиторы АПФ, блокаторы рецепторов к ангиотензину II и антагонисты кальция более эффективны, чем β-адреноблокаторы, в плане регресса ГМЛЖ [37]. Поэтому согласно российским и европейским рекомендациям ингибиторы АПФ являются одной из приоритетных групп препаратов при наличии у больного ГМЛЖ [15]. Возможности фиксированной комбинации нолипрел в регрессе ГМЛЖ также хорошо изучены в рамках исследования PIXEL [38]. Результаты исследования PIXEL показывают, что уменьшение ГМЛЖ под влиянием нолипрела было в 3 раза эффективнее, чем при лечении эналаприлом. В исследовании сравнивались степень регресса ГМЛЖ у больных АГ на фоне длительного (до 1 года) приема периндоприла/индапамида или эналаприла. Были включены 679 пациентов в возрасте старше 18 лет с эссенциальной АГ. При этом различие по динамике АД между группами оказалось не столь значительным, как различие степени регресса ГМЛЖ. Индекс массы миокарда левого желудочка (ИММЛЖ) через 1 год снизился на 13,6 г/м2 в группе нолипрела и всего на 3,9 г/м2 в группе эналаприла. Почти на 2/3 этот эффект достигался через 24 нед после начала лечения. При этом у 170 пациентов существенная положительная динамика АД отсутствовала, но в этих подгруппах ИММЛЖ уменьшился на 11,4 и 2,3 г/м2 соответственно для группы нолипрела и группы эналаприла. Обращает внимание, что регресс ГМЛЖ у пациентов, не реагирующих на лечение нолипрелом, был более выраженным, чем у пациентов, у которых терапия эналаприлом привела к существенному снижению АД. Полученные результаты свидетельствуют о наличии у нолипрела независимого от снижения АД кардиопротективного эффекта [37]. И хотя в исследовании ADVANCE динамика ИММЛЖ не оценивалась, можно с большой долей вероятности утверждать, что способность нолипрела уменьшать ГМЛЖ внесла вклад как в снижение риска смерти и развития осложнений в рандомизированной части исследования, так и в сохранение положительного влияния на прогноз на протяжении последующего наблюдения в исследовании ADVANCE-ON. Таким образом, главным возможным объяснением полученных долгосрочных преимуществ терапии нолипрелом являются его органопротективные свойства.
Влияние на общую и сердечно-сосудистую смертность оказала также разная продолжительность периода достижения целевого уровня АД в группах в рандомизированной части исследования [10]. Так, пациенты в группе нолипрела достигли оптимальных уровней АД как минимум на 2,9 года раньше, чем больные в группе плацебо. Этот факт также очень важен для клинической практики, поскольку свидетельствует, что чем раньше будет достигнуто целевое АД, тем лучше будет долгосрочный прогноз. Следует еще раз подчеркнуть, что, согласно современным рекомендациям [15], пациенты с АГ высокого риска, к которым относятся больные с сопутствующим СД, уже в начале лечения нуждаются в назначении комбинированной АГТ именно в связи с более быстрым достижением целевого уровня АД и усилением органопротективных свойств.
Что еще «поражает» в исследовании ADVANCE-ON? Огромный разрыв между клиническими рекомендациями и реальной клинической практикой. Так, во время первого визита в рамках ADVANCE-ON 39% больных не принимали АГП (!), 23% больных принимали один АГП [25]. И это пациенты из группы очень высокого риска, с СД, каждый третий из которых в анамнезе имел ССО! Напомним, что исследование проходило в 215 центрах 20 стран мира, в том числе России, Великобритании, Франции, Австралии, Германии [10]. С грустью приходится констатировать, что при наличии схем лечения, улучшающих прогноз у больных с АГ и СД, они не применяются в клинической практике в должном объеме.
Итак, подведем итоги: какие уроки мы можем извлечь из исследований ADVANCE и ADVANCE-ON? Во-первых, важность достижения целевых уровней АД у больных с АГ и СД. Во-вторых, важность назначения фиксированных комбинаций АГП на самых первых этапах лечения таких больных. Это позволит быстрее достигнуть целевого уровня АД и более надежно удерживать достигнутый целевой уровень, что обеспечивает достоверно меньшую общую и сердечно-сосудистую смертность на протяжении фактически 10 лет. В-третьих, важность выбора АГП с органопротективными свойствами всем пациентам с АГ и СД, независимо от того, имеются ли у них поражения органов-мишеней, поскольку органопротекция обеспечивает долгосрочное влияние на смертность. В-четвертых, как это ни покажется банальным, у больных из группы высокого и очень высокого риска никакие перерывы в приеме АГП не допустимы, поскольку это нивелирует или в лучшем случае уменьшает благоприятное влияние на смертность и риск развития осложнений.
Несмотря на «ложку дегтя» в результатах исследования ADVANCE-ON, все-таки в целом они позволяют смотреть в будущее с оптимизмом. У нас есть АГП, способные уменьшить риск смерти от ССЗ и даже от всех причин, есть четко и ясно сформулированные в рекомендациях подходы к назначению терапии. Дело «за малым» — за соблюдением этих рекомендаций в клинической практике.



