Одно из наиболее частых осложнений, возникающих после хирургического лечения коронарной недостаточности у больных ишемической болезнью сердца (ИБС), — нарушение ритма сердца [1, 2]. В этой связи примечателен вывод, сделанный Л.А. Бокерия, о том, что прямая реваскуляризация миокарда позволяет устранить нарушения ритма лишь у небольшого числа пациентов [3]. Основной пик нарушений ритма сердца приходится на первые 3 сут после операции [4], в дальнейшем синусовый ритм восстанавливается. Согласно данным литературы, у пациентов с послеоперационными нарушениями ритма сердца, в частности, с фибрилляцией предсердий, 30-дневная и 6-месячная выживаемость заметно ниже, чем без осложнений [5]. Для предупреждения подобных осложнений рекомендовано использовать антиаритмические препараты, в частности, β-адреноблокаторы. Однако они не всегда эффективны, поскольку практически все антиаритмические препараты способны оказывать проаритмогенное действие [6, 7].
Многочисленные выявления нарушений ритма сердца в послеоперационном периоде могут быть отражением метаболических нарушений, возникающих в клетках сердечной мышцы [4]. Экспериментально установлено, что одним из механизмов поражения сердечной мышцы при ишемическом и реперфузионном воздействии является неконтролируемое перекисное окисление липидов (ПОЛ), ведущее к нарушению структуры и функции клеточных мембран [8, 9].
Цель данной работы — оценить роль оксидантного стресса в развитии нарушений ритма сердца в раннем послеоперационном периоде после аортокоронарного шунтирования и возможность их предупреждения препаратами аскорбиновой кислоты.
Материал и методы
В исследование были включены 40 пациентов (мужчины) с хронической формой ИБС, госпитализированных в НИИ кардиологии СО РАМН. Всем пациентам было рекомендовано хирургическое лечение. Включенные в исследование пациенты были разделены на 2 сопоставимые группы: основную и контрольную. Краткая клиническая характеристика групп обследованных больных представлена в табл. 1. Все пациенты до операции и после нее получали стандартную базовую терапию, включающую β-адреноблокаторы (метопролол, бисопролол, атенолол). У пациентов основной группы базовая терапия была дополнена аскорбиновой кислотой. Ее использовали в форме водорастворимых таблеток по 1 г по следующей схеме: 2 г вечером перед операцией и по 1 г 2 раза в сутки в течение 5 дней после операции.
Таблица 1. Клиническая характеристика групп обследованных больных
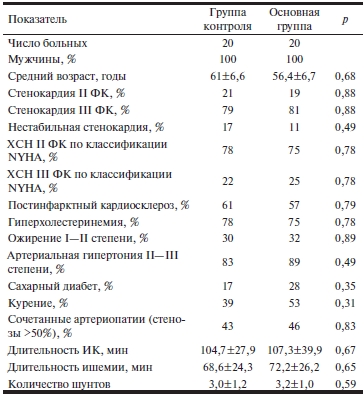
Примечание. ФК — функциональный класс; ХСН — хроническая сердечная недостаточность; NYHA — классификация Нью-Йоркской ассоциации сердца; ИК — искусственное кровообращение.
Контроль за нарушением ритма сердца у пациентов в пред- и послеоперационный период осуществляли путем мониторирования электрокардиограммы при помощи монитора Siemens SC 9000.
Перед приемом аскорбиновой кислоты, а также на 1-е и 5-е сутки после операции у всех пациентов брали образцы венозной крови. Полученную из них плазму замораживали и хранили при температуре жидкого азота. Биологические образцы использовали для оценки интенсивности оксидантного стресса, о которой судили по концентрации диеновых конъюгатов (ДК) [10] и активности антиокислительного фермента каталазы [11].
Сравнение полученных данных выполняли с использованием критерия Манна—Уитни и χ2. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Результаты определения концентрации ДК и активности каталазы в плазме крови рассматриваемых групп пациентов представлены в табл. 2. Согласно полученным данным, по исходным представленным показателям сформированные нами группы значимо не различались. Этот результат хорошо согласуется с данными табл. 1 и представлением о том, что формирование ИБС сопровождается активацией ПОЛ в миокарде и крови пациентов [12]. Однако в послеоперационном периоде динамика концентрации ДК и активности каталазы в исследуемых группах пациентов различалась. Так, в контрольной группе концентрация ДК в плазме крови через 24 ч и через 5 сут после операции достоверно значимо не изменялась. У пациентов, получавших аскорбиновую кислоту, через 24 ч после операции отмечено достоверно значимое снижение концентрации ДК по сравнению с исходной в группе. Поскольку ДК являются первичными продуктами ПОЛ [13], снижение их концентрации можно рассматривать как признак того, что использование аскорбиновой кислоты блокирует развитие оксидантного стресса на начальных стадиях его развития. В естественных условиях процесс ПОЛ находится под постоянным контролем антиоксидантной системы организма. В условиях хронической формы ИБС с повторяющимися эпизодами ишемии и реперфузии происходит истощение отдельных антиоксидантов [8], что может отрицательно отражаться на эффективности сдерживания ПОЛ в условиях острого ишемического воздействия. Действительно, ранее нами было показано, что у больных ИБС с тяжелой сердечной недостаточностью снижается уровень эндогенных жирорастворимых антиоксидантов [14].
Таблица 2. Показатели активности каталазы и концентрации диеновых конъюгатов в плазме крови кардиохирургических пациентов
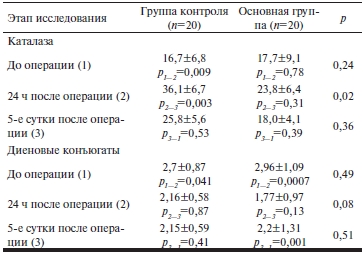
Примечание. р1—2 — достоверность различий между показателями в группе до операции и через 24 ч после операции; р2—3 — достоверность различий между показателями в группе через 24 ч и на 5-е сутки после операции; р3—1 — достоверность различий между показателями в группе до операции и на 5-е сутки после операции.
Для оценки состояния антиоксидантной системы у пациентов исследуемых групп и ее реакции в процессе терапии аскорбиновой кислотой мы определяли активность каталазы — основного фермента антиоксидантной защиты.
Как следует из данных, представленных в табл. 2, активность каталазы на дооперационном этапе у пациентов рассматриваемых групп достоверно не различалась. По прошествии 24 ч после операции у пациентов контрольной группы мы выявили значимое, более чем в 2,1 раза, повышение активности этого фермента. На 5-е сутки активность каталазы снизилась, но по-прежнему оставалась выше, чем до операции. Такая направленность изменений активности одного из основных антиоксидантных ферментов может расцениваться как показатель компенсаторного напряжения системы антиоксидантов в ответ на ишемическое и реперфузионное воздействие, которому была подвергнута сердечная мышца в ходе хирургического вмешательства. При этом увеличение активности каталазы дает основание утверждать, что эндогенная антиоксидантная система пациентов, включенных в исследование, во всяком случае, ее ферментативная составляющая, сохраняет функциональный резерв.
У пациентов основной группы на протяжении всего периода исследования нами не отмечено значимых изменений активности каталазы. Вероятно, что такая динамика изменения ферментативной активности каталазы в этой группе может быть обусловлена повышением антиоксидантной устойчивости организма в результате применения препарата аскорбиновой кислоты.
В настоящее время патогенез реперфузионных аритмий, в том числе возникающих после хирургического лечения ИБС с использованием техники искусственного кровообращения, связывают с проявлением «кислородного парадокса» и, как следствие, патологической активацией процессов ПОЛ [1, 2, 4].
Представленные данные дают основание считать, что применение аскорбиновой кислоты позволяет если не предотвратить, то существенно снизить активацию ПОЛ в результате ишемического и реперфузионного воздействия на миокард. В этих условиях вполне оправданно ожидать меньшую выраженность нарушений ритма сердца, обусловленных перенесенной его остановкой. Действительно, по нашим данным, в контрольной группе восстановление коронарного кровотока в 20% случаев (4 больных) сопровождалось развитием фибрилляции предсердий в послеоперационном периоде. В группе пациентов, получавших аскорбиновую кислоту, частота возникновения фибрилляций предсердий была достоверно меньше (χ2=4,11; р=0,04) и наблюдалась только в 5% случаев (один больной). Столь выраженное снижение частоты нарушений сердечного ритма у пациентов основной группы свидетельствует о повышении электрической стабильности миокарда в послеоперационном периоде.
Вероятно, снижение интенсивности свободно-радикальных процессов в результате приема аскорбиновой кислоты положительно отразилось на структурно-функциональном состоянии мембран кардиомиоцитов. Так, согласно существующим представлениям, кардиопротекторное действие антиоксидантов связывают с сохранением химического состава липидного бислоя и функции ионных каналов клеточных мембран [15].
Заключение
Результаты проведенного исследования свидетельствуют, что использованная нами схема применения аскорбиновой кислоты позволяет достаточно эффективно сдерживать развитие оксидантного стресса при хирургическом лечении ишемической болезни сердца с использованием аппарата искусственного кровообращения. Однако для решения вопроса о целесообразности включения аскорбиновой кислоты в состав медикаментозной терапии таких пациентов с целью предупреждения нарушений ритма сердца в послеоперационном периоде необходимо проведение дальнейших клинических и лабораторных исследований.



