Основным методом профилактики внезапной сердечной смерти (ВСС) в группах высокого риска у пациентов с ишемической болезнью сердца (ИБС) в соответствии с существующими показаниями является имплантация кардиовертера-дефибриллятора (ИКД) [1]. Эффективность применения ИКД для первичной профилактики ВСС у пациентов с ИБС и фракцией выброса левого желудочка (ФВ ЛЖ) менее 35% показана в исследованиях MADIT II [2] и SCD-HEFT [3]. Популяция пациентов, нуждающихся в имплантации ИКД в соответствии с существующими показаниями, очень велика. Так, в США, по данным национального регистра в период с 2005 по 2009 г., имплантировано 486 025 ИКД [4]. У 65,3% пациентов имелась ИБС как основное заболевание, 69% устройств имплантированы для первичной профилактики ВСС. Однако, по данным В. Shah и соавт. [5], только 20% пациентов с показаниями к первичной профилактике ВСС имплантируется ИКД. В России в 2011 г. имплантировано 1355 ИКД в 57 центрах [6]. Учитывая трудности в обеспечении всех нуждающихся ИКД, одной из основных задач для будущих исследований авторы существующих рекомендаций считают дальнейшую стратификацию риска среди больных с показаниями к первичной профилактике ВСС [7]. Определение признаков, пригодных для решения данной задачи, является целью современных исследований.
Целью нашего исследования была оценка особенностей поражения коронарного русла у пациентов с ИБС и ИКД для первичной профилактики ВСС при наличии или в отсутствие мотивированных срабатываний в анамнезе.
Материал и методы
В исследование включены 64 пациента с постинфарктным кардиосклерозом (60 мужчин, 4 женщины), которым был имплантирован ИКД для первичной профилактики ВСС в период с 2007 по 2012 гг. Все пациенты, включенные в исследование, имели показания I класса для имплантации кардиовертера-дефибриллятора (КД) в соответствии с отечественными рекомендациями [8].
До имплантации КД всем пациентам выполняли стандартные исследования: снятие электрокардиограммы (ЭКГ), трансторакальную эхокардиографию (ЭхоКГ) с оценкой ФВ ЛЖ по Симпсону, конечного диастолического и конечного систолического объемов ЛЖ, толщины межжелудочковой перегородки, диаметра левого предсердия. С помощью ЭхоКГ оценивали также локализацию зон постинфарктного кардиосклероза (акинезии и дискинезии).
 Перед операцией пациентам выполняли селективную коронарографию (КГ) в соответствии с существующими показаниями к данному исследованию — у пациентов с низкой ФВ ЛЖ и наличием клинических симптомов стенокардии напряжения или сердечной недостаточности (СН). Оценивали наличие гемодинамически значимого поражения главного ствола левой коронарной артерии (ГС ЛКА), передней межжелудочковой ветви (ПМЖВ) ЛКА, огибающей ветви (ОВ) ЛКА, правой коронарной артерии (ПКА). Гемодинамически значимым поражением КА считали стеноз проксимальной трети артерии более 75% или поражение средней трети либо крупных ветвей артерии, потребовавшее реваскуляризации.
Перед операцией пациентам выполняли селективную коронарографию (КГ) в соответствии с существующими показаниями к данному исследованию — у пациентов с низкой ФВ ЛЖ и наличием клинических симптомов стенокардии напряжения или сердечной недостаточности (СН). Оценивали наличие гемодинамически значимого поражения главного ствола левой коронарной артерии (ГС ЛКА), передней межжелудочковой ветви (ПМЖВ) ЛКА, огибающей ветви (ОВ) ЛКА, правой коронарной артерии (ПКА). Гемодинамически значимым поражением КА считали стеноз проксимальной трети артерии более 75% или поражение средней трети либо крупных ветвей артерии, потребовавшее реваскуляризации.
Средний срок послеоперационного наблюдения составил 19,0±12,0 мес. Послеоперационное программирование ИКД выполняли в раннем послеоперационном периоде, через 2 мес после имплантации, затем 1 раз в 6 мес — в соответствии с существующими рекомендациями по программированию имплантируемых устройств [9]. Анализ эндограмм, зарегистрированных устройством, проводил врач, выполнявший программирование. Внеплановые осмотры выполняли в случае мотивированного срабатывания ИКД. Немотивированные разряды ИКД в данном анализе не учитывали. Пациенты были разделены на 2 группы: 1-я группа — 26 пациентов с мотивированными срабатываниями ИКД за время наблюдения, 2-я группа — 38 пациентов без мотивированных срабатываний ИКД.
Для статистического анализа данных использована программа Statistica 8. Проверку нормальности распределения данных проводили с помощью критерия Шапиро—Уилка. Количественные данные представлены как среднее значение ± среднеквадратичное отклонение. Количественные параметры сравнивали с помощью критерия Стьюдента для независимых выборок. Сравнение качественных параметров осуществляли с помощью критерия χ2 или точного критерия Фишера. Значимыми считали различия при p<0,05.
Результаты
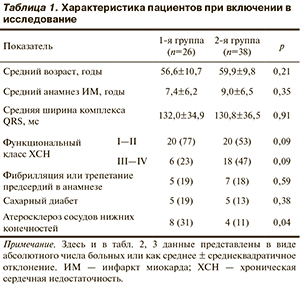
Данные пациентов обеих групп на момент включения представлены в табл. 1.
Все пациенты получали адекватную медикаментозную терапию, включавшую β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента. Профилактическую антиаритмическую терапию кордароном или соталолом получали 17 (64%) пациентов в 1-й группе и 19 (50%) во 2-й группе (р=0,34).
 По оцененным выше параметрам группы статистически значимо не разичались, за исключением большего числа больных с генерализованным атеросклерозом (31% в 1-й группе и 11% во 2-й группе; р=0,04).
По оцененным выше параметрам группы статистически значимо не разичались, за исключением большего числа больных с генерализованным атеросклерозом (31% в 1-й группе и 11% во 2-й группе; р=0,04).
В обеих группах зафиксировано по 2 летальных исхода. Два пациента в 1-й группе умерли от инфекционных осложнений после операций повторной реваскуляризации миокарда, 2 пациента во 2-й группе — от декомпенсированной СН.
Данные ЭхоКГ пациентов представлены в табл. 2.
В исследуемых группах не выявлено статистически значимых различий при оценке распространенности различных локализаций ИМ.
Различия при оценке поражения коронарных артерий (КА) представлены на рисунке. Поражение ПМЖВ выявлено у большего числа пациентов в 1-й группе — 25 (96%) против 28 (74%) во 2-й группе (р=0,02). Частота поражения остальных КА в группах пациентов статистически значимо не отличалась: ГС ЛКА — 7 (27%) в 1-й группе и 5 (13%) во 2-й группе (р=0,14); ОВ — 17 (65%) в 1-й группе и 18 (47%) во 2-й группе (р=0,24), ПКА — 16 (62%) в 1-й группе и 17 (45%) во 2-й группе (р=0,29).
Число пациентов с двух- или трехсосудистым поражением КА также значимо не различалось в исследуемых группах: 20 (77%) в 1-й группе и 31 (82%) во 2-й группе (р=0,89).
Реваскуляризация миокарда в бассейне пораженных КА выполнялась пациентам перед имплантацией КД. Реваскуляризация не была выполнена одному пациенту в исследуемой группе и одному — в контрольной группе. У обоих имелась хроническая окклюзия одной КА. Причиной отказа в реваскуляризации стало решение кардиохирургической комиссии, обусловленное минимальными клиническими проявлениями ИБС (компенсированная СН, отсутствие стенокардии напряжения) и высоким риском кардиохирургического вмешательства у пациентов с низкой ФВ ЛЖ.
Данные о желудочковых аритмиях (ЖА) и типе их купирования, зарегистрированных в группе пациентов с мотивированными срабатываниями ИКД, представлены в табл. 3.
Обсуждение
 Срабатывание ИКД, в частности, шоковый разряд, является неблагоприятным прогностическим фактором у больных со сниженной ФВ ЛЖ. По данным J. E. Poole и соавт. [10], в исследовании MADIT II смертность в группе пациентов, получивших хотя бы один адекватный шоковый разряд, была выше в 5,68 раза, чем у пациентов, не имевших шоковых разрядов ИКД.
Срабатывание ИКД, в частности, шоковый разряд, является неблагоприятным прогностическим фактором у больных со сниженной ФВ ЛЖ. По данным J. E. Poole и соавт. [10], в исследовании MADIT II смертность в группе пациентов, получивших хотя бы один адекватный шоковый разряд, была выше в 5,68 раза, чем у пациентов, не имевших шоковых разрядов ИКД.
В большинстве исследований, оценивавших риск смерти у больных с ИКД, основным фактором риска, за исключением ФВ ЛЖ, стала тяжесть течения сопутствующих кардиальных и некардиальных заболеваний [11—13].
В нашем исследовании мы впервые оценили особенности локализации ИМ и поражения КА исключительно у пациентов с показаниями к первичной профилактике ВСС. В популяции нашего исследования обращает внимание статистически значимо большая встречаемость генерализованного атеросклероза у пациентов с мотивированными срабатываниями ИКД, что соответствует данным D.B. Kramer и соавт. [13] о значимости генерализованного атеросклероза в стратификации риска мотивированных срабатываний у больных с ИКД. Однако число пациентов с многососудистым поражением КА статистически значимо не отличалось в исследуемой нами популяции. Статистически значимые различия по локализации ИМ отсутствовали, однако наблюдалась тенденция к большему числу пациентов с передним ИМ в группе пациентов со срабатываниями ИКД.
При оценке поражения КА в группах со срабатываниями ИКД и без таковых статистически значимо большее число пациентов в нашем исследовании имели гемодинамически значимый стеноз ПМЖВ или ее крупных ветвей. Статистически значимых различий при оценке распространенности поражения других КА нами не выявлено. Косвенным объяснением данного вывода могут служить более тяжелое поражение миокарда, большая вероятность возникновения выраженной дилатации ЛЖ после перенесенного переднего ИМ [14].
В нескольких исследованиях оценивались данные о поражении КА и локализации ИМ в схожей популяции пациентов. P. Pascale и соавт. [15] оценили состояние КА и локализацию ИМ у пациентов с ИБС, доставленных в госпиталь после эпизода желудочковой тахикардии/фибрилляции желудочков. Авторам этого исследования удалось обследовать 252 пациентов, из которых у 34% имелась ФВ ЛЖ более 40%. В группе пациентов с острым ИМ статистически незначимо преобладала передняя локализация. Однако в группе с хроническими постинфарктными изменениями и ЖА преобладали пациенты с нижним ИМ. Авторы связывают эти изменения с возможным вовлечением правого желудочка [16] либо с возможной дисфункцией автономной иннервации сердца при нижней локализации ИМ [17].
Особенностью исследования P. Pascale и соавт. была неоднородность групп пациентов, многие из которых имели нормальную ФВ ЛЖ. Кроме того, к сожалению, авторы не приводят данных о наличии ИКД у пациентов с ИМ в анамнезе, что может ограничивать популяцию включенных в исследование больных, так как многие больные с эпизодом ЖА без ИКД могли умереть внезапно до направления в госпиталь.
 В работе M. Olimulder и соавт. [18] сравнивались особенности локализации рубцовой ткани по данным магнитно-резонансной томографии (МРТ) у пациентов с ИКД для первичной и вторичной профилактики ВСС. Передняя локализация ИМ чаще встречалась у больных с показаниями к первичной профилактике ВСС по сравнению с пациентами с ИКД для вторичной профилактики ВСС (р=0,02). Однако в данном исследовании не оценивалась вероятность мотивированных срабатываний ИКД у пациентов с показаниями к первичной профилактике ВСС.
В работе M. Olimulder и соавт. [18] сравнивались особенности локализации рубцовой ткани по данным магнитно-резонансной томографии (МРТ) у пациентов с ИКД для первичной и вторичной профилактики ВСС. Передняя локализация ИМ чаще встречалась у больных с показаниями к первичной профилактике ВСС по сравнению с пациентами с ИКД для вторичной профилактики ВСС (р=0,02). Однако в данном исследовании не оценивалась вероятность мотивированных срабатываний ИКД у пациентов с показаниями к первичной профилактике ВСС.
В нашем исследовании практически всем пациентам с ИМ была выполнена реваскуляризация пораженных КА до имплантации ИКД, как и в большинстве современных исследований по первичной профилактике ВСС. Эпизоды устойчивых ЖА зарегистрированы у 40% пациентов при длительном сроке наблюдения. По данным J. Brugada и соавт. [19], вероятность возникновения ЖА остается высокой после реваскуляризации миокарда у пациентов, имевших ЖА до операции. В то же время в исследовании G.D. Veenhuyzen и соавт. [20] показано, что реваскуляризация миокарда уменьшает вероятность ВСС. Возможным объяснением этого наблюдения является снижение вероятности образования новых субстратов аритмии в связи со снижением риска повторных ИМ. В нашем исследовании пациенты с мотивированными срабатываниями ИКД имели анамнез поражения ПМЖВ, что связано с более тяжелым поражением миокарда ЛЖ [14] и, вероятно, с наибольшим количеством субстратов аритмии.
Использование для стратификации риска мотивированных срабатываний ИКД дополнительных диагностических методов, таких как МРТ сердца, может приводить к значительному повышению стоимости обследования пациента. Так как КГ является стандартом обследования больных ИБС с низкой ФВ ЛЖ [21], использование в клинической практике значимого поражения ПМЖВ как предиктора мотивированных срабатываний ИКД не приводит к изменению длительности и стоимости лечения пациента. Дальнейшее использование данного признака в системах прогнозирования мотивированных срабатываний ИКД может улучшить своевременность применения дополнительных методов лечения в группах пациентов высокого риска.
Основными ограничениями нашего исследования стали небольшой объем выборки и ретроспективный характер исследования. Учитывая наличие архивированных данных пациентов на момент имплантации устройства, одинаковое применение доступных методов лечения в обеих группах, ретроспективный характер исследований может быть адекватным для выявления основных закономерностей. Небольшой объем исследования, к сожалению, связан с невысокой частотой имплантации КД для первичной профилактики ВСС в нашей стране.
Заключение
Наличие гемодинамически значимого поражения передней межжелудочковой ветви левой коронарной артерии является предиктором возникновения желудочковых аритмий и мотивированных срабатываний имплантируемого кардиовертера-дефибриллятора в группе пациентов с ишемической болезнью сердца и фракцией выброса левого желудочка менее 35%.



