Основной причиной смертности больных сахарным диабетом (СД) являются сердечно-сосудистые осложнения (ССО), развивающиеся вследствие прогрессирующего атеросклероза. По данным Всемирной организации здравоохранения, более 75% больных СД 2-го типа умирают вследствие сосудистых катастроф.
В сравнении с общей популяцией у пациентов с СД риск развития ишемической болезни сердца (ИБС) возрастает в 4 раза [1]. Поражение коронарных артерий часто сочетается с атеросклеротическим поражением сосудов нижних конечностей (СНК), брахиоцефальных артерий (БЦА), почечных артерий (ПА) [2, 3]. Мультифокальность — одна из ключевых характеристик атеросклероза, представляющая большие проблемы для диагностики и лечения, особенно при бессимптомном течении процесса. Мультифокальный атеросклероз, а также связанный с ним атеротромбоз ярко проявляются при СД, который определяет распространенность и выраженность поражений. Традиционное представление о высоком риске развития сердечно-сосудистых заболеваний (ССЗ) при СД в основном связывается с СД 2-го типа. Высокие заболеваемость и смертность от ССЗ больных с СД 1-го типа стали документироваться, начиная с конца 70-х годов XX века. Регистр больных СД 1-го типа в США в 1984 г. отметил 10-кратное повышение сердечно-сосудистой смертности (ССС) по сравнению с популяционной [4]. Столь высокий риск был в последующем подтвержден исследователями Джослинского центра, которые доложили о 7-кратном превышении ССС у лиц с СД 1-го типа в возрасте 55 лет и старше по сравнению с данными Фрамингемского исследования [5]. Исследование WESDR (The Wisconsin Epidemiologic Study of Diabetic Retinopathy) также показало, что относительный риск смерти от ИБС составил у мужчин 9,1, а у женщин 13,5 при развитии СД в возрасте моложе 30 лет [6].
Цель исследования — определить распространенность и факторы риска атеросклеротического поражения экстракоронарных артерий у больных СД 1-го типа и СД 2-го типа с подтвержденным коронароангиосклерозом.
Материал и методы
В исследование были включены 100 человек, 48 пациентов с СД 2-го типа (1-я группа), 18 пациентов с СД 1-го типа, из них 8 получали терапию, замещающую функцию почек (2-я группа), и 34 человека без СД (3-я группа), у которых по данным селективной коронарографии (КГ) было определено гемодинамически значимое поражение коронарных артерий. КГ выполняли на ангиографических установках с использованием неионного низкоосмолярного контрастного вещества.
Всем пациентам проводили оценку антропометрических данных, общеклиническое и биохимическое исследование крови, анализ мочи на экскрецию альбумина, определение уровня гликированного гемоглобина, эхокардиографию (ЭхоКГ). С целью оценки состояния сосудистого русла всем пациентам было проведено ультразвуковое дуплексное сканирование (УЗДС) СНК, БЦА, ПА. Стандартными критериями для диагностики гемодинамически значимого стеноза является сужение просвета артерии более чем на 50%. Гипертрофию миокарда левого желудочка (ГМЛЖ) определяли в соответствии с индексом миокарда ЛЖ (ИММЛЖ), вычисленным по формуле R. Devereux. Расчет скорости клубочковой фильтрации (СКФ) был произведен по формуле MDRD.
В ходе работы оценены профиброгенные медиаторы — трансформирующий β1-фактор роста (TGF-β1), матричная металлопротеиназа-9 (ММР-9), моноцитарный хемоаттрактантный протеин 1-го типа (МСР-1), регулятор активации экспрессии и секреции нормальных Т-лимфоцитов (RANTES), маркеры дисфункции эндотелия — фактор Виллебранда (FW), ингибитор активатора плазминогена 1-го типа (PAI-1), гомоцистеин, молекулы адгезии сосудистых клеток (sVCAM), молекулы межклеточной адгезии (sICAM), фактор роста сосудистого эндотелия (VEGF), асимметричный диметиларгинин (ADMA). Были определены N-концевой натрийуретический пептид (NT-proBNP) и фактор роста фибробластов 23-го типа (FGF-23). Определение основных факторов фиброза и дисфункции эндотелия проводили с помощью стандартных наборов фирм: TECHNOZYM — PAI-1, FW; Immundiagnostik — ADMA; eBioscience — TGF-β1, sICAM, sVCAM, RANTES, ММР-9 МСР-1; Invitrogen — VEGF; Axis — HCYST; Biomedica — NT-proBNP; USCN — FGF-23. Все пациенты подписывали информированное согласие на участие в исследовании.
Полученные данные анализировали при помощи программы Statistica. Сравнение показателей в изучаемых группах осуществляли при помощи U-критерия Манна—Уитни. Для описания распределения показателя определяли значения медианы Ме верхнего и нижнего квартилей (25%; 75%), оценку статистически значимых различий между группами проводили при помощи критерия χ2. Достоверными считали различия при p<0,05. Для исследования взаимосвязи между признаками использовали метод ранговой корреляции по Спирмену. Исследование прогностической ценности факторов в модели логистической регрессии проводили с поправкой на пол и возраст.
Результаты
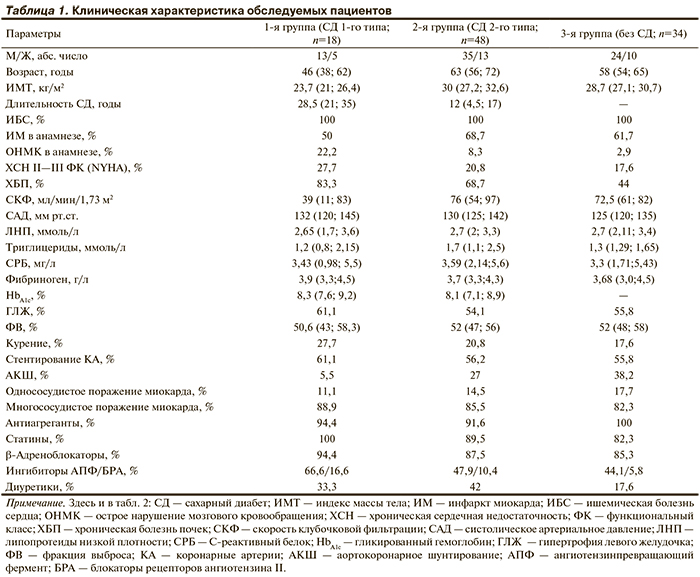
Клиническая характеристика обследуемых пациентов представлена в табл. 1.
Распространенность множественного поражения коронарных артерий была сопоставима во всех 3 группах (СД 2-го типа — 88,9%, СД 2-го типа — 85,5%, без СД — 82,3%).
По данным ЭхоКГ, значимый стеноз СНК чаще выявлялся у больных СД (при СД 2-го типа — 58,3%, при СД 2-го типа — 55,5%), чем у лиц без СД (11,7%; р<0,05). Частота поражения ПА и БЦА была практически сопоставима у пациентов с СД 2-го типа и группы без СД (ПА — 12,5 и 11,7%; БЦА — 33,3 и 44,1% соответственно). У больных СД 2-го типа стеноз БЦА и ПА выявлялся в 16,6 и 5,5% случаев (рис. 1).

Поражение 2 сосудистых бассейнов и более отмечалось при СД 2-го типа у 85,3% пациентов (2 — у 58,3%, 3 — у 18,7%, 4 — у 8,3%), в группе без СД — 50% (2 — у 35,3%, 3 — у 11,8%, 4 — у 2,9%; р=0,005). У больных СД 2-го типа определялось в 61,1% случаев поражение 2 сосудистых бассейнов, в 11,1% случаев — 3 сосудистых бассейнов (рис. 2).
Оценка профиброгенных медиаторов и маркеров дисфункции эндотелия у пациентов с СД в сравнении с группой без СД выявила значимое повышение или тенденцию к повышению ряда исследуемых показателей (табл. 2).
Повышение уровня NT-proBNP (маркера сердечной недостаточности) у больных СД 1-го типа оказалось самым значимым по сравнению с лицами других групп (табл. 3). Кроме того, в этой группе он отрицательно коррелировал со СКФ (r=–0,7142; p<0,05), липопротеидами высокой плотности (r=–0,9; p<0,05) и положительно — с уровнем триглицеридов (r=0,8173; p<0,05). У пациентов с СД 2-го типа, как и у пациентов с СД 2-го типа выявлена отрицательная корреляция уровня NT-proBNP с СКФ (r=–0,7472; p<0,05) и положительная — с ГМЛЖ (r=0,5407; p<0,05).
FGF-23 — фосфатурический гормон, действующий на молекулярном уровне с участием трансмембранного белка Klotho и имеющий у больных СД тесную взаимосвязь с прогрессированием хронической болезни почек (ХБП) и ССО; его уровень был сопоставим во всех 3 группах, но выше референсных значений (норма до 50 пг/мл) (см. табл. 3). При этом данный показатель у больных СД 2-го типа отрицательно коррелировал с СКФ (r=–0,5452; p<0,05).
Группы больных СД с мультифокальным атеросклерозом и поражением только одного бассейна различались по СКФ, уровню СРБ, фибриногена, NT-proBNP, FW, PAI-1, ADMA, sICAM (табл. 4).
Группы больных без СД с мультифокальным атеросклерозом и поражением только одного бассейна статистически значимо не различались, за исключением систолического артериального давления (АД).

Поскольку в обследуемой группе больных СД, имевших значимое преимущество в частоте мультифокального атеросклероза, более 50% имели ХБП на разных стадиях, было проведено сравнение основных показателей у лиц с СКФ более 60 мл/мин/1,73 м2 и менее 60 мл/мин/1,73 м2. Такой подход был целесообразен с позиции зависимости прогноза ССЗ от величины СКФ, начиная с III стадии ХБП (табл. 5).
В группе больных СД со СКФ менее 60 мл/мин/1,73 м2 отмечается повышенный уровень FGF-23 и NT-proBNP, корреляция которых с СКФ констатирована как при СД 1-го типа, так и при СД 2-го типа.
Методом логистической регрессии были определены факторы, ассоциированные с развитием мультифокального атеросклероза в исследуемых группах (табл. 6).
Обсуждение
Наличие СД в последние годы не препятствует проведению реваскуляризационных вмешательств при развитии многососудистого поражения миокарда и практически не рассматривается как дополнительный фактор развития периоперационных осложнений [7]. Более того, имеется ряд убедительных исследований, демонстрирующих хорошие отдаленные ангиографические результаты и выживаемость у больных СД, сопоставимые с таковыми у лиц без СД [8]. Такие позитивные сдвиги во многом определяются успехами в управлении заболеванием. Вместе с тем у больных СД наряду с многососудистым поражением коронарного русла чаще выявляется мультифокальный атеросклероз, определяющий ближайший и отдаленный прогноз [9]. Пациенты с СД 2-го типа представленного исследования значимо чаще имели 2-, 3- и даже 4-бассейновый атеросклероз по сравнению с лицами без СД при сопоставимых клинических характеристиках (возраст, индекс массы тела, наличие артериальной гипертонии, инфаркта миокарда или острого нарушения мозгового кровообращения в анамнезе, курение, ГЛЖ, СКФ, проводимая терапия). У больных СД 1-го типа, включенных в исследование, ССЗ имела тесную связь с диабетической нефропатией (ДН) — у 66,6% этих пациентов имелась ХБП III—V стадии, включая лиц с трансплантированной почкой.
 Сложные механизмы развития мультифокального атеросклероза, включающие факторы дисметаболизма, неспецифического воспаления, гемодинамических нарушений, инсулинорезистентности, коагулопатий и др., могут быть в полной мере реализованы при СД. Атеросклероз как воспалительный процесс очень быстро прогрессирует в условиях гипергликемии, провоцирующей дисфункцию эндотелия, тромбообразование, пролиферацию и взрывообразное усиление окислительного стресса с триггерной ролью цитокинов. Ряд исследуемых маркеров этих процессов (RANTES, ММР-9, PAI-1, VCAM, sICAM, ADMA) были значимо выше у лиц с СД, чем у пациентов без СД. Остальные показатели имели тенденцию к росту при нарушении углеводного обмена. Эти данные согласуются с результатами других исследований, демонстрирующих повышенную активацию профиброгенных цитокинов и дисфункцию эндотелия у лиц с СД при развитии и прогрессировании атеросклероза, особенно при его мультифокальности [10—12].
Сложные механизмы развития мультифокального атеросклероза, включающие факторы дисметаболизма, неспецифического воспаления, гемодинамических нарушений, инсулинорезистентности, коагулопатий и др., могут быть в полной мере реализованы при СД. Атеросклероз как воспалительный процесс очень быстро прогрессирует в условиях гипергликемии, провоцирующей дисфункцию эндотелия, тромбообразование, пролиферацию и взрывообразное усиление окислительного стресса с триггерной ролью цитокинов. Ряд исследуемых маркеров этих процессов (RANTES, ММР-9, PAI-1, VCAM, sICAM, ADMA) были значимо выше у лиц с СД, чем у пациентов без СД. Остальные показатели имели тенденцию к росту при нарушении углеводного обмена. Эти данные согласуются с результатами других исследований, демонстрирующих повышенную активацию профиброгенных цитокинов и дисфункцию эндотелия у лиц с СД при развитии и прогрессировании атеросклероза, особенно при его мультифокальности [10—12].
РАI-1 — важнейший ингибитор активации фибринолиза, уровень которого резко возрастает в случае активации и повреждения эндотелия [13]. Наше исследование подтвердило повышение уровня этого фактора у пациентов с СД по сравнению с лицами без СД, имевшими значимо меньшую частоту мультифокального атеросклероза при выраженной коронарной патологии. Такая же ситуация складывается с VCAM и sICAM — циркулирующими молекулами адгезии сосудистых клеток.
В исследовании продемонстрирована ассоциация СД 1-го типа с ADMA — наиболее серьезным фактором риска развития ССО и прогрессирования почечной патологии. У них также определен высокий повреждающий эффект RANТES, известный как фактор, индуцирующий окислительный стресс и действие цитокинов [14].
Сравнительный анализ лиц с мультифокальным атеросклерозом и поражением только 1 бассейна среди лиц с СД позволил выделить наиболее значимые факторы атеросклеротического процесса (СКФ, уровни СРБ, фибриноген, NT-proBNP, FW, PAI-1, ADMA, sICAM). СРБ — маркеру воспаления – отводится значимая роль в развитии ИБС. По данным мета-анализа, в котором было проанализировано 2557 случаев, показано двукратное увеличение риска развития ССО при уровне СРБ >2,4 мг/л [15]. Наиболее значимое повышение уровня NT-proBNP (предиктора ССО) отмечалось у больных СД с поражением 2 сосудистых бассейнов и более, а также в группе больных с СКФ менее 60 мл/мин/1,73 м2, что отражает не только его вклад в развитие и прогрессирование ССЗ, но и взаимосвязь между функциональным состоянием почек и сердечно-сосудистой системы. Имеются данные о повышении уровня NT-proBNP у пациентов с СД 1-го типа, СД 2-го типа при наличии ДН вне зависимости от уровня СКФ, а также у пациентов с диастолической дисфункцией [16, 17]. В проспективном исследовании, включившем 987 человек, уровень NT-proBNP (более 1,3 пг/мл) был связан с 2,3-кратным увеличенным частоты развития ССО [18]. FGF-23, секретируемый остеоцитами, остеобластами и остеокластами в ответ на гиперфосфатемию, по данным эпидемиологических исследований имел связь со смертностью у пациентов, получающих терапию, замещающую функцию почек, программным гемодиализом [19]. Согласно данным эпидемиологических исследований, повышенный уровень FGF-23 ассоциирован с ССО [20], ГЛЖ [21], дисфункцией эндотелия [22] и атеросклеротическим поражением сосудов [23].
В нашем исследовании этот показатель, возможно, играет опосредованную роль в развитии ССЗ путем негативного влияния на функцию почек в рамках нефрокардильного синдрома.
 Усиленное накопление и выделение FW отражает массивное повреждение эндотелия различного, в том числе атеросклеротического, генеза, что позволило этому фактору проявить себя в развитии мультифокального сосудистого поражения у больных СД. Проведенные исследования продемонстрировали увеличение концентрации FW по мере нарастания тяжести и диабетического поражения почек, и тяжелого повреждения эндотелия сосудов [24]. Сходные результаты получены и в нашем исследовании при оценке изучаемого фактора в зависимости от СКФ.
Усиленное накопление и выделение FW отражает массивное повреждение эндотелия различного, в том числе атеросклеротического, генеза, что позволило этому фактору проявить себя в развитии мультифокального сосудистого поражения у больных СД. Проведенные исследования продемонстрировали увеличение концентрации FW по мере нарастания тяжести и диабетического поражения почек, и тяжелого повреждения эндотелия сосудов [24]. Сходные результаты получены и в нашем исследовании при оценке изучаемого фактора в зависимости от СКФ.
В серии клинических исследований повышение уровня ADMA ассоциировано с сердечно-сосудистой заболеваемостью и ССС за счет ухудшения эндотелийзависимой вазодилатации, у пациентов как в общей популяции, так и с почечной патологией [25]. В исследовании, включившем 116 пациентов, показана положительная корреляция ADMA с возрастом, АД, нарушенной толерантностью к глюкозе, толщиной интимы—медии БЦА [26]. Согласно проведенным исследованиям, этот параметр представляется серьезным фактором, ответственным за генерализованный атеросклеротический процесс, значимо повышающим риск мультифокального атеросклероза. Такую же роль следует отметить для факторов коагуляции, активность которых существенно повышена при СД. Полифункциональность фибриногена — важнейшего компонента системы гомеостаза — определяет глубокий и сложный характер его связи с развитием ССЗ, ее выраженности и возможных исходов. В Гетеборгском и Фрамингемском исследованиях показано, что повышенный уровень фибриногена в плазме крови является независимым фактором риска развития инфаркта миокарда и острого нарушения мозгового кровообращения, а также приравнен к факторам риска развития ССО, таким как артериальная гипертония, СД и курение [27].
Проведенные в последние годы исследования уделяют большое внимание дисфункции почек как важнейшему фактору риска ССЗ. Крупные популяционные исследования показали обоснованность включения ХБП в перечень факторов риска развития ССО [28]. Особенно уязвимой группой являются пациенты с СКФ менее 60 мл/мин/1,73 м2, когда начинают активно работать наряду с традиционными нетрадиционные факторы атеросклеротического процесса (альбуминурия, анемия, гиперурикемия, оксидативный стресс, активация ренин-ангиотензин-альдостероновой системы, гиперфосфатемия, гиперпаратиреоз, дефицит витамина D и др.). В нашем исследовании у 68,7% пациентов группы больных СД 2-го типа имелась ХБП различных стадий (31,2% — с СКФ менее 60 мл/мин/1,73 м2), что значимо больше, чем у пациентов без СД. Это могло внести определенный вклад в активность и распространенность атеросклеротического процесса. Не исключена, кроме того, альтерация стандартных факторов риска атеросклероза в условиях нарушенного углеводного обмена и дисфункции почек.
Совершенно очевидно, что риск развития ССЗ у больных СД 1-го типа, включенных в исследование, ассоциирован с ДН. У 63,2% этих пациентов имелась ХБП III—V стадии, включая лиц с трансплантированной почкой. Другое серьезное осложнение CД и расцениваемое как фактор риска развития ИБС при СД 1-го типа — автономная невропатия, проявляющаяся сниженной реакцией вазодилатации резистентных коронарных сосудов в условиях симпатовагинальной дисфункции. Несколько механизмов могут быть ответственны за раннюю смертность при ИБС у больных СД 1-го типа, включая ассоциацию с субклиническим, но очевидным коронарным атеросклерозом, отклонения в способности коронарных сосудов к вазодилатации, изменения в систолической и диастолической функции миокарда и, наконец, угрожающая жизни аритмия, порог которой снижен в условиях относительно повышенного симпатического тонуса — ситуации довольно распространенной среди больных СД с симпатовагинальной дисфункцией.
В исследовании у больных СД 1-го типа с длительностью заболевания более 30 лет определена роль состояния почек в общей смертности и ССС в течение 5 лет наблюдения [29]. Популяционные данные свидетельствуют о высочайшем риске сердечно-сосудистой смерти у больных, получающих гемодиализ, независимо от возраста, приравненном к риску сердечно-сосудистой смерти у больных в возрасте 80 лет и старше [30]. Снижение функции почек вследствие развития ДН ускоряет развитие ССЗ, поскольку обеспечивает действие дополнительных факторов риска атерогенеза. Уже в 2005 г. эксперты IDF приравняли пациентов с СД 1-го типа в возрасте старше 30 лет по риску развития ИБС к больным СД 2-го типа, а в случае поражения почек (ДН) — независимо от возраста [31]. При оценке возможности проведения трансплантации почки у больных СД 1-го типа необходима оценка состояния коронарных и экстракоронарных артерий, поскольку почти у 50% этих пациентов имеется бессимптомная значимая ишемия миокарда [32]. Даже после успешной трансплантации почки риск ССС у пациентов данной категории в 2—5 раз выше, чем в общей популяции [33]. Пациенты группы СД 1-го типа, среди которых почти у 30% имелась хроническая сердечная недостаточность II—III функционального класса, имели наиболее высокий уровень NT-proBNP — маркера сердечной недостаточности, отрицательно коррелировавший с СКФ, уровнем липопротеидов высокой плотности и положительно — с уровнем триглицеридов.
Рекомендации Американской ассоциации диабета (АDА) и Американской ассоциации сердца (АНА) отстаивают достаточно решительно контроль уровня липидов и АД и инициируют лекарственную терапию у детей с СД 1-го типа в случае, если немедикаментозными методами не удается достичь целевых показателей. Эти строгие рекомендации должны поощряться. Обе организации также обеспечивают интенсивные дискуссии в вопросах применения рекомендаций по первичной профилактике ССЗ (установленной для пациентов с СД 2-го типа) для молодых пациентов, несмотря на то что не установлен возраст начала терапии. Более того, у многих молодых людей имеются избыточная масса тела и ожирение, ведущие к развитию инсулинорезистентности, ассоциированной с атерогенными факторами риска при СД 1-го типа, что значительно повышает риск развития ССЗ.
Таким образом, распространенность сочетанного атеросклеротического поражения 2 сосудистых бассейнов и более, определяющего долгосрочный прогноз у пациентов с СД с подтвержденным коронароангиосклерозом (независимо от типа) выше, чем у пациентов без СД, и ассоциирована с дисфункцией почек и сердца, повышенной активацией медиаторов воспаления, гемостаза и факторов повреждения эндотелия. Сложный клинический профиль пациентов с мультифокальным атеросклерозом и СД определяет комплексный подход при разработке программы обследования (учитывая возможность бессимптомого течения патологии), агрессивную тактику терапии и важность мер профилактики.



