Во всем мире большие финансовые затраты, связанные с высокой частотой повторных госпитализаций больных и неблагоприятным прогнозом, продолжают определять медицинскую и социально-экономическую значимость хронической сердечной недостаточности (ХСН) [1—5]. С начала XXI века в экономически развитых станах и отдельных регионах России отмечается тенденция к улучшению прогноза у больных с ХСН с низкой фракцией выброса (ФВ) левого желудочка — ЛЖ (СН-нФВ) [3]. За прошедшее десятилетие в стандарты ведения таких пациентов вошли новые, в том числе высокотехнологичные методы лечения, неоднократно обновлялись рекомендации по медикаментозной терапии. В настоящее время больной с СН-нФВ II—IV функционального класса (ФК) должен не только получать оптимальное медикаментозное лечение, но и рассматриваться как потенциальный кандидат на ресинхронизирующую терапию (РТ), имплантацию кардиовертера-дефибриллятора или трансплантацию сердца.
Необходимость создания электронных баз данных российских больных с ХСН, сведения в которых будут постоянно обновляться, контролироваться и статистически обрабатываться координационным центром, активно обсуждается в российском сообществе кардиологов. Непрерывный сбор и анализ информации, а также доступность ее для всех участвующих в исследовании учреждений здравоохранения позволят оценить качество медицинской помощи и наметить пути для ее улучшения согласно общепринятым стандартам диагностики и лечения пациентов с данной патологией, создав платформу для открытого обсуждения этих важных вопросов.
Цель исследования: получение информации о клинико-эпидемиологических характеристиках, применении современных рекомендаций по диагностике и терапии у пациентов с СН-нФВ, проходящих лечение в отдельных стационарах 3 субъектов РФ, на основании данных оригинального госпитального регистра больных с ХСН — RUS-HFR.
Материал и методы
Регистр больных с ХСН. В 2012 г. сотрудниками научно-исследовательского отдела сердечной недостаточности (НИО СН) Северо-Западного федерального медицинского исследовательского центра (ФМИЦ им. В.А. Алмазова) была разработана компьютерная база данных «Российский госпитальный регистр хронической сердечной недостаточности (RUssian hoSpital Heart Failure Registry — RUS-HFR). RUS-HFR охватывает более 250 характеристик, включая этиологию, факторы риска развития СН-нФВ, данные о сопутствующей патологии, клиническом и лабораторном статусе, результатах инструментальных исследований, сведения о терапии ХСН, течении стационарного периода, рекомендациях при выписке, методе амбулаторного наблюдения и исходе. Критериями отбора пациентов в RUS-HFR были возраст 18—75 лет, наличие медицинской карты стационарного больного, диагноз ХСН на момент госпитализации, ФВ ЛЖ ≤40% (Simpson). Не включали в регистр пациентов с текущим инфарктом миокарда и тромбоэмболией легочной артерии, а также находящихся в листе ожидания трансплантации сердца.
Организация, техническое описание и безопасность. RUS-HFR был организован как госпитальный регистр с включением больных с СН во время стационарного лечения и дальнейшим проспективным наблюдением пациентов каждые 6 мес. Финансирование работы осуществлялось за счет средств МЗ РФ в рамках госзадания на 2012—2014 гг. В работе Регистра приняли участие 3 стационара, имеющие отделения кардио-логического профиля: ФГБУ СЗФМИЦ (ФМИЦ), ГБОУ ВПО «Оренбургская государственная медицинская академия» (ОрГМА), ГБУЗ «Самарский областной клинический кардио-логический диспансер» (СОККД). В ходе инициирующего визита в регионах координаторами программы научными сотрудниками НИО СН было проведено обучение персонала порядку ввода данных и особенностям работы с RUS-HFR.
В 2012—2014 гг. исполнители вводили в регистр данные из историй болезни, затем в сроки 6 и 18 мес осуществляли телефонные контакты с этими пациентами. Доступ к данным RUS-HFR производили путем двухфакторной авторизации для исключения утечки персональных данных, а обмен информацией осуществлялся в деперсонализированном виде. Во ФМИЦ включали только жителей Северо-Западного региона РФ, находящихся на лечении в разных отделениях центра, при этом соотношение пациентов, лечившихся в специализированном отделении СН и получающих терапию в других отделениях, составило 2:3. В СОККД и ОрГМА проводили анализ пациентов, госпитализированных в отделения неотложной кардиологии.
Статистическую обработку данных проводили с использованием программы «SPSS» ver.15. Данные представлены в виде М±SD, где М — среднее значение, SD — стандартное отклонение.
Результаты
Полученные в разных центрах данные при изложении материала частично ослеплены.
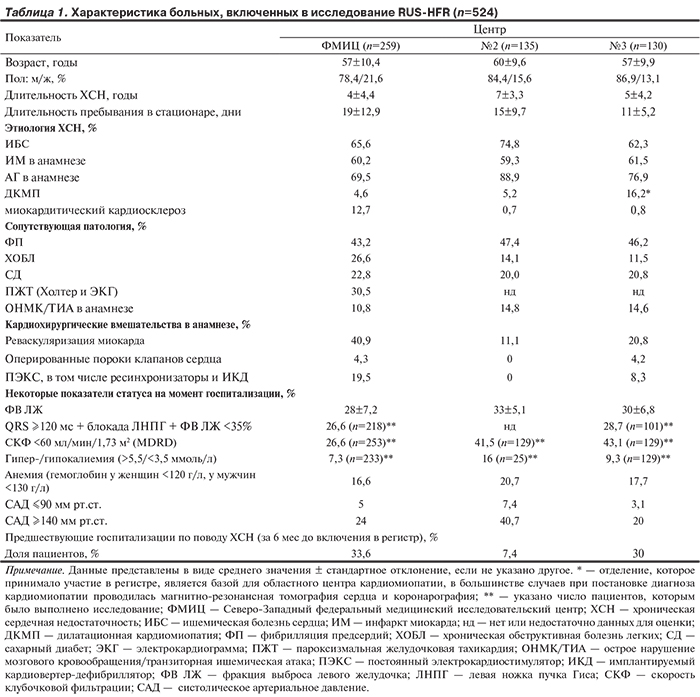
Пациенты. С октября 2012 г. по июнь 2014 г. в регистр были включены 524 человека, основные характеристики которых представлены в табл. 1.
Средний возраст составил около 60 лет, доля мужчин — около 80%. Большинство пациентов имели несколько конкурирующих в отношении этиологии ХСН заболеваний. Ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ) были у 62—75% и 69—89% больных соответственно. Частота выявления фибрилляции предсердий (ФП) в разных центрах колебалась незначительно (43—47%). Кардиомиопатии в ФМИЦ и ОрГМА диагностировали в 4—5% случаев. Практически каждый 5-й больной имел сахарный диабет (СД), 12—27% больных — хроническую обструктивную болезнь легких (ХОБЛ). У 27—43% пациентов была хроническая болезнь почек (скорость клубочковой фильтрации — СКФ по MDRD <60 мл/мин/1,73 м2); около 2% госпитализированных в ФМИЦ имели СКФ MDRD <30 мл/мин/1,73 м2. Пароксизмальные желудочковые тахикардии по данным суточного мониторирования электрокардиограммы — ЭКГ (выполнено у 100% включенных пациентов ФМИЦ) и обычной ЭКГ имелись почти у 1/3 пациентов. Существенных половых различий в этиологии, давности ХСН (около 5 лет), наличии сопутствующих заболеваний не было. Ранее реваскуляризацию миокарда перенесли 11—41% пациентов, 0—4% пациентов были оперированы с целью коррекции клапанных пороков, постоянный электрокардиостимулятор (ПЭКС) был имплантирован у 0—19,5% больных, бивентрикулярный ПЭКС (РТ) и имплантируемый кардиовертер-дефибриллятор (ИКД) исходно имели 4,3 и 5,5% пациентов из ФМИЦ.
Причины госпитализации. В зависимости от профиля и возможностей лечебных учреждений соотношение причин госпитализации различалось, основные из них представлены в табл. 2.

Более чем в 50% случаев в ОрГМА и СОККД госпитализация была связана с декомпенсацией ХСН, тогда как во ФМИЦ преобладали плановые госпитализации для медикаментозного или кардиохирургического лечения, а с декомпенсацией ХСН госпитализировался лишь каждый 6-й пациент.
Данные объективного осмотра и инструментальных исследований. На момент поступления в стационар большинство больных имели ХСН III ФК (44,6—58,5%), II ФК и IV ФК ХСН диагностировали у 17,8—39,8% и 11,5—23,7% пациентов соответственно (табл. 3).
Эхокардиография в течение последних 12 мес была выполнена у всех пациентов. ФВ ЛЖ составляла 28—33% (см. табл. 1). Рентгенологическое исследование органов грудной клетки при поступлении было выполнено в 61,5—74,6% случаев, при этом признаки застойных явлений в проекции корней легких выявлены лишь у 31,1—45,4% больных с клинически выраженной ХСН. Исследование содержания N-концевого предшественника мозгового натрийуретического пептида выполнено только 15 больным из ФМИЦ (в научных целях), где данный показатель составил 4553±3480 пг/мл.
Большинство пациентов при поступлении имели целевой уровень артериального давления (АД), у 3—7% отмечалась гипотония, а у 20—41% — некорригированная АГ (см. табл. 1).
Длительность комплекса QRS ≥120 мс (показатель, использующийся в определении показаний к РТ) при ФВ ≤35% отмечена у 26,6 и 28,7% пациентов из ФМИЦ и СОККД соответственно. Из них у 17% пациентов из ФМИЦ и у 20,7% из СОККД величина комплекса QRS составляла более 150 мс.
Терапия, длительность пребывания в стационаре. Медикаментозная терапия оценивалась как при поступлении (ФМИЦ и центр №3), так и при выписке из стационара (табл. 4).
По сравнению с данными 10-летней давности, полученными в исследованиях серии ЭПОХА, к 2013 г. доля пациентов, получающих ингибиторы ангиотензинпревращающего фермента (АПФ) или антагонисты рецепторов ангиотензина II (АРА) и β-адреноблокаторы, существенно возросла, однако во время стационарного лечения практически каждому четвертому больному из ФМИЦ один из основных препаратов для лечения ХСН назначался впервые. Более 45% пациентов с клинически выраженной ХСН на догоспитальном этапе вообще не получали диуретики. Так, при поступлении 55,5% больных из ФМИЦ с ХСН II ФК не принимали диуретики и антагонисты минералокортикоидных рецепторов (АМКР), а 34,4% получали АМКР без диуретической терапии. Сочетание петлевой/тиазидный диуретик + АМКР, соответствующее современным рекомендациям [6], получали только 26,7% больных из данной группы, т.е. чуть более 1/4 больных с ХСН II ФК. Отсутствие назначений диуретической терапии и АМКР выявлялось при поступлении во ФМИЦ среди 21,3 и 24,1% больных с III и IV ФК соответственно.

На момент выписки по сравнению с амбулаторным этапом доля пациентов, получающих основные препараты, значительно увеличилась, и уже около 82% больных получали ингибитор АПФ/АРА, более 76% — рекомендованные β-адреноблокаторы (карведилол, метопролола сукцинат, бисопролол, небиволол), терапия АМКР на постгоспитальном этапе была рекомендована в 66—81% случаев, а диуретическая терапия — 81—95% больных. В ОрГМА и в СОККД в 10 раз чаще, чем во ФМИЦ, применяли терапию дигоксином (51,9, 33,1 и 4,6% случаев соответственно), при этом больным с синусовым ритмом этот препарат был назначен только в первых двух центрах (13,1 и 17% случаев соответственно).
В ходе госпитализации у отдельных больных проводилось титрование доз основных препаратов (рис. 1, 2), и, например, во ФМИЦ на момент выписки целевые дозы ингибитора АПФ/АРА, β-адреноблокатора, соответственно, получали уже 9 и 27% респондентов.
Ежедневная оценка массы тела проводилась только у 57% больных с ХСН из ФМИЦ; ее динамика в стационаре составила –2,8±4,2 кг. Инструктаж о правилах жизни, мониторировании массы тела, самоконтроле (брошюра «5 правил жизни с ХСН»), а также число пациентов, информированных об интернет-ресурсе на русском языке для пациентов с ХСН и их родственников (www.heartfailurematters.org), во ФМИЦ составили 100%.
При выписке во всех центрах отмечено снижение ФК ХСН у большинства больных со стабилизацией на уровне II—III ФК ХСН (см. табл. 3).
В результате проведенного обследования и лечения у 38,2% больных из ФМИЦ были определены показания к различным высокотехнологичным методам лечения, в том числе к ИКД — 14,7%, РТ — 7,4%, трансплантации сердца — 6,6% больных. В центре №3 2,3% больных рекомендована имплантация ИКД и РТ; в трансплантации сердца нуждались 3 (2,3%) пациента. В центре №2 показания к высокотехнологичным методам лечения у больных с ХСН не определялись (табл. 5).
Высокая частота определения показаний к трансплантации сердца, отмеченная во ФМИЦ, объясняется тем, что в 2009 г. этот центр был специализирован по такому высокотехнологичному методу лечения, и кардиологи всех отделений хорошо информированы об отборе пациентов в лист ожидания трансплантации.
Средняя продолжительность стационарного лечения в центрах — участниках RUS-HFR составила 11—19 дней, а у пациентов, поступивших по поводу декомпенсации ХСН, — 26±14 и 15±10, 13±5 дня в Санкт-Петербурге, Оренбурге и Самаре соответственно.
Обсуждение
RUS-HFR — госпитальный регистр больных СН-нФВ, первая регистрация в базе данных которого была произведена в октябре 2012 г. В настоящей статье анализируются результаты госпитального этапа, полученные на июнь 2014 г. по 524 пациентам. Данные проспективного наблюдения в RUS-HFR будут представлены позже.
 Характеристика больного. В RUS-HFR средний возраст больных, как и в прежних исследованиях в РФ, составил около 60 лет [7]. Этот показатель в большинстве зарубежных регистров СН варьирует в пределах 55—79 лет, а более старшие больные (средний возраст 70—75 лет) госпитализируются в основном из-за декомпенсированной или острой СН; примерно 50—60% из них также составляют мужчины [2, 4, 5].
Характеристика больного. В RUS-HFR средний возраст больных, как и в прежних исследованиях в РФ, составил около 60 лет [7]. Этот показатель в большинстве зарубежных регистров СН варьирует в пределах 55—79 лет, а более старшие больные (средний возраст 70—75 лет) госпитализируются в основном из-за декомпенсированной или острой СН; примерно 50—60% из них также составляют мужчины [2, 4, 5].
Верификация диагноза ХСН. Возможно, верификация ХСН при наличии предшествующей истории заболевания большинству больных и не требуется, и такие исследования, как рентгенография легких и исследование уровня натрийуретических пептидов в крови, проводились пациентам нашего регистра по иным соображениям (научные цели, поиски заболеваний легких и т.д.). Однако рентгенологическое исследование органов грудной клетки при поступлении было выполнено во всех стационарах более чем 60% пациентов с СН-нФВ, при этом признаки застойных явлений в проекции корней легких выявляли лишь у 31,1—45,4% больных с клинически выраженной ХСН. Расхождение клинического и рентгенологического диагнозов может быть связано с нацеленностью современных рентгенологов преимущественно на описание очаговой патологии легких. К сожалению, рентгенография органов грудной клетки имеет высокую вариабельность и низкую воспроизводимость. Так, в регистре ADHERE (85 376 участников, США) 20% пациентов не имели признаков легочного застоя по данным рентгенологического исследования даже при острой или декомпенсированной СН [8]. Вероятно, следует констатировать снижение диагностической значимости этой повседневной процедуры.
Определение уровня натрийуретических пептидов в настоящее время не влияет на выбор тактики терапии ХСН, а точная оценка прогноза не входит в стандарты медицинского вмешательства, вследствие чего такое исследование не оплачивается. Подобное отношение к этому показателю отражает и то, что во многие зарубежные регистры СН данные по уровню мозгового натрийуретического пептида или его N-концевого предшественника не включались, либо наблюдалась низкая доступность оценки этих маркеров для большинства пациентов, особенно в странах Восточной Европы [2, 9].
Этиология ХСН, сопутствующая патология. Как и в других российских исследованиях, ИБС и АГ были основными факторами развития ХСН у пациентов RUS-HFR, а распространенность ХОБЛ, СД и ФП осталась высокой [7]. В целом причины развития СН-нФВ в РФ не отличаются от мировых. По данным регистра ESC-HF Pilot, включавшего 5118 пациентов (63 и 37% с хронической и острой СН соответственно; более чем у 64% из них ФВ ЛЖ <45%), ИБС и АГ были основными причинами СН-нФВ преимущественно в странах Восточной Европы. Низкая распространенность дилатационной кардиомиопатии в регистре RUS-HFR согласуется с ранее полученными данными российской выборки Euro Heart Survey [7]. В крупных зарубежных госпитальных регистрах ХОБЛ, ФП, СД и ХБП диагностировали у 15—31%, 24—44%, 27—45% и 17—53% пациентов соответственно, причем ФП и СД являлись независимыми предикторами неблагоприятного прогноза при СН-нФВ [2, 4]. Эти состояния влияют на механизмы прогрессирования СН и по-прежнему ограничивают как начало назначения, так и дальнейшее титрование препаратов, рекомендованных для современной терапии, что осложняет лечение таких больных.
В регистре RUS-HFR 3—7% пациентов при поступлении имели артериальную гипотензию (систолическое АД ≤90 мм рт.ст.), а более 20% — неконтролируемую АГ. Последний факт особенно тревожен, так как АГ всегда способствует прогрессированию систолической дисфункции ЛЖ, при этом являясь корректируемым и легко управляемым фактором при учете возможностей современной фармакотерапии. Аналогично следует рассматривать и анемию, отмеченную у 1/5 больных. Выраженное нарушение функции почек (СКФ по MDRD <30 мл/мин/1,73 м2) зарегистрировано лишь у 2% пациентов, а в европейских регистрах число таких случаев составляет 5—10% [4], что может быть связано с госпитализацией в этих странах преимущественно больных более преклонного возраста или с острой СН.
Контроль состояния больных в ходе терапии. Ежедневная оценка массы тела пациента, являющаяся важным индикатором течения ХСН как в период декомпенсации, так и при стабильном течении, проводилась лишь у 57% больных и только в одном из центров.
Стандартная терапия СН-нФВ. По сравнению с данными 10-летней давности (серия исследований ЭПОХА), а также материалами нашей ранней публикации, посвященной анализу медикаментозной терапии у пациентов с ХСН в условиях специализированной клиники в 2002—2003 гг. [10], число больных в RUS-HFR, получающих ингибиторы АПФ/АРА, β-адреноблокаторы, АМКР, существенно увеличилось и стало сопоставимым с показателями европейских регистров. Так, по данным амбулаторной части исследования ESC-HF Long-Term Registry (4792 участника, 2011—2013 гг.) пациенты с ХСН и ФВ ЛЖ ≤45% получали в 92,7, 92,2 и 67% случаев β-адреноблокаторы, ингибиторы АПФ/АРА и АМКР соответственно.
В большинстве международных регистров доля больных с ХСН, получающих β-адреноблокаторы, ингибиторы АПФ/АРА и АМКР, существенно увеличивается на момент выписки [2], такое же явление отмечено и в регистре RUS-HFR. Начало терапии ХСН в стационарных условиях, где легче осуществлять ее коррекцию и контроль в связи с высокой распространенностью сочетанной патологии у пациентов в данной выборке, является одним из лучших предикторов ее длительного использования. Однако недостаточно начать основную терапию в стационаре, ее необходимо максимально оптимизировать, имея возможность лабораторного контроля. Уже 10 лет назад в отделении сердечной недостаточности ФМИЦ на послегоспитальный этап пациентам с ХСН β-адреноблокаторы назначались в 77,9% случаев, ингибиторы АПФ/АРА — в 82,5%, АМКР — в 55,8% [10], но как правило, это были начальные и небольшие дозы. К 10-м годам XXI века титрование доз основных препаратов, независимо от причины госпитализации, стало правилом во всех кардиологических отделениях центра. К сожалению, в настоящее время использование целевых доз основных препаратов по-прежнему остается прерогативой научных медицинских центров, а не обычных стационаров или амбулаторной службы не только в РФ [2, 11, 12]. Например, лишь 17,5—30,5% пациентов из ESC-HF Long-Term Registry получали целевые дозы данных препаратов, при этом в 1/3 случаев причина отсутствия титрования препаратов была неизвестна [5].
В RUS-HFR не применяли диуретическую терапию до госпитализации более 45% пациентов с клинически выраженной ХСН (т.е. при СН >I ФК). Объемы и состав диуретической терапии до поступления в клинику также существенно отличались от тактики ее применения в стационаре, где, например, применение комбинации петлевых диуретиков с тиазидным диуретиком и ацетазоламидом, а также сопутствующее применение адекватных доз АМКР в настоящее время достаточно освоены врачами. Алгоритмы диуретической терапии в зависимости от тяжести ХСН четко представлены в Национальных Рекомендациях по лечению ХСН (2013 г.) и детализированы в качестве мнения экспертов по назначению мочегонных препаратов при задержке жидкости в 2014 г. [6]. Подробный анализ ошибок в тактике диуретической терапии части выборки RUS-HFR как на момент госпитализации, так и при выписке был подробно описан нами ранее [13]. Основными причинами не соответствующих рекомендациям вариантов диуретической терапии у больных с ХСН на догоспитальном этапе являются «нелюбовь» пациентов к мочегонным препаратам и недостаточная информированность врачей амбулаторного звена о возможностях современных препаратов этой группы. Однако и в ESC-HF Long-Term Registry 35% таких больных на догоспитальном этапе не получали диуретической терапии [5], что не позволяет отнести отечественных пациентов с ХСН к уникальной группе «нелюбителей» диуретиков. Частота назначения диуретической терапии в RUS-HFR на постгоспитальный этап была довольно высокой и не отличалась от результатов международных регистров (83,6% пациентов) [5].
Наиболее существенные различия между центрами были выявлены по частоте применения дигоксина, которая составила 4,6% среди больных из ФМИЦ и была в 10 раз выше в СОККД и ОрГМА, при этом более чем в 40% случаев препарат был рекомендован пациентам с синусовым ритмом. Пациенты, включенные в исследование ЭПОХА-О-ХСН, получали сердечные гликозиды лишь в 5,8% случаев [14]. Частота назначения данного препарата как амбулаторно, так и при выписке из стационара в исследовании ESC-HF Long-Term Registry составила около 20%, при этом отмечены достоверные различия по частоте назначения дигоксина пациентам на амбулаторном этапе (19,5%) и после выписки (26,4%) [5]. Причины назначения или отмены дигоксина в RUS-HFR на текущий момент не анализировались.
Высокотехнологичные методы терапии ХСН. Имплантированные устройства на момент поступления имели преимущественно пациенты ФМИЦ; помимо этого, еще 14,7 и 7,4% больных с СН-нФВ при выписке из данного центра были определены показания к постановке ИКД и РТ соответственно. В исследовании ESC-HF Pilot число пациентов, подвергающихся установке имплантируемых устройств, зависело от уровня здравоохранения стран ЕЭС и составляло 3,9—18,4% для ИКД и 0,3—11,9% для РТ [4], а в исследовании ESC-HF Long-Term Registry, несмотря на наличие показаний, имплантация таких устройств не планировалась в 44 и 40% случаев соответственно. Причинами такой ситуации служили неосведомленность врачей, отказ больного и материально-технические аспекты [5].
Средняя продолжительность стационарного лечения пациентов в регистре RUS-HFR составила 11—19 дней и была больше во ФМИЦ, что связано, во-первых, со спецификой работы центра, где больным с ХСН выполняются плановые кардиохирургические вмешательства, а во-вторых, с наличием специализированного отделения СН. По данным исследования ЭПОХА-О-ХСН, в начале XXI века продолжительность пребывания больных в стационаре при декомпенсации СН составляла 27 дней, что в 2,5—5,5 раза превышает аналогичные показатели в странах Европы (11 дней) и США (5 дней) [15], но вполне соотносится с данными авторов из Японии (31—35 дней). Наиболее крупные регистры Японии — ATTEND (Аcute decompensated heart failure syndromes registry) и JCARE-CARD (Japanese Cardiac Registry of Heart Failure in Cardiology) демонстрируют, что при этом летальность при СН не превышает аналогичные показатели западных регистров, а длительное пребывания больных в стационаре предоставляет возможность титрования препаратов и коррекции факторов риска [16, 17]. Возможно, это и есть один из путей для оптимизации прогноза у пациентов данной категории.
Выводы
- База данных, разработанная для регистра RUS-HFR, позволяет всесторонне оценить в динамике как клинико-эпидемиологические показатели, так и результаты лечения современного пациента с сердечной недостаточностью, и может стать основой для проведения более масштабного мониторирования эффективности терапии сердечной недостаточности.
- По сравнению с данными 10-летней давности в целом характеристика больного с сердечной недостаточностью и низкой фракцией выброса в Российской Федерации не изменилась, однако стала ощутимой доля больных, перенесших кардиохирургические и электрофизиологические вмешательства.
- Число пациентов, получающих терапию ингибиторами ангиотензинпревращающего фермента/антагонистами рецептора ангиотензина II, β-адреноблокаторами и антагонистами минералокортикоидных рецепторов, сопоставимо в настоящее время с показателями европейских регистров, однако на догоспитальном этапе выявлены статистически значимые несоответствия рекомендациям по медикаментозной терапии, а на момент выписки из стационара недостаточное внимание уделяется немедикаментозным методам воздействия и ориентации больных на высокотехнологичные методы терапии хронической сердечной недостаточности.
- Госпитализации, не связанные с острой декомпенсацией сердечной недостаточности, составляют 5— 37%, а их длительность, как и длительность пребывания больных в стационаре по причине острой декомпенсации хронической сердечной недостаточности, значительно превышает этот показатель в ЕС и США, однако предоставляет возможность титрования доз основных препаратов и оптимизации диуретической терапии для лечения хронической сердечной недостаточности.
- Отсутствие у отдельных пациентов RUS-HFR обязательной медикаментозной терапии до поступления в стационар поднимает вопросы о коррекции приверженности пациентов лечению, а также о создании системы их специализированного амбулаторного контроля после выписки.



