Согласно данным Всемирной организации здравоохранения, тромбоэмболия легочной артерии (ТЭЛА) является третьей по распространенности причиной смерти при сердечно-сосудистых заболеваниях после острого коронарного синдрома и инсульта [1]. Хроническая ТЭЛА — одно из самых тяжелых осложнений острой формы данного заболевания. В 25% случаев ТЭЛА единственным проявлением катастрофы служит внезапная смерть [2].
Радикальным методом лечения хронической ТЭЛА является операция тромбэндартерэктомии (ТЭЭ) из ветвей легочной артерии (ЛА) в условиях искусственного кровообращения (ИК) и глубокой гипотермической остановки кровообращения [3—5]. Риск повреждения нервной системы у больных хронической ТЭЛА связан как с исходной гипоксией, так и с усугублением гипоксии тканей головного мозга (ГМ) при хирургическом лечении в результате длительной искусственной перфузии и применения остановки кровообращения [6]. Полное прекращение кровообращения в ГМ может привести к развитию глобальной ишемии ГМ и тяжелых неврологических осложнений [7, 8].
В настоящее время существуют альтернативные методы проведения ИК [9, 10]. В ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава РФ внедрен метод проведения операции ТЭЭ из ЛА в условиях умеренной гипотермии с антеградной унилатеральной перфузией ГМ (АПГМ). Данный метод является одним из важных направлений предупреждения послеоперационных цереброваскулярных осложнений, хорошо зарекомендовавшим себя при проведении реконструктивных операций на дуге аорты [11, 12].
Цель исследования: оценить риск развития церебральных осложнений на фоне различных способов защиты ГМ при хирургическом лечении больных хронической ТЭЛА.
Материал и методы
В исследование включен 61 пациент с диагнозом хроническая ТЭЛА, хроническая посттромбоэмболическая легочная гипертензия, поступивший на оперативное лечение в ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава РФ за период с июля 2011 г. по октябрь 2013 г. Средний возраст больных составил 48 (39—54) лет. Диагноз был установлен по данным ангиопульмонографии с оценкой уровня давления в ЛА, сопротивления сосудов малого круга кровообращения. Пациентам была проведена перфузионная сцинтиграфия легких, мультиспиральная компьютерная томография ветвей ЛА. Объем эмболического поражения оценивался в баллах (индекс Миллера) [13]. Локализация тромбов имела проксимальный характер. У всех пациентов в анамнезе был тромбоз глубоких вен нижних конечностей.
Среди всех больных 42 (69%) составили мужчины, 19 (31%) — женщины. Средняя длительность заболевания достигала 2,8 (1,1—3,2) года. Согласно классификации New York Heart Association (NYHA), состояние 81% пациентов отнесено к III функциональному классу хронической сердечной недостаточности, IV функциональный класс определен в 19% случаев.

Всем больным проводили хирургическое лечение в объеме ТЭЭ из ветвей ЛА. В исследование не включали пациентов с гемодинамически значимым поражением брахиоцефальных и интракраниальных артерий, с умеренными или грубыми неврологическими нарушениями до операции, острым нарушением мозгового кровообращения в анамнезе. По данным транскраниальной допплерографии у всех пациентов выявлен замкнутый виллизиев круг.
Всем пациентам была произведена оценка кислородного обеспечения ГМ с использованием билатеральной транскраниальной спектроскопии (церебральный оксиметр). Определяли уровень оксигенации ГМ (rSO2, %) правого и левого полушарий. Во время исследования датчик накладывали на правую и левую лобно-височные области. Церебральная оксиметрия заключается в измерении степени абсорбции света в диапазоне волн от 700 до 1000 нм, проходящего через биологические объекты. В пределах данного диапазона единственными биологическими субстанциями, имеющими кислородозависимые спектры поглощения, являются гемоглобин и цитохромоксидаза. В связи с этим данный метод позволяет оценивать кислородный статус гемоглобина, находящегося в сосудах исследуемой области ГМ. Известно, что венозные сосуды составляют 85% от объема сосудистого русла мозга [14]. Таким образом, метод церебральной оксиметрии позволяет оценить насыщение гемоглобина О2 главным образом в крови церебральных венозных сосудов, с целью оценки выраженности ишемии ГМ. Норма rSO2 соответствует норме сатурации гемоглобина О2 в крови верхней полой вены, т.е. 63—75% [15]. Данный метод является неинвазивным, дает возможность производить мониторинг адекватности перфузии ГМ во время хирургического лечения.
 Оксигенацию левого и правого полушарий ГМ регистрировали на различных этапах операции: 1-й этап — вводный наркоз, 2-й — во время ИК, 3-й этап — ТЭЭ из ветвей ЛА справа, 4-й этап — период реперфузии, 5-й этап — ТЭЭ из ветвей ЛА слева, 6-й — подключение ИК, 7-й — период согревания на фоне ИК, 8-й — остановка ИК, 9-й этап — окончание операции. В ранние сроки после операции проводили оценку послеоперационных неврологических осложнений с учетом способа защиты ГМ во время ТЭЭ.
Оксигенацию левого и правого полушарий ГМ регистрировали на различных этапах операции: 1-й этап — вводный наркоз, 2-й — во время ИК, 3-й этап — ТЭЭ из ветвей ЛА справа, 4-й этап — период реперфузии, 5-й этап — ТЭЭ из ветвей ЛА слева, 6-й — подключение ИК, 7-й — период согревания на фоне ИК, 8-й — остановка ИК, 9-й этап — окончание операции. В ранние сроки после операции проводили оценку послеоперационных неврологических осложнений с учетом способа защиты ГМ во время ТЭЭ.
Хирургическое лечение всем пациентам проводилось в условиях ИК в непульсирующем режиме. Объемную скорость перфузии поддерживали на уровне 2,5 л/мин/м2.
Все пациенты были разделены на 2 группы. В 1-ю группу вошли 22 больных, которым выполнялось оперативное лечение в условиях умеренной гипотермии (25 °С) с проведением АПГМ во время ТЭЭ из ветвей ЛА; 2-ю группу составили 39 пациентов, у которых во время ТЭЭ применялась остановка кровообращения на фоне перфузионного охлаждения организма до 20 °С с краниоцеребральной гипотермией (обкладывание головы пациента льдом).
В 1-й группе пациентов ТЭЭ из ветвей ЛА выполняли после пережатия брахицефальной артерии и начала АПГМ с объемной скоростью 10 мл/кг/мин и поддержанием давления в правой лучевой артерии 55—100 мм рт.ст. После выполнения ТЭЭ из правой ЛА снимали зажим с брахицефальной артерии и объемную скорость перфузии увеличивали до расчетной — начинался этап реперфузии продолжительностью 50% от времени АПГМ. Затем вновь закрывали брахицефальную артерию и АПГМ возобновляли на период ТЭЭ из левой ЛА.
Во 2-й группе больных ТЭЭ из ветвей ЛА выполняли в условиях гипотермической остановки кровообращения и краниоцеребральной гипотермии. Охлаждение пациента проводили с температурным градиентом 7—8 °С. После ТЭЭ также выполняли реперфузию с полной расчетной скоростью продолжительностью 50% от времени гипотермической остановки кровообращения. Согревание пациента начинали после проведения основного этапа операции с градиентом 5 °С.
Всем пациентам проводили стандартный периоперационный мониторинг, включающий непрерывную пульсоксиметрию, регистрацию электрокардиограммы, частоты сердечных сокращений, артериального и центрального венозного давления. На различных этапах операции определяли газовый состав артериальной и венозной крови. Для анализа использовали данные: PCO2 — парциальное давление углекислого газа в крови; PO2 — парциальное давление кислорода в крови; О2SAT — насыщение крови кислородом. Анализировали концентрацию общего гемоглобина в крови (Hb), гематокрит (Ht), параметры гемодинамики — среднее артериальное давление — АДср. (систолическое АД – диастолическое АД)/3 + диастолическое АД).
Статистический анализ полученных данных проведен с использованием пакета статистических программ Statistica 6.0 (США). Данные представлены в виде медианы (25-й процентиль; 75-й процентиль). Достоверность различий зависимых величин определяли по критерию Вилкоксона, независимых — по критерию Манна—Уитни, для качественных признаков применяли критерий χ2. Взаимосвязь параметров оценивали с использованием коэффициента ранговой корреляции Спирмена. Достоверными принимали значения при p<0,05.
Результаты
В табл. 1 представлена клинико-функциональная характеристика больных хронической ТЭЛА, которым в последующем было проведено хирургическое лечение в виде ТЭЭ с использованием АПГМ (1-я группа) и гипотермической остановки кровообращения с краниоцеребральной гипотермией (2-я группа).
Согласно представленным данным, у пациентов обеих групп имелось выраженное нарушение перфузии легких — индекс Миллера более 20, что привело к увеличению давления в ЛА и сопротивления сосудов малого круга кровообращения. По данным показателям статистически значимых разичий между группами не было. Хроническое препятствие на пути оттока из правого желудочка приводит к увеличению давления в его полости и соответственно к гипертрофии миокарда с последующим истощением компенсаторных механизмов в процессе прогрессирующей гипертензии малого круга кровообращения. В результате данных изменений увеличиваются размеры правого желудочка и снижается его сократительная способность, что показано в табл. 1 у пациентов обеих групп. Сократительная способность миокарда левого желудочка у пациентов обеих групп была в пределах нормы, при этом отмечено уменьшение размеров и объемов данной камеры сердца. Статистически значимых различий по данным показателям между группами не выявлено.
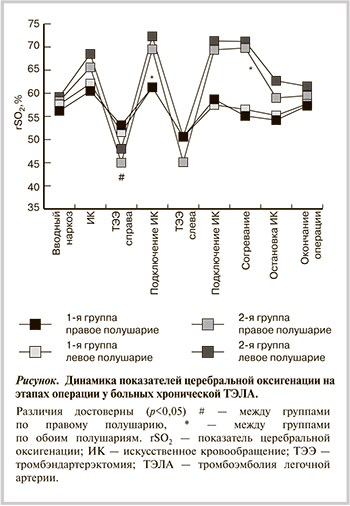
На рисунке представлены данные церебральной оксигенации (Me rSO2) по правому и левому полушариям ГМ у больных хронической ТЭЛА обеих групп на различных этапах операции.
На этапе вводного наркоза в 1-й и во 2-й группах показатели rSO2 полушарий ГМ были ниже 60%, что свидетельствует о снижении исходных показателей кислородного обеспечения ГМ у пациентов данной категории.
На 2-м этапе во время ИК у пациентов обеих групп регистрировалось статистически значимое увеличение rSO2 по сравнению с предыдущими данными (p<0,05), что связано со снижением метаболических потребностей ГМ на фоне анестезии и гипотермии.
На 3-м этапе во время ТЭЭ из ЛА справа у пациентов 1-й группы с применением АПГМ регистрировалось снижение rSO2 правого и левого полушарий на 14 и 17% соответственно по отношению к предшествующим показателям во время ИК (p<0,05). У пациентов 2-й группы регистрировалось более выраженное снижение кислородного обеспечения ГМ по правому и левому полушариям — на 29 и 26% соответственно, что статистически значимо отличалось от 1-й группы (p<0,05). Кроме того, на данном этапе операции выявлены статистически значимые различия между группами в абсолютных значениях rSO2 по правому полушарию (p<0,05).
Таким образом, у пациентов 1-й группы максимальное снижение rSO2 во время ТЭЭ из ЛА справа не превышало 20%, у пациентов 2-й группы снижение данных показателей было больше 25% по отношению к исходным величинам.
На 4-м этапе (реперфузия) абсолютные значения rSO2 полушарий ГМ во 2-й группе составили около 70% и превышали данные показатели на 2-м этапе (p<0,05). При этом уровень rSO2 справа и слева в данной группе больных был статистически значимо выше, чем в 1-й, что связано с более выраженным снижением метаболических потребностей ГМ на фоне общего охлаждения организма в сочетании с краниоцеребральной гипотермией.

Во время ТЭЭ слева (5-й этап) у больных 1-й группы регистрировалось более значительное снижение кислородного обеспечения ГМ по правому и левому полушариям (на 18 и 20% соответственно) по сравнению с 3-м этапом (p<0,05). У больных 2-й группы также было выявлено более выраженное снижение rSO2 справа и слева (на 34 и 31% соответственно; p<0,05). Снижение кислородного обеспечения ГМ в процентах от исходного фона было статистически значимо больше во 2-й группе больных (p<0,05).
После ТЭЭ в динамике от начала согревания (7-й этап) к моменту остановки ИК (8-й этап) во 2-й группе пациентов отмечено выраженное снижение rSO2 справа и слева (p<0,05), что отражает увеличение метаболических потребностей ГМ на фоне повышения общего температурного фона и завершения гипотермической защиты ГМ. В 1-й группе на фоне умеренной гипотермии не отмечено статистически значимого снижения rSO2 в период остановки ИК. На этапе согревания во 2-й группе больных после завершения остановки кровообращения на фоне общей и краниоцеребральной гипотермии значения rSO2 обоих полушарий оставались выше, чем в 1-й группе (p<0,05), за счет неполностью восстановленной метаболической активности ГМ. В конце хирургического лечения статистически значимых различий по rSO2 в обеих группах не выявлено.
Таким образом, применение глубокого перфузионного охлаждения организма и краниоцеребральной гипотермии способствует более выраженному снижению метаболических потребностей ГМ. Это отражается в более высоких уровнях rSO2 во время ИК по сравнению с таковыми у пациентов, которым выполнялась операция в условиях умеренной гипотермии. Следует отметить, что применение остановки кровообращения во время ТЭЭ вызывает наиболее резкое снижение церебральной перфузии и соответственно кислородного обеспечения ГМ по сравнению с таковой у пациентов, у которых применялась АПГМ.
При анализе корреляций между rSO2 и периоперационными показателями газового состава крови была выявлена прямая взаимосвязь между уровнем rSO2 на этапе вводного наркоза и парциальным давлением СО2 в артериальной крови по правому полушарию (r=0,41; p<0,05) и левому полушарию (r=0,42; p<0,05). Во время ИК данные связи исчезали, а в конце операции при отключении ИК возобновлялись (r=0,36; p<0,05). Выявлена прямая взаимосвязь между rSO2 и уровнем парциального давления О2 венозной крови на 2-м этапе во время ИК (r=0,44; p<0,05), а также во время согревания после ТЭЭ (6-й этап) (r=0,45; p<0,05). Это объясняется тем, что кровь, протекающая через ГМ, на 85% является венозной. Показатель гематокрита венозной крови на 2-м этапе во время ИК обратно взаимосвязан со значениями rSO2 слева и справа во время ТЭЭ справа (3-й этап) — r= –0,45; p<0,05 и r= –0,38; p<0,05 соответственно, а также со значениями rSO2 во время ТЭЭ слева (5-й этап) — r= –0,43; p<0,05 и r= –0,40; p<0,05 соответственно. Общий температурный фон во время различных этапов операции был обратно взаимосвязан с показателями rSO2, что объясняется снижением метаболических потребностей ГМ при гипотермии. Значения данных взаимосвязей составляли от r= –0,33; p<0,05 до r= –0,45; p<0,05. Были выявлены обратные взаимосвязи между продолжительностью снижения абсолютных показателей rSO2 ниже 40% при ТЭЭ слева (5-й этап) и абсолютными значениями rSO2 слева и справа на последующем 6-м этапе в период согревания — r= –0,35; p<0,05 и r= –0,42; p<0,05 соответственно.
Таким образом, на этапе вводного наркоза, а также в конце операции после отключения ИК на фоне частично сохранной ауторегуляции мозгового кровотока ведущим фактором, влияющим на значения церебральной оксигенации, является уровень СО2 артериальной крови. Необходимо учитывать показатели реологии крови, так как на значения rSO2 при ТЭЭ влияет уровень Ht во время ИК, а также обращать особое внимание на снижение абсолютных показателей rSO2 ниже критического значения (40%) во время ТЭЭ.
В табл. 2 приведены лабораторные показатели крови и гемодинамики пациентов обеих групп на различных этапах операции.
Во время ИК у пациентов обеих групп отмечено снижение Hb, Ht артериальной крови по сравнению с показателями на этапе вводного наркоза (p<0,05), что обусловлено гемодилюцией на фоне охлаждения. Снижение Ht до 30% вполне оправдано, так как понижение температурного фона на фоне ИК увеличивает вязкость крови, и только при сниженных показателях Ht можно обеспечить достаточный кровоток в капиллярах тканей, в том числе ГМ. После окончания ТЭЭ из ветвей ЛА во 2-й группе пациентов прослеживалось статистически значимое снижение парциального давления О2 в венозной крови по сравнению с данными во время ИК, что характеризует увеличение потребления О2 тканями на фоне общего согревания (p<0,05). Достоверных различий между группами по лабораторным показателям крови во время операции не было выявлено.
Во время остановки кровообращения при кардиохирургических операциях происходит резкое снижение притока крови к ГМ, приводящее к срыву регуляции мозговой гемодинамики, нарушению мозгового кровообращения и развитию ишемии [17]. В связи с этим актуальна проблема неврологических осложнений, так как даже удачно проведенная операция при наличии неврологического осложнения в лучшем случае обусловливает необходимость длительной реабилитации.

Мы провели анализ неврологического статуса в ранний послеоперационный период у больных хронической ТЭЛА в зависимости от методов защиты ГМ во время операции (табл. 3).
У пациентов 2-й группы с применением гипотермической остановки кровообращения и значительным снижением rSO2 (>30%) во время ТЭЭ по отношению к исходным показателям в 28% случаев выявлены неврологические осложнения. Острая недостаточность мозгового кровообращения (ОНМК), выявленная у 2 пациентов, регистрировалась в бассейнах левой и правой внутренних сонных артерий. Умеренно выраженная постгипоксическая энцефалопатия регистрировалась у 9 пациентов и включала следующие симптомы: замедленное пробуждение, снижение памяти и внимания. В данной группе больных снижение абсолютных показателей rSO2 во время ТЭЭ ниже критических значений (<40%) было зафиксировано у 13 (33%) пациентов, при этом больные с нарушением неврологического статуса в ранний послеоперационный период входили в это число. В 1-й группе больных с применением АПГМ и снижением rSO2 правого и левого полушарий на этапе ТЭЭ не более 20% от исходного в ранний послеоперационный период нарушения неврологического статуса регистрировались у 2 человек: 1 — с умеренно выраженной постгипоксической энцефалопатией и 1 — с ОНМК в бассейне левой внутренней сонной артерии. У пациента, перенесшего ОНМК, регистрировалось снижение абсолютных показателей rSO2 во время ТЭЭ ниже 40%. Таким образом, доля прооперированных больных с хронической ТЭЛА с нарушениями неврологического статуса в ранний послеоперационный период была статистически значимо больше в группе с применением остановки кровообращения во время ТЭЭ (критерий χ2, p<0,05) по сравнению с группой больных, у которых во время ТЭЭ применялась АПГМ.
Во 2-й группе больных продолжительность ИК была статистически значимо больше, чем в 1-й (p<0,05), за счет периода согревания пациента (см. табл. 3). По общей продолжительности ТЭЭ справа и слева данные группы пациентов не различались между собой (p>0,05).
Обсуждение
Вопросы профилактики нарушений мозгового кровообращения во время кардиохирургических операций остаются актуальными и в настоящее время, так как это формирует не только значительную часть операционной смертности, но и радикально влияет на качество жизни больных [18].
Основными повреждающими факторами при ИК являются гипоперфузия и эмболия, дополнительными — непульсирующий характер и нарушение ауторегуляции мозгового кровотока, изменения гематоэнцефалического барьера, системные проявления воспаления, ишемическое и реперфузионное повреждение [19—21]. Гипоперфузия служит сопутствующим фактором всех этапов кардиохирургических операций.
Церебральное перфузионное давление — важный показатель, влияющий на оксигенацию ГМ. У здоровых пациентов при АДср. от 50 до 160 мм рт.ст. церебральное перфузионное давление поддерживается механизмами ауторегуляции, но эти механизмы могут плохо работать при проведении анестезии [22]. В связи с этим важным моментом является поддержание оптимального АДср. во время хирургического лечения. В нашем исследовании во время операции АДср. поддерживалось не ниже 70 мм рт.ст.
Основным в регуляции мозгового кровообращения является метаболический фактор. Величина просвета артерий зависит от напряжения СО2 в капиллярах и тканях. При падении парциального давления СО2 до 20 мм рт.ст. в 2 раза снижается мозговой кровоток, что может привести к выраженной ишемии ГМ, вызванной вазоконстрикцией [23]. В нашем исследовании взаимосвязь между rSO2 и парциальным давлением СО2 в артериальной крови на этапах вводного наркоза и в конце операции после отключения ИК отражает возможность регулирования кислородного обеспечения на данных этапах операции за счет поддержания нормокапнии.
Возникающая во время остановки кровообращения гипоперфузия ГМ сопровождается резким уменьшением синтеза макроэргических соединений. Гипоперфузия приводит к увеличению концентрации CO2 и ацидозу, уменьшающему интенсивность кровотока. Накопление недоокисленных продуктов вызывает отек, что может дополнительно усилить нарушение перфузии тканей мозга, особенно в области коры [24, 25]. Особое внимание следует уделять снижению rSO2 на 25% и более от исходных значений во время остановки кровообращения. Исследования показали, что при абсолютных значениях ниже 40% или снижении rSO2 более чем на 25% от исходного уровня развивается постгипоксическая ишемия ГМ, приводящая к нарушениям неврологического статуса [26—28].
Хотя применение глубокой гипотермии при остановке кровообращения снижает метаболические потребности ГМ, потребность мозговой ткани в энергетических субстратах, хотя и в меньшей степени, сохраняется. Поэтому при определенной продолжительности остановки кровообращения в условиях глубокой гипотермии, в отсутствие поступления энергетических субстратов может формироваться метаболическая задолженность, которая впоследствии способна привести к ишемическому повреждению ГМ [29].
В нашем исследовании негативное влияние гипоперфузии во время остановки кровообращения со снижением rSO2 более 30% от исходных значений на этапе ТЭЭ у больных хронической ТЭЛА выражается в значительной доле пациентов с нарушением неврологического статуса в ранний послеоперационный период.
Антеградная перфузия ГМ способствует увеличению «безопасного» времени работы без использования глубокого охлаждения, так как обеспечивает: 1) доставку метаболитов к ГМ в период остановки кровообращения; 2) удаление кислых метаболитов, образующихся при анаэробном метаболизме и, следовательно, поддержание нормального рН мозга; 3) удаление активирующих нейротрансмиттеров, которые принимают участие в патогенезе ишемического повреждения ГМ [30, 31]. В нашем исследовании применение АПГМ во время ТЭЭ у больных хронической ТЭЛА сопровождается снижением rSO2 не более 20% от исходных значений и снижает риск возникновения неврологических осложнений в ранний послеоперационный период.
Заключение
Таким образом, антеградная перфузия головного мозга у больных хронической тромбоэмболией легочной артерии является наиболее физиологичным и эффективным методом защиты головного мозга во время операции, позволяет отказаться от глубокой гипотермии, а также полного прекращения церебрального кровотока. Все это способствует наименьшему снижению кислородного обеспечения головного мозга во время тромбэндартерэктомии и значительно снижает риск развития ишемии и неврологических осложнений со стороны центральной нервной системы в ранний послеоперационный период.



