Низкая обеспеченность клеток организма магнием неизбежно приводит к дефициту магния в митохондриях — своего рода «энергостанциях» клетки. Миокардиоциты, миоциты, нейроны и глия, клетки плаценты характеризуются максимальным содержанием митохондрий на клетку. Дефицит магния негативно сказывается на функционировании митохондрий, в частности, приводит к существенному снижению энергетического метаболизма миокарда.
Данные фундаментальных исследований позволяют предположить, что воздействие магния на митохондрии осуществляется путем влияния на энергетический метаболизм митохондрий [1, 2], синтез белка [3], активность определенных митохондриальных белков [4], электролитный баланс митохондрий [5], открытие митохондриальной поры [6] и апоптоз [7]. Проводимый в настоящей работе системно-биологический анализ митохондриальных белков полностью подтверждает эти механизмы воздействия магния на митохондрии, и, более того, указывает на такие экспериментально мало исследованные механизмы, как воздействие магния на «ремонт», т.е. восстановление, ДНК (в том числе фолатзависимый), метаболизм ряда микронутриентов в митохондриях и противовирусный иммунитет. Полученная информация о молекулярных механизмах воздействия магния существенно углубляет понимание фундаментальной фармакодинамики воздействия магния на митохондрии.
Материалы и методы
 Системно-биологический анализ магнийзависимых белков проводили с использованием метода анализа функциональных взаимосвязей [8] — одной из информационных технологий современной биоинформатики. Метод анализа функциональных взаимосвязей, соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о функциях магнийсодержащих белков, симптоматике и критериям диагностики заболеваний и т.д.), позволяет систематически рассмотреть все возможные области применения препаратов магния. В целом для каждого белка протеома человека составляется последовательная цепь описаний: 1) аминокислотная последовательность белка; 2) список биохимически необходимых эссенциальных кофакторов белка (в том числе с указанием потребности ионов магния для активности рассматриваемого белка); 3) список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка; 4) список клеточных функций белка (по базе данных Gene Ontology, GO и др.); 5) список отдельных симптомов заболеваний, список диагнозов по МКБ-10, а также другая информация из баз данных. Затем в полученной таблице выделяют магнийзависимые белки митохондрий и проводят их последующий анализ.
Системно-биологический анализ магнийзависимых белков проводили с использованием метода анализа функциональных взаимосвязей [8] — одной из информационных технологий современной биоинформатики. Метод анализа функциональных взаимосвязей, соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о функциях магнийсодержащих белков, симптоматике и критериям диагностики заболеваний и т.д.), позволяет систематически рассмотреть все возможные области применения препаратов магния. В целом для каждого белка протеома человека составляется последовательная цепь описаний: 1) аминокислотная последовательность белка; 2) список биохимически необходимых эссенциальных кофакторов белка (в том числе с указанием потребности ионов магния для активности рассматриваемого белка); 3) список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка; 4) список клеточных функций белка (по базе данных Gene Ontology, GO и др.); 5) список отдельных симптомов заболеваний, список диагнозов по МКБ-10, а также другая информация из баз данных. Затем в полученной таблице выделяют магнийзависимые белки митохондрий и проводят их последующий анализ.
Результаты
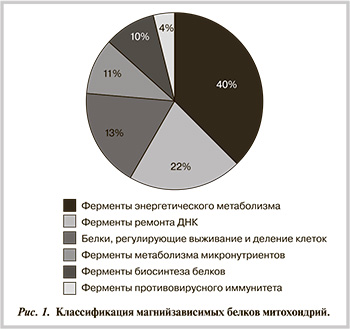
В результате анализа выделено 70 магнийзависимых белков, большинство из которых — ферменты. Все рассматриваемые белки локализованы внутри митохондрий (на наружной мембране митохондрий, в митохондриальном матриксе и др.). Для каждого из этих белков ион магния является кофактором, существенно влияющим на биологическую активность этого белка/фермента. Магнийзависимые белки митохондрий подразделяются на следующие группы:
- ферменты энергетического метаболизма;
- ферменты «ремонта« ДНК (в том числе фолатзависимого);
- белки, регулирующие выживание клеток и митохондрий;
- ферменты, участвующие в метаболизме микронутриентов в митохондриях;
- ферменты биосинтеза митохондриальных белков;
- ферменты противовирусного иммунитета (рис. 1).
Магнийзависимые митохондриальные ферменты энергетического метаболизма. Активность магнийзависимых ферментов метаболизма жирных кислот (ЖК), цикла трикарбоновых кислот (Кребса) и таких ферментов, как креатинкиназа, гексокиназа и др. (табл. 1), принципиально важна для энергетического метаболизма митохондрий. Ферменты энергетического метаболизма составляют 1/3 всех известных магнийзависимых белков митохондрий и подразделяются на ферменты метаболизма ЖК, цикла трикарбоновых кислот и ферменты, осуществляющие другие реакции (в частности, биосинтез кардиолипина).
Метаболизм ЖК. В условиях атерогенной диеты недостаток в пище магния способствует прогрессированию атеросклеротического поражения сердечно-сосудистой системы. И наоборот, дотации магния, калия, кальция приводят к регрессу гиперхолестеринемии; снижается уровень три-глицеридов [9—11]. Ионы Mg2+ необходимы, в частности, для активации участвующих в метаболизме ЖК ферментов митохондрий: кофермент А (КоА)-лигаз длинноцепочечных ЖК (гены ACSL1, ACSL3, ACSL4, ACSL5, ACSL6) и ацил-коА-синтазы (гены ACSM1, ACSM2A, ACSM2B, ACSM3 и ACSM5). Данные ферменты осуществляют липогенез в печени и необходимы для включения ЖК в фосфатидилхолин — основной фосфолипид клетки.
Ацил-КоА-лигазы длинноцепочечных ЖК активируют цепи ЖК для деградации через путь β-окисления. КоА-лигазы различаются в специфичности к субстрату: например, ACSL1 использует преимущественно пальмитолеат, олеат и линолеат; ACSL3 — преимущественно миристат, лаурат, арахидонат и эйкозапентаеноат, в то время как ACSL5 имеет очень широкий диапазон субстратов, включающий почти все биологически важные насыщенные ЖК.
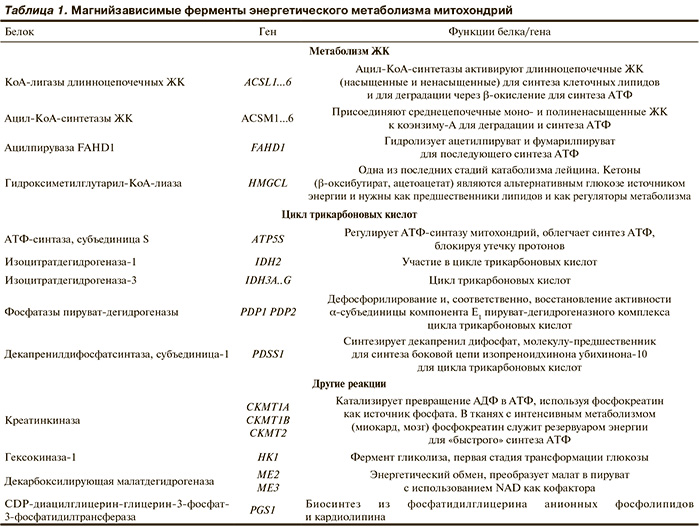
Ацил-КоА-синтазы (ACSM; см. рис. 1) прикрепляют цепочки средних и коротких ЖК к коферменту А и также характеризуются различиями по специфичности к субстрату, воздействуя преимущественно на моно- и полиненасыщенные ЖК. Активные сайты ацил-КоА-лигаз и ацил-КоА синтаз образованы с участием иона Mg2+ (рис. 2, см. цветную вклейку).
Цикл трикарбоновых кислот (Кребса). Воздействие магния на энергетический метаболизм митохондрий связано с влиянием на интенсивность протекания цикла трикарбоновых кислот — центрального пути синтеза аденозин-трифосфата (АТФ). В каждом «обороте» цикла синтезируется до 38 молекул АТФ (при идеальной обеспеченности кислородом и всеми микронутриентными кофакторами ферментов цикла). Все реакции цикла трикарбоновых кислот в эукариотических клетках протекают внутри митохондрий, причем катализирующие их ферменты (кроме сукцинатдегидрогеназы) находятся в матриксе митохондрий.
Ферменты, осуществляющие химические реакции цикла трикарбоновых кислот, нуждаются в определенных микронутриентных кофакторах — витаминах группы В (В1, В2, РР, В5, биотине, липоевой килоте), коферменте Q, железе, меди и магнии. Магний является важным кофактором двух ферментов цикла трикарбоновых кислот: изоцитратдегидрогеназы и фосфатазы пируватдегидрогеназы — регуляторной субъединицы сложной молекулярной машины цикла — пируватдегидрогеназного комплекса. При дефиците магния активность обоих ферментов будет существенно снижена, что отрицательно скажется на синтезе АТФ в митохондриях.
Помимо цикла трикарбоновых кислот магний может оказывать воздействие на энергетический метаболизм за счет участия в формировании активного центра креатинкиназы. Как известно, в клинической практике достаточно часто используется тест на креатинкиназу. Нормальные значения должны быть в диапазоне 25—200 МЕ/л, а повышенные уровни свидетельствуют о распаде клеток кардиомиоцитов в зоне инфаркта.
Креатинкиназа (ген СKM) катализирует превращение аденозиндифосфата в аденозинтрифосфат, используя фосфокреатин как источник фосфата, и образуют креатин как продукт реакции. В тканях с интенсивным метаболизмом (таких как миокард, мозг, мышечная ткань) фосфокреатин служит резервуаром энергии для быстрого синтеза АТФ при метаболической потребности. Таким образом, креатинкиназа необходима для оперативного поддержания энергетического метаболизма сердечной мышцы. Магний необходим для функции креатинкиназы (рис. 3, см. цветную вклейку), а недостаток магния будет способствовать снижению энергетических ресурсов миокарда.

В эксперименте кардиопротективный эффект органической формы магния (аспартат магния, дозы 20 или 40 мг/кг) подтвержден при ишемии, вызываемой липополисахаридом (ЛПС). Внутрибрюшинная инъекция ЛПС (2 мг/кг) сопровождалась пероральным приемом магния в течение 7 дней. Магний дозозависимо компенсировал повышение уровней креатинкиназы, снижал интенсивность окислительного стресса, способствовал сохранению внутриклеточного депо креатинфосфата, адениновых нуклеотидов и активности Na/К-АТФазы [12]. В соответствии с данными электронной микроскопии более высокая доза магния (40 мг/кг) более эффективно защищала митохондрии от повреждений структуры, вызвала значительное снижение активности креатинкиназы и повышение концентрации глутатиона в плазме по сравнению моделью ишемии.
Среди ферментов митохондрий, воздействующих на синтез АТФ, следует отметить магнийзависимый фермент CDP-диацилглицерин — глицерин-3-фосфат-3-фосфатидилтрансферазу, который осуществляет биосинтез кардиолипина. Кардиолипин — фосфолипид, который составляет 20% липидов внутренней мембраны митохондрий [13]. Кардиолипин, первоначально обнаруженный в кардиомиоцитах, необходим для функционирования многочисленных ферментов, участвующих в энергетическом обмене любой клетки [14]. Кроме того, кардиолипин участвует в метаболизме холина и импорте белков в матрикс митохондрий [15].
В частности, фермент цитохромоксидаза (комплекс IV дыхательной цепи) — последний из ферментов в цепи переноса электронов, большой белковый комплекс, расположенный в мембране митохондрий. Комплекс IV катализирует перенос 4 электронов с 4 молекул цитохрома C на O2, в результате чего образуется 2 молекулы воды.
Для поддержания ферментативной активности комплекса IV необходимы 2 связанные с ним молекулы кардиолипина. Кардиолипин также необходим для поддержания четвертичной структуры и функциональной активности комплекса III [16]. Митохондриальный фермент глицерин-3-фосфат-3-фосфатидилтрансфераза отвечает за биосинтез кардиолипина и содержит ион магния в активном центре (рис. 4, см. цветную вклейку).
Магнийзависимые ферменты «ремонта» митохондриальной ДНК. О синергизме с фолатами. Как известно, митохондрии имеют свой геном (митохондриальную ДНК, мито-ДНК) и, соответственно, свой собственный набор молекулярных машин для считывания информации. В геноме митохондрий человека всего несколько десятков генов, кодирующих рибосомальную и транспортную РНК, и белки, принципиально необходимые для поддержания основной функции митохондрий — синтеза АТФ: NADH-дегидрогеназа, цитохромоксидаза, АТФ-синтаза (рис. 5, см. цветную вклейку).
Поскольку в митохондрии активнейшим образом происходят процессы окисления различных субстратов, защита и «ремонт» мито-ДНК от окисления чрезвычайно важны для функционирования митохондрий. Под «ремонтом» ДНК подразумевают совокупность внутриклеточных процессов, направленных на выявление и исправление повреждений ДНК. Внутриклеточный уровень и активность белков защиты и «ремонта» ДНК зависят от состояния мито-ДНК. Накопление определенного лимита необратимых повреждений ДНК приводит, как правило, к апоптозу кардиомиоцита.
Описываемые ниже белки «ремонта» мито-ДНК активируются при умеренном количестве повреждений ДНК, которое приводит к ингибированию деления клеток и к активации генов, кодирующих белки «ремонта» митохондриальной ДНК. Мы разделили магнийзависимые белки «ремонта» ДНК на 4 группы: 1) «точечный ремонт» ДНК; 2) контроль репликации (копирования) ДНК; 3) ферменты, контролирующие свертывание—развертывание ДНК; 4) ферменты фолатзависимого «ремонта» ДНК (табл. 2).
«Точечный ремонт» ДНК. Под воздействием тепловых и химических факторов отдельные нуклеотиды, из которых синтезируется мито-ДНК, могут претерпевать нежелательные изменения (окисление, гидратацию) как в структуре мито-ДНК, так и во время синтеза ДНК. Это приводит к «точечному» повреждению ДНК и, соответственно, к активации механизмов «точечного ремонта» ДНК.
В частности, магнийзависимые ферменты 7,8-дигидрооксогуанин трифосфатазы предотвращают ошибочное включение окисленных форм пуриновых нуклеозидтрифосфатов в ДНК, тем самым проявляя антимутагенный эффект и предотвращая смерть кардиомиоцитов, вызываемую окислительными повреждениями митохондриальной ДНК.
В процессе деления клеток и митохондрий осуществляется синтез ДНК дочерней клетки, который заключается в копировании или репликации ДНК. Нарушение процесса репликации приводит к крупным повреждениям ДНК, несовместимым с выживанием митохондрий. В ходе анализа установлено существование, по крайней мере, 4 магнийзависимых белков, необходимых для репликации мито-ДНК. Центральным белком репликации мито-ДНК является ДНК-полимераза-гамма (ген POLG) — фермент, который, собственно, и осуществляет репликацию митохондриальной ДНК. Дефекты гена POLG ассоциированы прогрессирующей внешней офтальмоплегией [MIM: 157640], для которой характерны аномальная утомляемость, постоянная мышечная слабость, а на биопсиях мышечной ткани отмечаются рваные красные волокна и атрофия. Отметим, что глубокий дефицит магния в клетках характеризуется эффектами, отчасти схожими с описанными эффектами повреждения гена ДНК-полимеразы-гамма.
Свертывание—развертывание ДНК. Молекула мито-ДНК плотно упакована и для прохождения транскрипции должна развертываться, чтобы с нее могла считываться информация (т.е. осуществляться синтез РНК и затем белка). Такие Mg-зависимые ферменты, как геликазы и ДНК-топоизомеразы, осуществляют свертывание—развертывание ДНК и предотвращают перекручивание ДНК при транскрипции генов во время считывания мито-ДНК.
Магнийсвязывающий фермент серин/треонин-протеинкиназа STK11 регулирует метаболизм и апоптоз клеток в ответ на повреждение ДНК за счет фосфорилирования белков AMPK, регулирующих сигнальные пути роста и деления клеток при низком уровне энергетического метаболизма клетки; поддерживает гомеостаз глюкозы в печени и дифференцировку В-клеток.
Ферменты фолатзависимого «ремонта» ДНК включают апуриновые-апиримидиновые эндонуклеазы (регулируют ответ клетки на окислительный стресс, деметилируя ДНК, участвуют в фолатзависимой эпигенетической регуляции экспрессии генов), митохондриальную енолазу (регулирует активность фолатзависимой тимидилатсинтазы, конвертирующей уридин в тимидин в синтезе нуклеотидов для ДНК) и метилентетрагидрофолат дегидрогеназу/циклогидролазу.

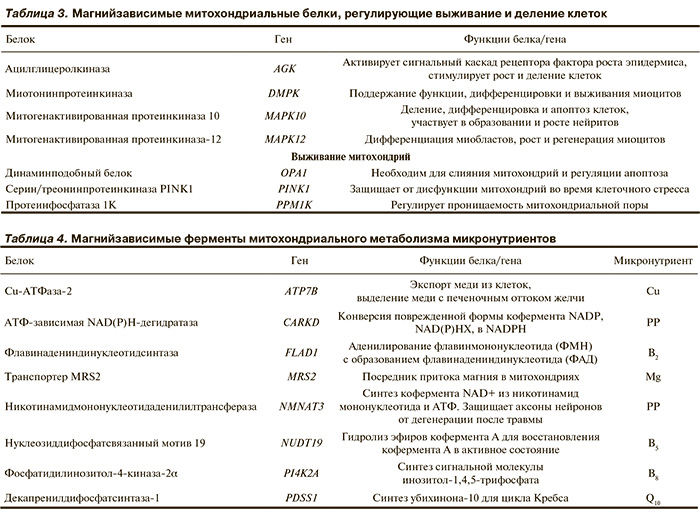
Магнийзависимые митохондриальные белки, регулирующие выживание и деление кардиомиоцитов. Помимо поддержания энергетического метаболизма и структуры ДНК (что естественным образом необходимо для выживания митохондрий и клеток) существуют митохондриальные магнийзависимые белки, контролирующие процессы апоптоза (программируемого отмирания) и выживания клеток и митохондрий (табл. 3). Следует подчеркнуть, что почти для каждого из белков, перечисленных в табл. 3, установлены ассоциации с генетическими дефектами, приводящими к тяжелым аномалиям развития мышечной ткани, в том числе кардиомиопатии.
Ацилглицеролкиназа фосфорилирует как моноацил-, так и диацилглицерол с образованием лизофосфатидной кислоты и фосфатидной кислоты соответственно. Увеличенный синтез и секреция лизофосфатидной кислоты активируют сигнальный каскад рецептора фактора роста эпидермиса (EGFR), что стимулирует рост и деление клеток. Дефекты гена приводят к синдрому истощения митохондриальной ДНК 10 [МИМ: 212350], для которого характерны гипертрофическая кардиомиопатия, скелетная миопатия, непереносимость физических нагрузок, молочнокислый ацидоз, врожденная катаракта и высокий уровень смертности вследствие кардиомиопатии.
Миотонинпротеинкиназа необходима для поддержания функции дифференцировки и выживания миоцитов. Фермент поддерживает целостность ядерной оболочки, играет важную роль в модуляции сократительной способности миокарда. Поддерживает надлежащий уровень проводимости сердца за счет регуляции гомеостаза кальция: фосфорилирует регулятор насосов кальция PLN и поглощение кальция саркоплазматической сетью миоцитов. Играет роль в синаптической пластичности. Дефекты гена DMPK связаны с миотоничной дистрофией 1-го типа [МИМ: 160900]: миотония, атрофия мышц в дистальных отделах конечностей, аритмия, а также катаракта, гипогонадизм, эндокринные нарушения и раннее облысение (у мужчин).
Митогенактивированная протеинкиназа-12 (ген MAPK12) поддерживает дифференциацию миобластов, рост и регенерацию миоцитов, адаптацию клеток к изменениям осмолярности.
Магнийзависимые динаминподобный белок, серин/треонинпротеинкиназа PINK1 и протеинфосфатаза-1K непосредственно регулируют выживание митохондрий. Динаминподобный белок (ген OPA1) образует диффузионный барьер для белков, хранящихся в митохондриальных кристах, и необходим для слияния митохондрий и регуляции апоптоза. В ответ на апоптотический сигнал динаминподобный белок стимулирует секрецию цитохрома С в межмембранное пространство митохондрий, что является сигналом для активации проапоптотических ферментов — каспаз.
Магнийзависимый фермент протеинфосфатаза-1K (ген PPM1K) регулирует проницаемость митохондриальной поры, что имеет большое значение для выживания и развития и митохондрий, и клеток. Митохондриальная пора — белковый комплекс в мембране митохондрий, который формируется при ишемии кардиомиоцитов. Избыточное открытие митохондриальной поры приводит к набуханию и гибели митохондрий. Открытие митохондриальной поры является, в частности, одним из ключевых факторов гибели не только кардиомиоцитов, но и нейронов в зоне ишемического очага [17].
Магнийзависимые митохондриальные ферменты метаболизма микронутриентов. Проведенный анализ показал, что несколько магнийзависимых белков митохондрий являются неотъемлемой частью обмена таких микронутриентов, как магний, медь, витамины B2, PP, B5, В8 (миоинозитол), коэнзим Q10 (табл. 4). Важно отметить, что все эти микронутриенты (за исключением миоинозитола) принципиально необходимы для поддержания энергетического метаболизма и, прежде всего, реакций цикла трикарбоновых кислот. Миоинозитол участвует не в самих реакциях синтеза АТФ, а в регуляции энергетического метаболизма клеток за счет передачи сигнала от гормональных рецепторов.
Например, магнийзависимый фермент декапренилдифосфатсинтаза (ген PDSS1) синтезирует декапренилдифосфат — молекулу-предшественник для синтеза боковой цепи изопреноидхинона убихинона-10 (коэнзима Q10) для цикла трикарбоновых кислот. Генетические дефекты в PDSS1 связаны с врожденным дефицитом коэнзима Q10 [МИМ: 614651], для которого характерны не только глухота, атрофия зрительного нерва и периферическая нейропатия, но и тяжелые пороки клапанов сердца.
Магнийзависимые митохондриальные белки, необходимые для синтеза и транспорта внутримитохондриальных белков. Магний необходим для синтеза белка, по крайней мере, вследствие 3 причин фундаментального характера. Во-первых, магний стабилизирует структуру самой молекулярной машины для синтеза белка — рибосомы: почти 100 ионов Mg2+ принимают участие в стабилизации каждой из двух субъединиц только одной рибосомы. Во-вторых, магний находится в комплексе с АТФ, который служит источником энергии для синтеза белка. В-третьих, магний является кофактором группы белков, участвующих как в самом процессе трансляции (т.е. синтезе белков на рибосоме), так и в сборке и разборка белковых структур после трансляции в митохондрии (табл. 5).
Участие магнийзависимых белков в синтезе белка в митохондрии весьма разнообразно. Например, митохондриальная рибосомасвязанная ГТФаза-2 регулирует сборку самой митохондриальной рибосомы, а CCA-тРНК-нуклеотидилтрансфераза-1 добавляет последовательность нуклеотидов CCA (т.е. цитозин-цитозин-аденин) к тРНК (данная последовательность необходима для прикрепления аминокислот к тРНК). Фенилаланин-тРНК-лигаза присоединяет аминокислоту фенилаланин к Phe-транспортной РНК в ходе синтеза белка. Дефект гена фенилаланин-тРНК-лигазы приводит к дефициту окислительного фосфорилирования митохондрий 14 [МИМ: 614946]: судороги, молочнокислый ацидоз, выраженные дефициты активности митохондриальных дыхательных ферментов.
Несколько магнийзависимых белков митохондрий необходимы для сборки и разборки белковых структур после трансляции. Эти процессы также имеют большое значение для осуществления основной функции митохондрий — синтеза АТФ. Например, белок внутренней мембраны митохондрий (ген OXA1L) необходим для вставки интегральных мембранных белков во внутреннюю мембрану митохондрии, участвует в сборке и активности цитохромоксидазы и АТФсинтазы митохондрий. LYR-мотивсодержащий белок (ген LYRM4) необходим для синтеза ядерных и митохондриальных белков, содержащих железосерные кластеры в активных центрах. Заметим, что такой кластер является коферментом одного из белков цикла трикарбоновых кислот — аконитазы.
Магнийзависимые митохондриальные ферменты противовирусного иммунитета. Четко доказано, что смертность от сердечно-сосудистых заболеваний ассоциирована со снижением противовирусного иммунитета. Эндотелиальное воспаление стимулирует адсорбцию вирусных частиц на поверхности клеток сосудов и кардиомиоцитов. В ходе настоящего анализа установлено, что несколько магнийзависимых белков митохондрий принципиально важны для осуществления механизмов врожденного иммунитета.
Олигоаденилатсинтазы (гены OAS1, OAS2) — интерферониндуцируемые противовирусные ферменты, которые играют важную роль во врожденной противовирусной реакции. Ферменты синтезируют 2′-5′-олигоаденилаты (2—5A) из АТФ, активируют другой магнийзависимый белок — рибонуклеазу L (ген RNASEL), которая осуществляет эффекты интерферона при противовирусном ответе. Активация РНКазы L вызывает деградацию вирусной РНК, что приводит к ингибированию синтеза вирусных белков и, таким образом, прекращает репликацию вируса. Фермент фосфодиэстераза-12 (ген PDE12) является регулятором олигоаденилатной системы противовирусной защиты. Таким образом, обеспеченность магнием — одно из важнейших условий поддержки неспецифической противовирусной защиты.
О компенсации дефицита магния с целью профилактики митохондриальной недостаточности. Для устранения дефицита магния в митохондриях необходимо, чтобы магний постоянно поступал внутрь клеток, а не рассеивался в желудочно-кишечном тракте. Органические соли магния имеют лучшие фармакокинетические параметры по сравнению с неорганическими солями при приеме внутрь. Оротат магния стимулирует всасывание магния внутрь кардиомиоцитов. Кроме того, «носитель» магния (оротат-анион) не только тропен к кардиомиоцитам, но и вносит самостоятельный вклад в энергообеспечение кардиомиоцитов.
Оротат также оказывает антиаритмическое, сосудорасширяющее и кардиопротективное воздействие, благоприятно влияет на клиническое течение инфаркта миокарда и проявления сердечной недостаточности [18]. Оротовая кислота участвует в метаболизме триглицеридов, фосфолипидов, β-окислении, синтезе нуклеотидов [19]. По данным систематического анализа метаболических эффектов оротата, воздействие оротата на уровни уридинмонофосфата является основным метаболическим эффектом оротата [20]. Уридинмонофосфат оказывает выраженное кардиопротективное воздействие, особенно в период острой ишемии. Прием оротовой кислоты увеличивает концентрацию уридинфосфатов плазмы и приводит к уменьшению глобальной ишемии при инфаркте [21]. Проверяются гипотезы о том, что кардиопротективный эффект уридинфосфатов связан с митохондриальными АТФзависимыми каналами [20] и с активацией пуринергических рецепторов.
Заключение
Проведенный анализ позволил установить точные молекулярные механизмы, посредством которых магний воздействует на энергетический метаболизм (в том числе цикл трикарбоновых кислот, метаболизм жирных кислот и кардиолипина), фолатзависимый «ремонт» повреждений ДНК, выживание и деление клеток, метаболизм ряда микронутриентов (витамины B2, PP, B5, микроэлементы Mg, Cu, миоинозитол, холин), синтез белков и противовирусный иммунитет. Результаты анализа имеют принципиальное значение для понимания фармакодинамических эффектов воздействия магния на функцию митохондрий.



