Острый коронарный синдром (ОКС) — серьезная медицинская и социально-экономическая проблема, которая остается одной из ведущих причин смертности и инвалидности в развитых странах [1]. Основной причиной развития ОКС является тромбоз коронарной артерии (КА). Принято считать, что ведущая роль в патогенезе тромбоза принадлежит нарушению стабильности атеросклеротической бляшки (АСБ) [2, 3]. Дестабилизация АСБ во многом обусловлена ее структурой. АСБ с большим липидным ядром, тонкой фиброзной оболочкой и скоплением макрофагов более склонны к разрыву и изъязвлению, чем бляшки, в которых преобладают фиброзный компонент и депозиты кальция [4, 5]. С помощью мультиспиральной томографии (МСКТ) можно выявлять косвенные признаки, указывающие на нестабильность АСБ: большой объем, пониженная рентгеновская плотность, включение микрокальцинатов, наличие тромботического компонента, а также диссекция и положительное ремоделирование КА на уровне бляшки [6—9]. Мультиспиральные компьютерные томографы последнего поколения с 64 рядами детекторов и более позволяют визуализировать просвет магистральных КА на всем протяжении, различать кальцинированные и «мягкие» бляшки, оценивать их протяженность и контур. Возможность оценки состава АСБ и выявление с помощью МСКТ критериев, ассоциированных с ее нестабильностью, может помочь в диагностике ОКС на ранних этапах, а также в стратификации риска развития ОКС.
Цель исследования: определить возможности МСКТ в оценке морфологических свойств АСБ в КА у больных ишемической болезнью сердца (ИБС), выявить особенности АСБ в КА у больных ОКС.
Материал и методы
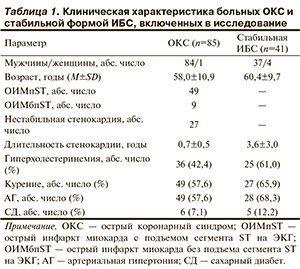
Оценка внутреннего рельефа КА и состава АСБ проведена у 85 больных ОКС и у 41 больного стабильной формой ИБС. Диагноз острого инфаркта миокарда (ОИМ) устанавливали на основании стандартных критериев [1]. В группу со стабильной ИБС включили больных стенокардией напряжения I—III функционального класса (ФК) либо с безболевой ишемией миокарда, по данным инструментальных методов обследования — нагрузочных тестов, холтеровского мониторирования электрокардиограммы (ЭКГ). Клиническая характеристика больных представлена в табл. 1.
 МСКТ проводили всем пациентам с ОКС на 1—5-е сутки, пациентам со стабильной ИБС на 3—7-е сутки после поступления в стационар до проведения инвазивных вмешательств на КА.
МСКТ проводили всем пациентам с ОКС на 1—5-е сутки, пациентам со стабильной ИБС на 3—7-е сутки после поступления в стационар до проведения инвазивных вмешательств на КА.
МСКТ выполняли на мультиспиральном компьютерном томографе. Перед исследованием проводили опрос пациентов и знакомство с медицинской документацией для уточнения возможных противопоказаний к введению рентгеноконтрастных веществ (аллергия на йодсодержащие препараты, сниженная скорость клубочковой фильтрации). Для предотвращения артефактов на изображениях сердца пациенты с частотой сердечных сокращений более 70 уд/мин перед процедурой принимали короткодействующие β-адреноблокаторы. До исследования в локтевую вену устанавливали пластиковый катетер калибром 18—20 G и накладывались электроды для постоянной регистрации ЭКГ. Исследование проводили в положении пациента лежа на спине при движении стола в краниокаудальном направлении. Всем пациентам выполняли топограмму (м. б. томограмму?) для разметки зоны исследования: больным ОИМ — от уровня корня аорты (выше отхождения КА) до верхушки сердца; больным с подозрением на ОКС — от уровня дуги аорты до диафрагмы.
Протокол проведения МСКТ сердца включал две фазы исследования при однократном введении контрастного препарата в артериальную фазу:
- 1-я фаза (нативная) выполнялась до введения контрастного препарата;
- 2-я фаза (артериальная) — на фоне внутривенного введения неионного контрастного препарата.
Все фазы исследования проводили при задержке дыхания.
Первая (нативная) фаза выполнялась в пошаговом режиме томографии с толщиной среза 3 мм, ток и напряжение на рентгеновской трубке составляли соответственно 100 мА и 120 кВ, время выполнения одного среза (время полуоборота трубки) — 250 мс. Использовали проспективную синхронизацию с ЭКГ, при которой каждый срез выполнялся в определенную фазу сердечного цикла (40% от интервала RR). Средняя эффективная доза облучения составила 0,9—1,1 мЗв.
Вторая (артериальная) фаза выполнялась в спиральном режиме томографии, который обеспечивает одновременное получение 64 срезов толщиной 0,5 мм за 400 мс (время полного оборота трубки) при непрерывном движении стола с пациентом. Ток и напряжение на трубке составляли соответственно 400 мА и 120 кВ. Контрастный препарат (оптирей-350 или омнипак-350) в дозе 100—150 мл (1,5 мл на 1 кг массы тела) вводился внутривенно со скоростью 5 мл/с автоматическим шприцем. Артериальная фаза исследования начиналась автоматически при достижении пикового значения рентгеновской плотности в просвете нисходящей аорты, соответствующего 80—120 HU. Средняя эффективная доза облучения составила 15—20 мЗв.
Реконструкции и анализ изображений МСКТ для оценки АСБ в КА. У всех больных проводили оценку степени атеросклеротического поражения во всех КА. В группе больных ОКС симптом-связанной (ССА) считали артерию, кровоснабжающую зону инфаркта или ишемии миокарда, выявляемую с помощью ЭКГ, эхокардиографии, нагрузочных тестов. В случае выявления в ССА нескольких АСБ ответственной за развитие ОКС считалась та бляшка, которая вызывала наибольшее сужение просвета.
Для оценки АСБ выполняли 3D- и MPR-реконструкции изображений КА, затем в их просвете курсором отмечали зону интереса, на уровне которой автоматически получали изображения поперечного сечения артерии толщиной 0,5 мм, что позволяло визуализировать состав и контур бляшки на всем ее протяжении. Анализировали бляшки в проксимальных и средних сегментах КА диаметром не менее 2 мм. Визуальная оценка включала определение типа и контура бляшки. Мы выделяли 2 типа бляшек: 1-й тип — кальцинированные, содержащие преимущественно массивные включения кальцинатов; 2-й тип — некальцинированные, к которым относятся: а) «мягкие» и б) гетерогенные бляшки, содержащие мелкие (точечные) включения кальцинатов (рис. 1, см. цветную вклейку). Кроме того, оценивали контур бляшки — ровный, неровный, в том числе с тромботическим компонентом, вызывающим субтотальный стеноз или окклюзию просвета сосуда (рис. 2, см. цветную вклейку).
 Количественная оценка включала определение плотности АСБ и индекса ремоделирования. Плотность бляшки в единицах HU определялась автоматически после обведения ее контура на изображении поперечного сечения артерии, как это показано на рис. 3, см. цветную вклейку.
Количественная оценка включала определение плотности АСБ и индекса ремоделирования. Плотность бляшки в единицах HU определялась автоматически после обведения ее контура на изображении поперечного сечения артерии, как это показано на рис. 3, см. цветную вклейку.
Коронарное ремоделирование определяли как изменение диаметра артерии по наружному контуру в месте локализации АСБ по сравнению с диаметром проксимального интактного сегмента (референтный сегмент). Индекс ремоделирования рассчитывается по формуле: ИР=Д1/Д2, где ИР — индекс ремоделирования, Д1 — диаметр КА на уровне АСБ, Д2 — диаметр референтного сегмента.
Положительным ремоделированием принято считать увеличение диаметра КА на уровне АСБ не менее чем на 10% от диаметра референтного сегмента [7].
Для оценки индекса ремоделирования выполняли реконструкцию КА по продольной оси на всем ее протяжении (MPR), затем исследователь выделял уровни, через которые пройдут поперечные сечения артерии: на уровне АСБ и в референтном сегменте с автоматическим определением их диаметров (рис. 4, см. цветную вклейку).
В нашем исследовании в 6 случаях оценка ремоделирования не могла считаться достоверной из-за артефактов от выраженного кальциноза, что затрудняло определение истинного диаметра артерии на уровне АСБ.
Результаты
В группе больных ОКС (n=85) выявлено 194 АСБ, из которых 60 «мягких», 72 гетерогенных и 62 кальцинированных. Средняя плотность «мягких», гетерогенных и кальцинированных АСБ составила соответственно 49±22 HU (от 14 до 82 HU); 91±22 HU (от 34 до 125 HU) и 391±156 HU (от 162 до 820 HU); p<0,02 при сравнении всех типов АСБ между собой.
В группе ОИМ с подъемом сегмента ST на ЭКГ (ОИМпST; n=49) в ССА чаще определись бляшки с тромботическим компонентом, чем в группе ОКС без подъема сегмента ST на ЭКГ (ОКСбпST; n=36; p=0,004), статистически значимых различий по составу АСБ между группами не выявлено (табл. 2). Внутри каждой из групп некальцинированные («мягкие» или гетерогенные) АСБ определялись чаще, чем кальцинированные, в группе ОИМпST различия достигли статистической значимости (p<0,001). При оценке контура бляшки внутри каждой из групп оказалось, что у больных ОИМпST чаще определялись бляшки с неровным, чем с ровным, контуром: 69,4 и 30,6% соответственно (p<0,01). У больных ОКСбпST количество АСБ с ровным и неровным контуром существенно не различалось: 57,8 и 47,2% соответственно.
Помимо тромботического компонента у 4,7% больных (у 2 ОИМпST и 2 нестабильной стенокардией) по данным МСКТ определялись признаки диссекции ССА. Из них у 2 больных нестабильной стенокардией определялись признаки изъязвления бляшки в ССА; у больных ОИМ в одном случае определялась протяженная диссекция инфаркт-связанной артерии (ИСА); во втором — АСБ с признаками надрыва. Во всех случаях признаки диссекции выявлены в «мягких» АСБ низкой плотности (17,8±3,6 HU) в артериях диаметром более 3 мм. В 3 случаях признаки диссекции ССА также были подтверждены при коронарографии – расшифровать На рис. 5—7 приведены примеры АСБ с признаками изъязвления (см. рис. 5, см. цветную вклейку), локальной (см. рис. 6, см. цветную вклейку) и протяженной (см. рис. 7, см. цветную вклейку) диссекции ИСА.
На следующем этапе мы провели сравнительную оценку бляшек в ССА и симптом-несвязанных артериях (СНА). У 53 больных из группы ОКС выявлено многососудистое поражение коронарного русла, у остальных 32 АСБ определялись только в ССА. Проанализировано 510 КА, в которых обнаружено 211 бляшек: 102 — в ССА (из которых 85 — ответственных за ОКС) и 109 — в СНА.
Количество «мягких», гетерогенных и кальцинированных бляшек в ССА и СНА не имело статистически значимых различий: 28 (32,9%), 36 (40%), 21 (27,1%) и 32 (29,4%), 36 (33%), 41 (37,6%) соответственно. При этом и в ССА и в СНА было больше некальцинированных («мягких» и гетерогенных) АСБ, чем кальцинированных: 72,9 и 27,1% в ССА, 62,4 и 37,6% в СНА соответственно (табл. 3). Различия между бляшками в ССА и СНА наблюдались при оценке индекса ремоделирования и контура бляшки: в ССА индекс ремоделирования был выше, а неровный контур определялся чаще, чем в СНА (см. табл. 3). Отметим, что неровный контур у некальцинированных АСБ определялся чаще, чем у кальцинированных: 39,40 и 20,97% соответственно (p=0,02).
В 4 из 85 ССА определялись АСБ, стенозирующие ≤50% просвета; все они имели ровные контуры без признаков тромбоза, из них одна — гетерогенная бляшка, одна — «мягкая» и две — кальцинированные. В остальных ССА (n=81) определялись бляшки, стенозирующие более 50% просвета.
Оценку структуры бляшек в ССА и СНА у одного и того же больного проводили в группе пациентов с многососудистым поражением КА (n=53). У 40 (76,9%) из 53 больных бляшки в СНА имели преимущественно ту же структуру, что и в ССА: из них у 23 больных в СНА и ССА определялись только однотипные бляшки, а у 17 больных в СНА, кроме схожих по составу бляшек имелись АСБ и других типов. У остальных 13 (23,1%) больных бляшки в СНА и ССА имели различную структуру: в ССА определялись только некальцинированные бляшки, в СНА — кальцинированные. Не было ни одного случая, когда в ССА определялись кальцинированные бляшки, а в других артериях — только некальцинированные.
Таким образом, у одного и того же больного в ССА и СНА схожие по структуре бляшки встречаются чаще, чем бляшки с различной структурой: 76,9 и 23,1% соответственно (p<0,0005).
Бляшки с тромботическим компонентом выявлены одновременно в ССА и СНА у 1 (1,9 %), только в ССА — у 7 (13,2 %), только в СНА — ни у одного больного.
Сравнение бляшек в КА у больных ОКС и стабильной ИБС. У 41 больного из группы стабильной ИБС проанализировано 125 бляшек, среди которых преобладали кальцинированные (66,4%), а гетерогенные и «мягкие» бляшки визуализировались значительно реже, соответственно в 24,8 и 8,8% случаев (p<0,001). Среднее число АСБ достоверно не различалось между группами ОКС и стабильной ИБС: 1,8±0,8 и 2,3±0,9 соответственно (p=0,09).
При сравнении распределения различных типов бляшек в группе ОКС в большинстве случаев определялись «мягкие» или гетерогенные бляшки, а в группе стабильной ИБС — кальцинированные бляшки (табл. 4). В группе ОКС бляшки с неровным контуром встречались значительно чаще, а индекс ремоделирования был выше, чем в группе стабильной ИБС (см. табл. 4). Бляшек с тромботическим компонентом в группе больных стабильной ИБС не обнаружено.
Обсуждение
 Атеросклеротическое поражение КА протекает часто бессимптомно до того момента, пока степень стеноза не достигает 70—80% [9]. Однако, по данным W.C. Little и соавт. [10], около 50% ИСА сужены менее чем на 50% [10]. На основании данных других исследователей, получивших аналогичные результаты, в настоящий момент считается, что более чем в 75% случаев стеноз симптом-связанного сосуда достигает легкой или умеренной степени [9]. Структура АСБ в большей степени, чем степень стеноза КА, предопределяет развитие острой коронарной патологии — инфаркта миокарда, нестабильной стенокардии, внезапной сердечной смерти. Часто патогенез этих исходов заключается в сочетании тромбоза КА и констрикции сосуда в месте надорванной АСБ. Стеноз КА как следствие этих процессов проявляется клинической симптоматикой ОКС [11].
Атеросклеротическое поражение КА протекает часто бессимптомно до того момента, пока степень стеноза не достигает 70—80% [9]. Однако, по данным W.C. Little и соавт. [10], около 50% ИСА сужены менее чем на 50% [10]. На основании данных других исследователей, получивших аналогичные результаты, в настоящий момент считается, что более чем в 75% случаев стеноз симптом-связанного сосуда достигает легкой или умеренной степени [9]. Структура АСБ в большей степени, чем степень стеноза КА, предопределяет развитие острой коронарной патологии — инфаркта миокарда, нестабильной стенокардии, внезапной сердечной смерти. Часто патогенез этих исходов заключается в сочетании тромбоза КА и констрикции сосуда в месте надорванной АСБ. Стеноз КА как следствие этих процессов проявляется клинической симптоматикой ОКС [11].
С появлением МСКТ с 64 рядами детекторов и более стала возможной неинвазивная оценка не только просвета КА, но и состояния ее стенки. Точная оценка структуры и контура АСБ возможна с помощью инвазивных методов диагностики, таких как внутрисосудистое ультразвуковое исследование (ВСУЗИ) с виртуальным гистологическим исследованием, оптическая когерентная томография [12]. В настоящее время МСКТ является единственной неинвазивной методикой оценки состояния внутреннего рельефа коронарного русла, которая широко применяется в клинической практике [13]. В то же время из-за недостаточного временнóго и пространственного разрешения современные томографы значительно уступают в информативности и точности оценки внутрисосудистым методам изучения АСБ. В зарубежных изданиях опубликованы немногочисленные работы по сравнительной оценке состава бляшки в КА у больных ИБС по данным МСКТ и ВСУЗИ [14, 15]. Наиболее интересные результаты, на наш взгляд, представлены в работе S. Achenbach и соавт. [15]. В данном исследовании МСКТ и ВСУЗИ были выполнены 22 больным, проанализировано 83 сегмента КА. Оценивались бляшки, сужающие не более 50% просвета артерий. Несмотря на небольшой объем бляшек, сравнительный анализ показал высокую информативность МСКТ. Чувствительность и специфичность МСКТ относительно ВСУЗИ для всех типов бляшек составили 82 и 88% соответственно для кальцинированных бляшек — 94 и 94%, для некальцинированных бляшек — 78 и 87%. При анализе лишь 41 проксимального сегмента специфичность и чувствительность составили 92 и 88% для всех типов бляшек. Следовательно, точность МСКТ меньше при визуализации бляшек в артериях малого диаметра (менее 2—3 мм).
В работе А. Leber и соавт. [14] показано, что по данным МСКТ средние значения показателей плотности для гипоэхогенных, гиперэхогенных и кальцинированных АСБ (по данным ВСУЗИ) имеют статистически значимые отличия. Различная плотность бляшек, по данным МСКТ, объясняется их составом и обусловлена преобладанием в бляшке фиброзно-липидного компонента, наличием некротического ядра или кальциноза.
Данные литературы [6—8, 16—21] демонстрируют, что различные морфологические свойства бляшек. по результатам МСКТ, такие как положительное ремоделирование, включения мелких кальцинатов и низкая рентгеновская плотность, могут указывать на наличие ОКС у пациентов с острой болью в грудной клетке и гемодинамически значимыми стенозами КА, по данным МСКТ.
При сравнении бляшек в группах больных ОКС и стабильной ИБС оказалось, что в КА больных ОКС преобладают «мягкие» и гетерогенные бляшки, а у больных стабильной ИБС — бляшки с высоким содержанием депозитов кальция [17, 22—25]. В работе G. Pundziute и соавт. [25] проведена сравнительная оценка АСБ у больных стабильной стенокардией и ОИМ, по данным ВСУЗИ (с функцией виртуального гистологического исследования) и МСКТ-64. Результаты анализа показали, что у больных стабильной стенокардией преобладали кальцинированные бляшки (61%), а у больных ОКС — преимущественно гетерогенные (59%) с незначительными включениями кальцинатов и тонкой фиброзной покрышкой.
Данные нашей работы согласуются с результатами приведенных выше исследований [17, 22—25]: в группе больных ОКС преобладали «мягкие» и гетерогенные бляшки, а в группе больных стабильной стенокардией чаще встречались кальцинированные бляшки. Кроме того, индекс ремоделирования КА в группе больных ОКС оказался значительно выше, чем в группе больных стабильной ИБС. По составу бляшки в ССА и СНА у больных ОКС существенно не различалась: преобладали «мягкие» и гетерогенные бляшки с незначительным кальцинозом.
Отличительной особенностью нашей работы была оценка контура бляшек. У больных ОКС в ССА значительно чаще определялись бляшки с неровным контуром, в том числе с тромботическим компонентом. Индекс ремоделирования у бляшек в ССА был выше, чем в СНА. В группе со стабильной ИБС бляшки с неровным контуром встречались лишь у 8 из 41 больного: в 9 (7,2%) из 125 бляшек; в группе больных ОКС — у 51 из 85 больных: в 65 (33,5%) из 194 бляшек. Кроме того, у 4 больных ОКС определялись признаки диссекции ССА. У нескольких больных ОКС, по данным МСКТ, определялись также признаки изъязвления (в 2 случаях), надрыва (в одном случае) нестабильных бляшек и диссекции интимы в местах их расположения. Еще у одного больного диагностирована изолированная диссекция ИСА. Указания на аналогичные изменения поверхности бляшек, выявляемые с помощью МСКТ, имеются в единичных работах [26].

В исследованиях по сравнительной оценке бляшек с помощью ВСУЗИ с виртуальной гистологшией показано, что у больных ОКС в СНА также могут существовать бляшки с признаками нестабильности, в том числе АСБ с тонкой капсулой [27—30]. Характерным для ОКС является повышение уровня маркеров воспаления в крови, что отражает воспалительный процесс, который может привести к дестабилизации АСБ [31—33]. Эти наблюдения послужили основанием для гипотезы о генерализованном процессе дестабилизации бляшек одновременно в нескольких КА, что может приводить к повторным коронарным эпизодам в течение 1 мес после развития ОКС [34—37]. В зарубежной литературе имеются противоречивые сведения о соотношении кальцинированных и некальцинированных бляшек в ССА и СНА, по данным МСКТ. Например, в работе G. Pundziute и соавт. [25] показано, что бляшки в ССА и СНА имели идентичную структуру с преобладанием мягкотканного компонента, а по данным U. Hoffmann и соавт. [17], некальцинированные бляшки в ССА определяются чаще, чем в СНА.
Результаты нашего исследования согласуются с данными G. Pundziute и соавт. [25]. Для обоснования предположения о том, что атеросклеротический процесс в КА протекает генерализованно, мы сравнили структуру бляшек в ССА и СНА у каждого больного ОКС с многососудистым поражением коронарного русла (n=53). Оказалось, что в ССА и СНА чаще определялись однотипные бляшки (у 75,5% больных), среди которых преобладали «мягкие» или гетерогенные. Различные по составу бляшки в ССА и СНА были выявлены у 13 (24,5%) больных; примечательно, у этих больных в ССА определялись только некальцинированные, а в СНА — только кальцинированные бляшки. Таким образом, в нашем исследовании в ССА и СНА у одного и того же больного в большинстве случаев определялись одинаковые по составу бляшки, что согласуется с гипотезой о генерализации атеросклеротического процесса в КА.
К основным преимуществам МСКТ относится возможность оценки не только степени стеноза КА, но и визуализации самой бляшки с оценкой ее состава, рельефа поверхности и объема, а также наружного контура сосуда, что в ряде случаев позволяет получить более полную информацию об АСБ, чем при КГ [38].
Обобщая данные приведенных выше исследований и результаты нашей работы, мы можем констатировать, что МСКТ позволяет выявлять различные типы и морфологические особенности АСБ, но не дает представления о толщине фиброзной покрышки и величине липидного ядра. К ограничениям метода относятся невозможность оценки АСБ в артериях диаметром менее 2 мм и выявления таких компонентов АСБ, как липидное ядро и покрышка. Кроме того, выраженный кальциноз затрудняет определение степени стеноза КА методом МСКТ.
Выводы
С помощью мультиспиральной компьютерной томографии возможно выявление «мягких», гетерогенных и кальцинированных бляшек на основании визуальных и количественных критериев.
К основным характеристикам атеросклеротической бляшки у больных острым коронарным синдромом, по данным мультиспиральной компьютерной томографии, относятся низкая плотность бляшки и включения микрокальцинатов.
Отличительной особенностью бляшек в симптом-связанных артериях является неровный контур, в том числе с тромботическим компонентом, и положительный индекс ремоделирования.



