ВВЕДЕНИЕ
Несмотря на реальные достижения в изучении патогенеза и лечения, ИБС остается главной медико-социальной проблемой развитых стран. По прогнозу экспертов ВОЗ, к 2020 г. ИБС выйдет на первое место среди всех причин инвалидизации и смертности в мире [1]. Категория пациентов, имеющих ИБС и поражение некоронарных бассейнов, особо сложна для курации. Больные с гемодинамически значимым «немым» поражением нескольких артериальных бассейнов − это одна из самых клинически и прогностически «отягощенных» групп пациентов, требующих особого подхода к лечению [2]. Согласно результатам обсервационных клинических исследований, встречаемость мультифокального атеросклероза (МФА) находится в пределах от 13,5 до 94%. Согласно данным ряда авторов, наличие периферического атеросклероза у больных с инфарктом миокарда (ИМ) ассоциировалось с неблагоприятным ранним и отдаленным прогнозом заболевания. В исследовании Л.Н. Слатовой и соавт. (2013) установлено, что у пациентов с ИМ и различными клиническими проявлениями МФА значительно ухудшался ранний прогноз заболевания [3].
При ИБС атеросклероз почечных артерий (ПА) диагностируется в большинстве случаев как находка при ангиографическом исследовании и варьирует от 11 до 43% [4].
По данным US Renal Data System, патологии артерий почек занимают пятую позицию среди причин развития почечной недостаточности [5]. Стеноз ПА может обусловить тяжелое нарушение системной гемодинамики с развитием застойной ХСН (при сохранной функции ЛЖ), внезапного и необъяснимого кардиальными причинами отека легких, а также развитием нестабильной стенокардии, обусловленной снижением перфузии миокарда и прямыми неблагоприятными воздействиями ангиотензина II на миокард [6]. 5-летняя выживаемость у пациентов с ИБС и 50% стенозом ПА составляет 65% по сравнению с выживаемостью без стенозов ПА, которая составляет 86%. Выживаемость больных коррелирует со степенью стеноза ПА и количеством пораженных сосудов. При двустороннем поражении ПА отмечается наибольшая скорость прогрессирования гипертрофии левого желудочка (ГЛЖ), хронической сердечной недостаточности (ХСН) и при декомпенсации — снижение сократительной способности левого желудочка (ЛЖ) [7].
Целью данного исследования явилось изучение влияния стеноза ПА в комплексе с другими факторами на риск развития фатальных и нефатальных сосудистых событий у пациентов с острым коронарным синдромом (ОКС).
МАТЕРИАЛ И МЕТОДЫ
В исследование включено 323 пациента с ОКС, находившихся на лечении в кардиологическом отделении регионального сосудистого центра ГБУ РО «РОКБ», из них 217 (67,1%) мужчин, 106 (32,9%) женщин. Средний возраст обследованных больных составил 59,6±9,2 лет.
Всем пациентам были проведены стандартные биохимические исследования, включающие оценку показателей липидного обмена: общий холестерин (ХС); ХС липопротеидов высокой и низкой плотности — ЛПВП и ЛПНП; индекс атерогенности – ИА; триглицериды (ТГ), уровни креатинина и мочевины. Функцию почек оценивали по уровню клиренса креатинина (КК), рассчитываемому по формуле Кокрофта—Голта, и скорости клубочковой фильтрации (СКФ), определяемой по формуле CKD-EPI (2009) [8]. Комплекс инструментальных исследований включал регистрацию ЭКГ в покое, суточное мониторирование ЭКГ по Холтеру, ультразвуковое исследование сердца, ультразвуковое исследование почек, коронароангиографию (КАГ) для оценки степени поражения коронарных сосудов, селективную ангиографию почечных сосудов.
Статистический анализ полученных результатов проводили с помощью набора прикладных статистических программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США).
С целью оценки типа распределения данных применяли анализ Колмогорова–Смирнова, при значениях p >0,05 распределение считали не отличающимся от нормального. Описательную статистику проводили с определением следующих особенностей: данные представляли в виде M±SD (M – среднее арифметическое, SD – стандартное отклонение) при нормальном распределении и в виде Me [Q1; Q3] (Me – медиана, Q1 и Q3 – первый и третий квартили) при ненормальном распределении. При нормальном распределении выборки при сравнении двух независимых выборок использовали критерий Стьюдента, а при отличии от нормального – критерии Манна—Уитни и χ2 или тест Левена с определением F. Также применялся логистический регрессионный анализ с расчетом относительных рисков (OR) и определением χ2, связь считалась статистически значимой при значении р <0,05. ROC-анализ с построением операционных характеристических кривых и расчетом коэффициента площади кривой (AUC) применялся для оценки прогностической информативности используемых методов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно полученным данным, у 24,8% больных ОКС было выявлено атеросклеротическое поражение ПА, при этом односторонний стеноз встречался у 58,8% пациентов, двусторонний — у 41,2%. При одностороннем поражении ПА средний процент стеноза составил 56,1%, тогда как при двустороннем поражении стеноз был более выраженным – 76,7% (р <0,05).
В ходе двухфакторного логистического регрессионного анализа в качестве одного фактора был выбран стеноз ПА или двухсторонний стеноз ПА, в качестве другого те признаки, которые ранее продемонстрировали свое влияние на риск развития сосудистых событий. Атеросклеротическое поражение ПА вместе с величиной ФВ или размером ЛП, ПЖ, а также толщиной МЖП влияли на риск развития нефатальных сосудистых событий (χ2=7,46, р=0,024; χ2=7,37, р=0,025; χ2=11,1, р=0,004; χ2=9,52 р=0,009 соответственно). Также обсуждаемый риск повышался в случае прироста ∆СКФ после проведенной КАГ, χ2=9,83, р=0,007 (табл. 1).
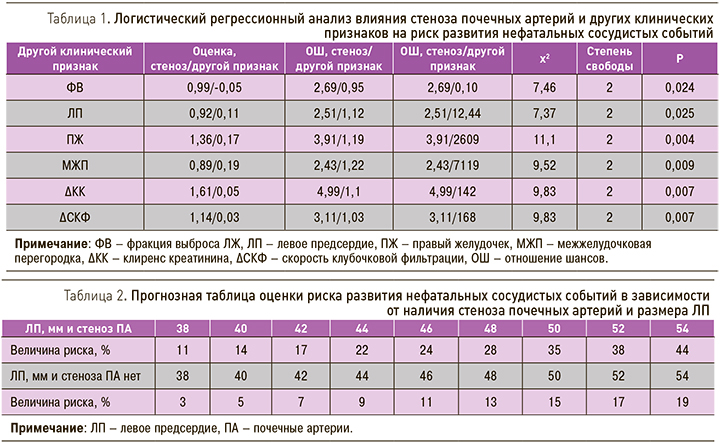
Полученные уравнения логистической регрессии позволили разработать прогнозные таблицы, одна из которых в качестве примера представлена в табл. 2.
Согласно полученным данным ЭхоКГ, было установлено, что при наличии стеноза ПА и размере ЛП=38 мм риск развития нефатальных сосудистых событий составил 11%, при размере ЛП=46 мм данный риск был равен 24%, в то время как у больных без поражения ПА – 3 и 9% соответственно. При значении ФВ ЛЖ=60% у обследованных пациентов с наличием стеноза ПА обсуждаемый риск был равен 17%, при значении ФВ ЛЖ=45% – 37%, при этом у больных без атеросклеротического поражения ПА эти показатели составили 6 и 21% соответственно.
При включении в таблицу риска таких факторов, как стеноз ПА и размеры ПЖ, вероятность развития нефатальных сосудистых событий может достигать 84%, в то время как у больных без поражения ПА этот показатель был существенно ниже и составил 63%. При анализе сердечно-сосудистого риска у пациентов с атеросклеротическим поражением ПА и толщиной МЖП=12 мм указанный риск равен 9%, у больных же без поражения – 5%, при толщине МЖП=20 мм – 28 и 15%.
В ходе работы было установлено, что среди пациентов с наличием стеноза ПА и ΔСКФ 60 мл/ мин/1,73м2 риск развития нефатальных сосудистых событий составил 57%, у больных же без поражения ПА – 14% (табл. 3).
Наличие двухстороннего стеноза ПА, а также размера ЛП, толщина МЖП, значения ОХС крови повышали риск развития фатальных сосудистых событий (табл. 4).
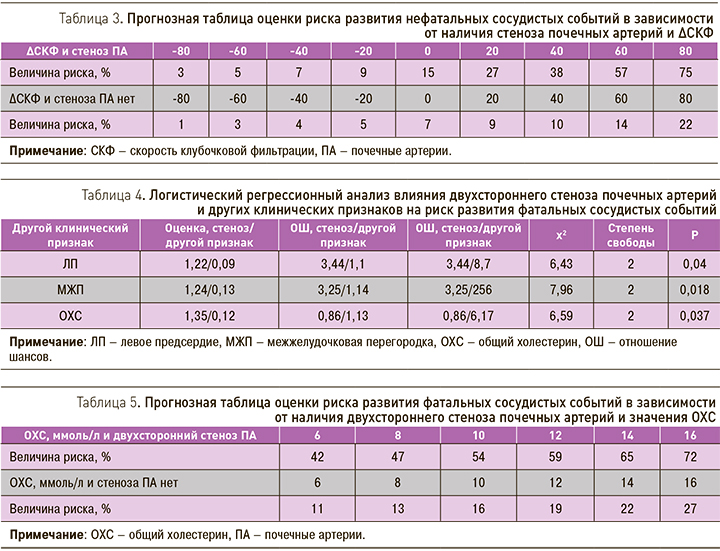
Так, риск развития фатальных сосудистых событий у пациентов с двусторонним стенозом ПА и значением ОХС 6 ммоль/л был равен 42%, у больных без стеноза ПА – 11% (табл. 5). В случае повышения значения ОХС до 10 ммоль/л обсуждаемый риск составляет 54 и 16% соответственно.
Также было установлено, что величина риска развития фатальных сосудистых событий у больных с двусторонним поражением ПА и размером ЛП=38 мм составила 36%, в то время как у пациентов без стеноза обсуждаемый риск существенно ниже – 10%.
Вероятность развития фатальных сосудистых событий у пациентов с двусторонним поражением ПА и толщиной МЖП=12 мм составила 28%, у больных же без стеноза ПА данный риск был равен 6%.
В ходе двухфакторного логистического анализа было установлено, что двухстороннее поражение ПА, а также такие факторы, как стадии ХБП (р=0,034, χ2=6,78), уровень СКФ до КАГ (р=0,0001, χ2=18,3), выраженность стеноза проксимального и дистального участков ПМЖВ (р=0,005, χ2=10,6) (р=0,027, χ2=7,2), оказывали влияние на риск развития фатальных и нефатальных сосудистых событий.
Анализ полученного фактического материала показал, что больные с двусторонним поражением ПА и ХБП 2 стадии имели риск развития фатальных и нефатальных сосудистых событий 32%, у пациентов без стеноза ПА обсуждаемый риск составил 12%.
Также было выявлено, что у больных с двусторонним поражением ПА и наличием гемодинамически значимого стеноза в проксимальном участке ПМЖВ данный риск был равен 63%, у пациентов же без поражения ПА обсуждаемый риск составил 8%. У больных с гемодинамически значимым поражением средней трети ПМЖВ и двусторонним стенозом ПА риск развития фатальных и нефатальных сосудистых событий был равен 49%, у больных без стеноза ПА – 7%.
Нами был проведен ROC-анализ, в ходе которого отдельно анализировали информативность инструментов прогнозирования по обсуждаемым выше конечным точкам: нефатальные сосудистые события, фатальные сосудистые события и фатальные/нефатальные сосудистые события. В отношении первой конечной точки комбинация признаков: наличие стеноза ПА, величина ФВ, размеры ЛП, ПЖ, толщина МЖП, ΔСКФ позволила повысить AUC до 0,78, увеличив чувствительность методики до 75%, сохранив при этом специфичность на уровне 70%.
ROC-анализ влияния факторов на фатальные сосудистые события показал более высокую информативность, чем в ходе обсуждаемого выше анализа. Совокупность таких факторов, как наличие двухстороннего стеноза ПА, размер ЛП, толщина МЖП и значение ОХС, позволила повысить AUC до 0,93, чувствительность метода до 82%, а специфичность до 95%.
Комбинированная точка: наличие двухстороннего стеноза ПА, стадии ХБП, выраженность стеноза проксимальной и средней ПМЖВ показала AUC, равную 0,92, при этом чувствительность метода была равна 90%, а специфичность – 90%.
В литературе имеются противоречивые данные о частоте ИБС и сопутствующего атеросклеротического стенозирующего поражения ПА. В целом у лиц старше 65 лет стеноз ПА наблюдается в 6,8% случаев (у мужчин в 9,1%, у женщин в 5,5%). При этом содружественное поражение почечных артерий наблюдается при коронарном атеросклерозе у больных с ИБС в 35–55% случаев, при атеросклерозе периферических артерий нижних конечностей в 22–59% случаев. В 19–29% случаев всех атеросклеротических стенозов ПА они бывают двусторонними [9].
Согласно проведенному исследованию, у 24,8 % обследованных пациентов ОКС встречалось атеросклеротическое поражение ПА.
Смерть, обусловленная сердечно-сосудистыми заболеваниями, в 10–20 раз чаще встречается среди больных с ХБП, чем в популяции, а вероятность развития сердечно-сосудистых осложнений в 25–100 раз выше, чем риск терминальной почечной недостаточности. Одной из разновидностей ХБП является ИБП, основной причиной развития которой является атеросклеротический стеноз ПА [6].
Наличие атеросклеротического поражения ПА и, как следствие, снижение СКФ является независимым фактором риска развития ССЗ и рассматривается в качестве маркера неблагоприятного прогноза сердечно-сосудистых событий [5]. В ходе работы было установлено, что среди больных со стенозом ПА и ΔСКФ=60 мл/мин/1,73м2 риск развития нефатальных сосудистых событий составил 57%, у больных же без поражения ПА – 14%.
Наиболее эффективным инструментом прогнозирования сердечно-сосудистого риска является комплексный подход к выявлению всех существующих ФР у каждого больного ОКС, опираясь не только на оценку традиционных ФР и маркеров почечной дисфункции, усугубляющих течение основного заболевания, но и определение индивидуальных особенностей поражения коронарного кровотока. Атеросклеротическое поражение ПМЖВ ЛКА в проксимальной трети ассоциируется с большим риском смерти по сравнения с атеросклеротическим процессом в ПКА или в дистальной трети ПМЖВ ЛКА [4].
Так, отмечено, что у пациентов с двусторонним поражением ПА и наличием гемодинамически значимого стеноза в проксимальном участке ПМЖВ риск развития фатальных и нефатальных сосудистых событий был равен 63%, у пациентов же без поражения ПА обсуждаемый риск составил 8%. У больных с поражением средней трети ПМЖВ и двусторонним стенозом ПА риск развития фатальных и нефатальных сосудистых событий достигал 49%, у больных без стеноза ПА – 7%.
ВЫВОДЫ
Выявлена широкая распространенность атеросклеротического поражения ПА у пациентов с ОКС.
Установлено влияние атеросклеротического стеноза ПА в комплексе с другими факторами у пациентов исследуемой группы на риск развития фатальных и нефатальных сосудистых событий.
Предложенная в ходе исследования модель прогнозирования является самостоятельным инструментом оценки риска развития сосудистых событий у больных ОКС и атеросклеротическим поражением ПА и может широко использоваться в комплексном обследовании данной категории пациентов.



